巨噬细胞移动抑制因子经Rho途径促进人肺成纤维细胞Ⅰ型胶原合成*
陈培芬 罗雅玲 赖文岩 邢晓雯 谭家余 骆子义 邱智辉
1 广东省深圳市第三人民医院内科 5180114; 2 南方医科大学附属南方医院呼吸科3 心内科实验室; 4 广州医学院附属第一医院心内科
气道重塑是哮喘具有特征性的病理改变之一。哮喘患者增厚的基底膜层主要是由Ⅰ、Ⅲ、Ⅴ胶原纤维和成肌纤维细胞产生的纤维连接蛋白组成[1]。Ⅰ型胶原的沉积促使管壁增厚和僵硬,被认为是早期气道重塑的重要指标[2]。巨噬细胞移动抑制因子(macrophage MIg ration inhib itory facto r,MIF)是体内一种重要的多功能细胞因子,具有促炎、免疫调节等功能。循环血中的嗜酸性粒细胞在佛波酯或白介素-5的刺激下可分泌MIF[3]。国外的研究提示MIF在哮喘气道炎症中起重要作用[4,5]。新近的研究提示MIF在气道重塑中起重要作用[6],但具体机制未明。本研究探讨了MIF在人胚肺成纤维细胞Ⅰ型胶原合成中的作用及其途径以初步探讨其在气道重塑中的机制。
1 材料和方法
1.1 材料与试剂 M RC-5细胞株购自中国科学院上海细胞生物学研究所;DM EM培养基为Gibco公司产品;胎牛血清购自PAA公司;recombinan t MIF(rMIF)、TGF-β1ELISA试剂盒购自 R&D 公司;T rizo lRNA抽取试剂为Invitrogen公司产品,逆转录试剂盒购自 Fermen tas生物技术有限公司;PCR引物由上海英骏公司合成;鼠抗人Ⅰ型胶原抗体购自San ta Cruz;H RP-兔抗鼠IgG(Ⅱ抗)购自北京博奥森生物技术有限公司;Rho激酶抑制剂Y27632购自BioSource公司。
1.2 方法
1.2.1 细胞培养及分组。M RC-5细胞培养于加入10%胎牛血清的DM EM 培养液中,放置于37℃、5%CO2培养箱中。实验分为实验组和对照组,实验组分别加入100μg/L的 rMIF。
1.2.2 RT-PCR方法检测Ⅰ型胶原m RNA的表达。使用6孔板,对照组和实验组孵育完成后收集细胞,T rizol提取总RNA,用紫外分光光度计检测纯度。反应分2步进行:取5μl总RNA,在M-M LV逆转录酶作用下合成DNA;再取1μl逆转录产物进行PCR扩增反应。Ⅰ型胶原上游引物为5'-GCTGGCTACTTCTCGCTCTG-3',下游为5'-AGCAGT TGGAGGCTGTGGG-3',产物大小267 bp;GAPDH上游引物为5'-ACCACAGTCCATGCCA TCAC-3',下游引物:5'-TCCACCACCCTGTTGCTG TA-3',产物大小450 bp。PCR反应条件:94℃预变性 5 MIn,94℃ 1MIn,53℃ 45s,72℃1MIn,进行36个循环,最后72℃延伸10MIn。每一PCR反应重复3次。PCR产物经2%琼脂糖凝胶电泳分离,紫外透射反射仪观察扩增产物的大小及亮度并摄影。使用IPP 6.0图像分析软件对扩增条带进行分析,以平均灰度值代表相应基因的表达量,并除以GAPDH灰度值,所得数值作为各扩增产物m RNA的相对表达量。
1.2.3 Western b lo tting检测Ⅰ型胶原蛋白表达。用预冷PBS洗细胞3次,加入200μl蛋白裂解液,刮起细胞,4℃12 000×g离心15MIn,吸取上清,BCA法测定总蛋白浓度。取 40μg的上述样品加样至15%的SDS-PAGE凝胶,电泳,待溴酚蓝接近凝胶底部时停止电泳,用转移缓冲液把凝胶上蛋白质转移至硝酸纤维膜上,膜在室温下用5%脱脂奶粉封闭液封闭1h,加入1∶500稀释的鼠抗人Ⅰ型胶原抗体及β-actin单克隆抗体于4℃孵育12h,然后加辣根过氧化物酶标记的Ⅱ抗(1∶10 000)室温孵育1h,TBST洗膜后用ECL液显影,以β-actin为内参照,用IPP6.0图像分析软件对Ⅰ型胶原蛋白进行半定量分析。
1.2.4 EL ISA法检测培养上清中TGF-β1蛋白表达。取对数生长期M RC-5细胞1×103个接种于6孔板中,培养24h;换无血清培养基,继续培养24h,使细胞进入生长静止期;吸弃各孔培养基,换为终浓度为100μg/L rMIF的含10%胎牛血清的DM EM 2m l,分别培养 6、12、24、28h;分别收集细胞培养上清液,4℃下3 000×g离心10MIn,收集上清。按试剂说明书测定TGF-β1蛋白浓度。
2 结果
2.1 培养的M RC-5形态 如图1所示,光镜下见M RC-5细胞生长旺盛,分布密集,多呈长梭形、细胞走向趋于一致,近于排列,并有一定的弧形。高倍镜下可见长梭形细胞的细胞体饱满、有2~3个扁平而长的突起,细胞核较大,呈卵圆形且多居中。

图1 人肺成纤维细胞M RC-5(×100)
2.2 rMIF对M RC-5培养上清 TGF-β1蛋白浓度的影响 如图 2、表 1所示,与同一时间点未加rMIF的对照组比较,100μg/L的rMIF刺激M RC-5细胞 6h、12h、24h、48h 后,细胞培养上清中的TGF-β1浓度无显著变化(P>0.05)。

图2 rMIF(100μg/L)刺激M RC-5细胞后不同时间点细胞培养上清 TGF-β1浓度(pg/m L)(±s,n=6)
2.3 100μg/L rMIF刺激促进M RC-5细胞Ⅰ型胶原m RNA转录,拮抗Rho激酶抑制此促进作用如图3所示,100μg/L的rMIF刺激48h后,M RC-5细胞Ⅰ型胶原m RNA合成显著增加(P<0.01);Rho拮抗剂预刺激后,rMIF促进Ⅰ型胶原m RNA合成能力显著减弱(P<0.01)。
表1 rMIF(100μg/L)刺激 MRC-5细胞后不同时间点细胞培养上清TGF-β1浓度(pg/m L)(±s,n=6)
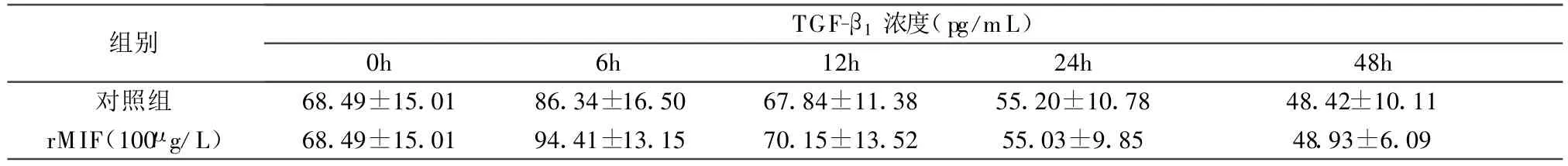
表1 rMIF(100μg/L)刺激 MRC-5细胞后不同时间点细胞培养上清TGF-β1浓度(pg/m L)(±s,n=6)
注:与对照组比较,P均>0.05。
组别TGF-β1浓度(pg/m L)0h 6h 12h 24h 48h对照组 68.49±15.01 86.34±16.50 67.84±11.38 55.20±10.78 48.42±10.11 rMIF(100μg/L) 68.49±15.01 94.41±13.15 70.15±13.52 55.03±9.85 48.93±6.09
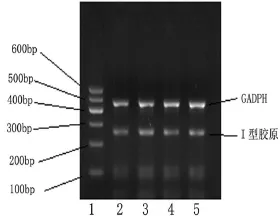
图3 Y27632对rMIF刺激的 MRC-5细胞Ⅰ型胶原mRNA表达的影响
2.4 100μg/L rMIF刺激促进M RC-5细胞Ⅰ型胶原蛋白合成,拮抗Rho激酶抑制此促进作用 如图4所示,100μg/L的rMIF刺激48h后,M RC-5细胞Ⅰ型胶原蛋白合成显著增加(P<0.01);Rho拮抗剂预刺激后,rMIF促进Ⅰ型胶原蛋白合成能力显著减弱(P<0.01)。

图4 Y27632对rMIF刺激的M RC-5细胞Ⅰ型胶原蛋白表达的影响
3 讨论
MIF既是一种细胞因子,又是一种源于垂体的激素,还可作为糖皮质激素生理活动的负反馈调节剂,具有广泛的生物学功能的细胞因子。MIF可促进血管平滑肌细胞合成Ⅰ、Ⅲ型胶原m RNA和Ⅰ型胶原蛋白,参与高血压血管重构[7],与动脉内膜增厚有关[8]。Sasaki等[9]发现MIF还可促进肾小球纤维化形成。提示MIF在胶原合成和器官纤维化中具有重要作用。以MIF拮抗剂ISO-1治疗慢性哮喘小鼠,可减轻气道重塑,提示MIF在气道重塑中起重要作用[6]。但MIF如何参与该过程,机制未明。
成纤维细胞(fib rob last,FB)气道黏膜下的主要结构细胞之一,其产生的胶原纤维、弹性纤维和网状纤维等沉积于基底膜,使气道壁进一步增厚。哮喘患者增厚的基底膜层主要是由Ⅰ、Ⅲ、Ⅴ胶原纤维和成肌纤维细胞产生的纤维连接蛋白组成[1]。Ⅰ型胶原的沉积促使管壁增厚和僵硬,与α-平滑肌肌动蛋白一起被认为是早期气道重塑的重要指标[2]。因此作者探讨了MIF与Ⅰ型胶原合成之间的关系。本研究结果表明,rMIF可促进Ⅰ型胶原m RNA和蛋白合成。这提示MIF可能通过促进成纤维细胞Ⅰ型胶原合成而参与哮喘的气道重塑。MIF导致M RC-5细胞Ⅰ型胶原表达增多的机制尚不清楚。最近发现,MIF可激活Rho激酶途径[10]。在调控血管紧张素Ⅱ刺激大鼠心肌成纤维细胞增殖与胶原合成中,Rho激酶具有重要作用[11]。Rho相关卷曲螺旋形成蛋白激酶(Rho associated coiled coil forMIng pro tein kinase,ROCK)是Rho蛋白的下游靶效应分子之一。Y 27632是在细胞生物学和药理学研究中广为应用的ROCK抑制剂。本研究在rMIF刺激M RC-5细胞前预先用Y 27632处理,观察其对rMIF促进Ⅰ型胶原合成中的影响。结果显示,rMIF诱导M RC-5细胞Ⅰ型胶原合成的能力可被Y27632所抑制。由于Y 27632只特异性作用于Rho激酶,因此本结果提示Rho激酶信号通路可能参与了rMIF诱导的M RC-5细胞Ⅰ型胶原合成。
TGF-β1是一个很重要的促纤维化细胞因子,在哮喘气道重塑中起重要作用。哮喘患者气道TGF-β1表达增加,与病情的严重程度和上皮下纤维化程度相关[12]。TGF-β1可诱导鼠成纤维细胞向成肌纤维细胞转化[13],增加胶原Ⅰ和Ⅲ合成而引起肺纤维化[14]。H o lgate等报道TGF-β1可促进成纤维细胞增殖、胶原合成、细胞外基质积聚及向肌成纤维细胞表型分化[15,16]。在人细胞上,Batra等[17]的研究提示TGF-β1的促纤维化机制是通过提高成纤维细胞生长、胶原产生和促进成纤维细胞转化成成肌纤维细胞以产生更多的胶原和细胞外基质等而实现的。本研究也探讨了rMIF刺激M RC-5细胞后TGF-β1的表达。结果显示,100μg/L的 rMIF刺激 6h、12h、24h、48h后,细胞培养上清中的 TGF-β1浓度无显著变化。这提示 rMIF诱导M RC-5细胞胶原合成可能与TGF-β1的作用无关。之前笔者在哮喘小鼠肺中观察到 TGF-β1表达增加,拮抗MIF可使小鼠TGF-β1表达下调[6],与本实验结果不大一致。究其原因有:(1)rMIF未影响到M RC-5细胞培养上清中TGF-β1蛋白水平,但未必不影响其m RNA和细胞内蛋白水平,应进一步检测上述2个指标;(2)巨噬细胞、上皮细胞、成纤维细胞和EOS均能分泌TGF-β1。rMIF对M RC-5分泌TGF-β1无影响,但不能除外影响巨噬细胞、上皮细胞、EOS等分泌 TGF-β1进而影响了哮喘小鼠肺TGF-β1的表达;(3)体内实验和体外实验的差别。究竟何种原因所致有待进一步研究。
总之,MIF可能通过Rho途径刺激成纤维细胞胶原Ⅰ型合成从而在哮喘气道重塑的发病机制中发挥重要作用。
[1] Elias JA,Zhu Z,Chupp G,eta l.A irwayremodeling in asthma〔J〕.JClin Invest,1999,104(8):1001-1006.
[2] Davies DE,Wicks J,Pow ell RM,et al.Airway remodeling in asthma:new insights〔J〕.J A llergy Clin Immunol,2003,111(2):215-225.
[3] Rossi AG,H aslett C,HiraniN,eta l.Human circu lating eosinophils secrete m acrophage MIgration inhibitory factor(MIF)〔J〕.JClin Invest,1998,101(12):2869-2874.
[4] Am ano T,Nishihira J,Miki I.Blockade of macrophage migration inhibitory factor(MIF)prevents the antigen-induced response in a murine model of allergic airway inflammation 〔J〕.In flamm Res,2007,56(1):24-31.
[5] MIzue Y,Ghani S,Leng L,eta l.Role ofmacrophage MIgration inhibitory factor in asthma〔J〕.Proc NatlAcad SciUSA,2005,102(40):14410-14415.
[6] Pei Fen C,Yaling L,WeiW,et a l.ISO-1,an MIF antagonist,inhibitsair way remodeling in am urinemodel of chronic asthma〔J〕.Molecular M edicine,2010,16(9-10):400-408.
[7] LI J,LIN SG,YU XY,et al.Effects of macrophage MIgration inhibitory factor on collagenⅠandⅢm RNA expression in vascu lar smooth muscle cells in vitro〔J〕 .Journal of First Military Medical University,2005,25(6):684-686.
[8] Korshunov VA,Nikonenko TA,Tkachuk VA,et al.Interleukin-18 and macrophage MIgration inhibitory facto r are associated with increased carotid intima-m edia thickening 〔J〕.A rterioscler Thromb Vasc Biol,2006,26(2):295-300.
[9] Sasaki S,Nishihira J,Ishibashi T,et al.Transgene of MIF inducespodocy teinjury and progressivemesangialsclerosis in the mouse kidney 〔J〕.Kidney Int,2004,65(2):469-481.
[10] Sw ant JD,Rendon BE,Sym ons M,et al.Rho GTPase-dependent signaling is required for macrophage MIgration inhibitory factor-mediated exp ression of cyclin D1 〔J〕.J Biol Chem,2005,280(24):23066-23072.
[11] Wang XH,W u W,Yang J,et a l.Roles of Rho-kinase in rat cardiac fib roblasts proliferation and collagen synthesis induced by angiotensin Ⅱ 〔J〕.Chinese Journal of Pathophysiology,2007,23(6):1098-1110.
[12] Leung JC,Chan LY,Tsang AW,et a l.Anti-macrophage MIgration inhibitory factor reduces transforMIng g row th factorbeta1 expression in ex perimental IgA neph ropathy 〔J〕.NephrolDial Transplant,2004,19(8):1976-1985.
[13] YokozekiM,Moriyama K,Shim okawa H,et al.Transforming grow th factor-beta1 modulates myofibroblastic phenotype of rat palatal fibroblasts in vitro〔J〕 .Exp Cell Res,1997,231(2):328-336.
[14] Kenyon NJ,Ward RW,Mc Grew G,et al.TGF-beta1 causes airway fibrosis and increased collagen Iand IIImRNA inMIce〔J〕.Thorax,2003,58(9):772-777.
[15] Holgate ST.Epithelialdamage and response〔J〕.Clin Exp Allergy,2000,30(Suppl 1):37-41.
[16] Zhang S,Smartt H,Holgate ST,etal.G row th factors secreted by bronchial epithelial cells con trol myofibroblast proliferation:an in vitro co-cu lturemodel of airway remodeling in asthma〔J〕.Lab Invest,1999,79(4):395-405.
[17] Lee CG,Homer RJ,Zhu Z,eta l.Interleukin-13 induces tissue fibrosis by selectively stimulating and activating transforming g row th factor beta〔J〕.JExp Med,2001,194(6):809-821.

