水产养殖用水生物脱氮技术的初步探索
伦艳霞 (天津市海纳德动物药业有限公司 天津300456)
随着人们对水产品需求的增加,水产养殖业从传统的养殖模式向集约化、工厂化模式转变。在集约化养殖模式中,大量人工饲料的投喂、有机肥料的施加、水产养殖动物排泄的粪便、死亡动植物的残骸构成了水体中有机物来源的主体,进而使水体的理化条件不断恶化。水体中氮素含量超标,并积累了大量的氨氮、亚硝酸盐等有害物质,最终给养殖户造成巨大的经济损失。[1-2]生物脱氮技术以其无污染、脱氮彻底和安全等优点被认为是目前最经济、有效、可行性高的水体除氮技术。[3-4]
本实验通过定向富集,从天津静海县某一常年养殖池塘中分离得到一株具有高效降解亚硝态氮能力的反硝化细菌,并在实验室条件下,对该菌株的天然养殖水体中的反硝化特性进行了研究,为在生产实践中开发应用反硝化细菌提供了有益的指导。
1 材料和方法
1.1 菌种分离
从天津静海县某一常年养殖池塘中采集水样,取1 mL水样加入到装有100 mL灭菌液的富集培养基中,置30℃、130 rpm环境中富集培养3~4天,待培养基浑浊;取1 mL培养液进行梯度稀释,将稀释液分别涂布于溴百里酚培养基(BTB培养基),置30℃环境中培养1~2天,用接种环挑取不同形态单菌落于新的富集培养基中置30℃、130 rpm环境中震荡过夜培养。重复划线培养2~3次,直至平板菌落形态单一,无其他形态的菌落为止。挑选产气快、气泡多的菌株,进一步检测培养基中亚硝态氮和总氮的含量。筛选一株产气快、可迅速降解亚硝态氮和总氮的菌株进行实验。
1.1.1 菌体形态和生理、生化鉴定依据文献[5]进行。
1.1.2 反硝化活性检测。挑取单菌落于反硝化培养基中过夜培养,按1%的接种量(前培养物OD600 nm为1)接种到装有100 mL含有1.98 mg/L亚硝态氮的LB培养基中,置30℃,静置密闭培养。第2天重新补加亚硝态氮至6.74 mg/L,继续培养。每隔一定时间(2 h)取样,测定培养基中剩余的C(NO2-)及菌体的浊度。
1.1.3 筛选出的菌株在天然养殖水体中的反硝化特性。
1.2 水样采集
2010年7月8日从天津静海县某一养殖池塘于早上5~6点采集水样;pH值为7.9,硝态氮浓度约为4.21 mg/L;亚硝态氮浓度约为0.08 mg/L;化学耗氧量COD为19.81~21.50 mg/L。
1.3 反硝化活性检测
水样经脱脂棉过滤后分为两份:一份加入NaNO2作为富含亚硝态氮的水样;另一份加入NaNO2和KNO3作为同时富含两种氮素的水样,加入最适合的碳源(0.2 g/L乙醇),使其中的碳氮摩尔比达到10∶1,分装于500 mL的血清瓶中。按1%的量加入纯培养后的菌株,培养72 h后检测水样中硝酸盐和亚硝酸盐的含量。以不加菌的水样作为对照。另一组不加碳源的水样,考察碳源对菌株反硝化活性的影响。亚硝酸盐采用N-(1-萘基)-乙二胺光度法;硝态氮采用紫外分光光度法测定;总氮采用碱性过硫酸钾法;CODMn采用酸性高锰酸钾法;菌体量采用浊度法和平板计数法。
1.4 碳氮摩尔比试验
水样过滤后,加入不等量的最适合碳源(0.2 g/L乙醇),使其碳氮摩尔比分别为4.6∶1,8∶1,12∶1。按1%的量接入菌体,每天定时取样,检测水样中的亚硝酸盐的含量。
1.5 接菌量试验
水样过滤后,接入不等量的菌体,使菌浓度分别为3.0×106CFU/L、3.0×107CFU/L、3.0 ×108CFU/L、3.0 ×109CFU/L,72 h后检测水样中亚硝态氮含量。
2 结果与讨论
2.1 菌株的分离与鉴定
经过富集、筛选和纯化,得到一株在接种后72 h即产生大量气泡、迅速降解亚硝态氮和总氮的菌株。该菌株为革兰氏阳性菌、产芽孢,可进行葡萄糖发酵,接触酶阳性,7%NaCl中生长,可水解淀粉和酪素,初步鉴定该菌株为芽孢杆菌属。
2.2 菌株在天然养殖水体中的反硝化特性
2.2.1 反硝化活性检测 从表1中可以看出,由于硝态氮可以同时作为微生物生长的营养盐和反硝化的电子供体被利用,所以无论是否添加碳源,水样中的硝酸盐都有一定程度的下降,未发生积累。对照水样中的氮素含量在两种情况下无明显变化,说明水样自身所含有的微生物不具有显著的反硝化能力,不会对实验结果产生干扰。
接菌水样在未添加碳源时,亚硝态氮的浓度由6.04 mg/L上升到6.31 mg/L,表明水样中发生了微弱的反硝化作用。说明天然水样中虽然含有一定量的有机质,但它们主要是一些未被降解的或较难生物降解的有机物,难以被反硝化细菌作为碳源利用。添加碳源时,投菌水样中的亚硝态氮降到了0.007 4 mg/L,几乎被完全降解,降解速率达到0.1 mg/(L·h),同时血清瓶中检测到有N2O产生。说明当可利用碳源充足时,典型的养殖水环境即可满足菌株进行高效反硝化作用的要求,使亚硝态氮转化为含氮气,彻底脱离水体。这对于治理养殖水体的亚硝态氮污染是非常有利的。
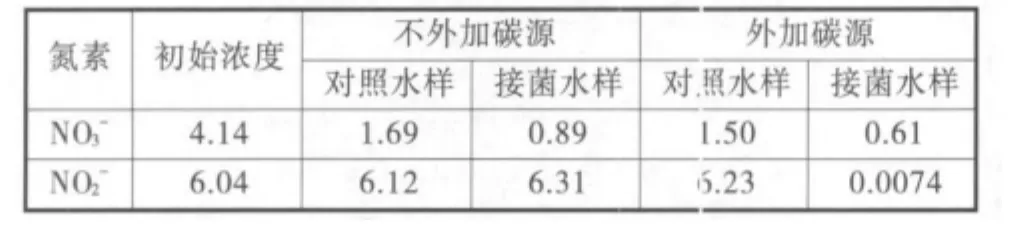
表1 菌株在富含亚硝态氮的天然养殖水体中的反硝化活性
从表2中可以看出,不添加碳源时,投菌水样中的硝态氮含量由43.20 mg/L下降到35.66 mg/L,而亚硝态氮含量由6.04 mg/L上升到10.36 mg/L。说明当水体同时富含这两种氮素时,菌株优先利用硝态氮作为反硝化电子的供体,即硝酸盐的还原先于亚硝酸盐的还原。当在水样中添加乙醇时,硝态氮浓度降为2.25 mg/L,亚硝态氮浓度降为0.17 mg/L,降解率分别达到94.79%和97.75%。说明菌株虽然是采用亚硝酸盐定向富集得到的,但它依然具有完整的反硝化酶系,且其硝酸盐还原酶活性相当高。
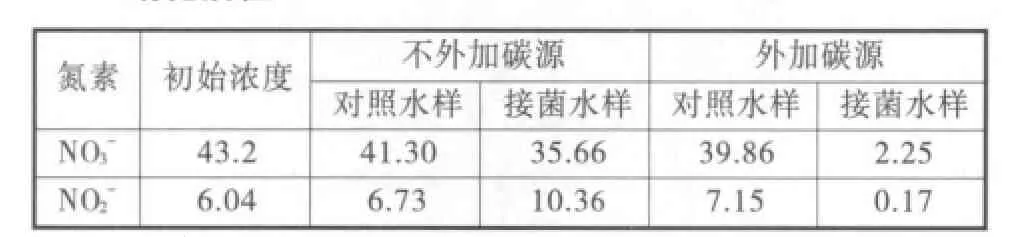
表2 菌株在富含硝态氮和亚硝态氮的天然养殖水体中的反表2 硝化活性
两次实验结果表明该菌株不仅可应用于富含亚硝态氮的水体,在同时富含硝态氮和亚硝态氮的水体中也可快速将两种氮素除去,具有广泛的适用性。
2.2.2 碳氮摩尔比对反硝化作用的影响 水体中的C、N摩尔比是影响脱氮系统除氮效果的一个重要因素。无氧条件下,反硝化作用所需碳与硝态氮和亚硝态氮之和的理论比值为4.6∶1;在Bardenpho工艺中,为达到充分脱氮,COD/TKN应大于10.0~11.1。丹麦的一些研究确定COD/TKN应大于8.3~12.5。[6-8]当碳氮摩尔比为4.6∶1时,水样中亚硝态氮含量随着接菌时间的增加逐渐升高;碳氮摩尔比为8.0∶1和12.0∶1的水样,变化趋势比较一致。在接菌的第2天亚硝态氮浓度达到一个极值,第3天迅速降到了最低,之后的10天亚硝态氮一直都维持在最低浓度,血清瓶中检测到有N2O生成。这表明菌株在处理试验所用水样时,碳氮比为8.0∶1时即可达到良好的脱氮效果。
2.2.3 投菌浓度试验 天然水体中存在着相当数量的土著微生物,它们和试验投加的菌体存在着相互竞争的关系。为了确保所投加的微生物能在天然水体中发挥应有的反硝化作用,有必要从实际应用的可操作性出发,确定合适的投菌浓度。
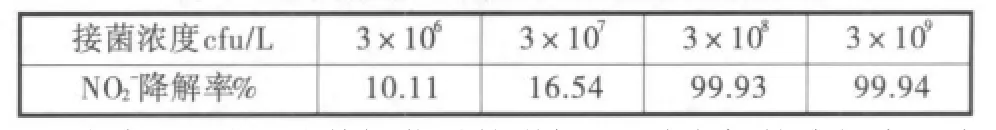
表3 接菌浓度对菌株反硝化特性的影响
由表3可知,随着投菌量的增加,亚硝态氮的降解率逐渐升高;当投菌浓度达到108CFU/L时,菌株即可在水体中发挥高效的反硝化作用。采用LB培养基,对天然水样中的可培养中温细菌进行计数,测得微生物浓度约为1.12×108cfu/L。在这种培养条件下,淡水中仅有约0.25%的微生物可被检测到,[9]说明水样中实际的微生物浓度要远远大于108cfu/L,即试验投加的菌体数量要远远小于土著微生物,表明该菌株在天然水体中具有较强的生存能力和环境适应能力。
目前该菌株已在国内多个池塘养殖水进行了试验,均取得了良好的脱氮效果。芽孢杆菌具有很强的生命力和旺盛的繁殖能力,易于生产、运输和保藏,能适应各种不良的环境条件,因此该菌株具有开发成微生态制剂,应用于污染水体生物脱氮的巨大潜力,前景十分广阔。■
[1]胡家文,姚维志.养殖水体富营养化及其防治 [J].水利渔业,2005,25(6):74-76.
[2]魏泰莉,余瑞兰,聂湘平,等.水中亚硝酸盐对彭泽鲫血红蛋白及高铁血红蛋白的影响[J].大连水产学院学报,2001,16(1):67-71.
[3]李军,杨秀山,彭永臻.微生物与水处理[M].北京:化学工业出版社,2002:378-380.
[4]M oreno B,G ómezM A,G onzález2López J,et al.Inoculation ofa submerged filterforbiologicaldenitrification ofnitrate pollutedgroundw ater:a comparative study[J].J H azard M ater,2005,117(2-3):141-147.
[5]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:62-65.
[6]郑平,徐向阳,胡宝兰.新型生物脱氮理论与技术[M].北京:科学出版社,2004:55-74.
[7]张光亚,陈美慈,韩如易,等.一株异养硝化细菌的分离及系统发育分析[J].微生物学报,2003,43(2):156-159.
[8]傅利剑,郭丹钊,史春龙,等.碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J].农村生态环境,2005,21(2):42-45.
[9]叶姜瑜,罗固源,吉芳英,等.污水生物处理功能微生物的多样性[J].重庆大学学报(自然科学版),2005,28(10):119-123.

