SIRT2对脑缺血再灌注损伤后神经保护作用及机制研究
郑超波, 江静雯, 殷卫海 刘建荣
很多蛋白的生物学活性可以被可逆的翻译后的修饰来协调[1]。近年来,蛋白赖氨酸e-氨基的乙酰化在调控细胞内的一些关键的生物学功能作用受到广泛关注[2,3]。目前研究证实参与去乙酰化和乙酰化调控的酶分别只有组蛋白脱乙酰基酶(HDACs)和组蛋白乙酰转移酶(HATs)[2,4]。其中 Sirtuins 是一种以NAD为辅酶的比较特殊的去乙酰化酶,Sirtuins蛋白共有7种(SIRT1-7),每种都有1个由275个氨基酸组成的催化核心区域,SIRT2主要表达在细胞质中,但是在细胞分裂的G2/M期可以进入细胞核中使得组蛋白H4脱乙酰基从而调控细胞分裂周期[5,6]。虽然 SIRT2是一种组蛋白脱乙酰基酶,但其底物也可以是其他的一些蛋白如P53、FOXOs和NF-κB等。在氧化应激和炎症刺激下,SIRT2可以分别通过对Foxo3a和NF-KB脱乙酰基来减少细胞在应激下引起的损伤[7,8],并且有研究指出在双氧水刺激后,AGK-2可以加重PC12细胞内ATP值的下降[9],炎症、氧化应激和细胞内ATP值下降是脑缺血再灌注损伤的重要病理过程,因此SIRT2在脑缺血中可能存在神经保护的作用。在本次实验中利用缺血再灌注损伤小鼠模型来观察缺血前后皮质中SIRT2蛋白水平的变化,并探讨SIRT2在脑缺血再灌注损伤中的作用及其相关机制。
1 材料与方法
1.1 实验动物分组 选择成年健康雄性CD1小鼠86只,体重25~30g,由中国科学院上海实验动物中心(斯莱克实验动物有限公司)提供。实验第1部分将小鼠随机分为假手术对照组15只,缺血再灌注组33只,即缺血60min,再灌注6h 6只,12h 12只,24h 15只;实验第2部分小鼠随机分为DMSO组 6只,AGK-2(2.5mmol/L)组 6只,AGK-2(5mmol/L)组6只;第3部分小鼠随机分为假手术组5只,DMSO组5只,AGK-2(2.5mmol/L)组5只,AGK-2(5mmol/L)组5只。
给药途径和方法:参考细胞中AGK-2给药的方法[9]术前给予左侧侧脑室定位注射不同浓度(2.5mmol/L、5.0mmol/L)AGK-25μl,对照组给予 DMSO 5μl,侧脑室坐标参考小鼠解剖图谱定位于前囟后0.7mm,旁开 1.5mm,进针2.0mm,给药后即给予手术。
1.2 脑缺血再灌注损伤(t-MCAO)模型的制作
1.2.1 栓线的处理 将6-0栓线(Dermalon,0.12mm,美国)的尖头靠近高温烧灼器(Bovie,美国)烧成圆头,切割1.5cm,然后将栓线伸入含有硅橡胶的 PE-10(BD,I.D.0.28mm)管中,包裹长度约2.0mm,沾有硅橡胶的线拴直径约为0.25mm,自然晾干。
1.2.2 手术过程 手术参考既往文献介绍的方法[10]将线栓从颈外动脉处逆行插向颈总动脉的分叉处,再将线栓转至颈内动脉腔,动作轻缓地将线栓小心经颅内段颈内动脉插入至感到轻微阻力,进线深度为0.9±0.05cm,用套线将线栓固定在颈外动脉残端,60min后拔出线栓。手术过程保持小鼠的体温在37±0.5℃。将线栓阻塞后血流降低至线栓阻塞前血流的20%以下,60min拔出线栓后血流上升至阻塞前血流的80%以上的小鼠为手术成功模型做后继的实验。动物苏醒后表现为提尾时右侧前肢内收屈曲、同侧Horner征、爬行时向右划圈;站立时右侧倾倒,凡有上述4项体征者列入研究对象。假手术对照组小鼠仅进行颈部血管分离和颈外动脉结扎。
1.3 Western blot法检测 处死小鼠后,断头取脑,在动物显微镜下分离缺血侧皮质,放入1.5ml的EP管中,随后加入RIPA,Cocktail,PMSF抽提总蛋白,用BCA法测定蛋白浓度,随后进行电泳。电泳时用5%浓缩胶,10%的分离胶,电压首先用50V,待指示条带越过浓缩胶后将电压调制120V,指示带到达分离胶底部时终止电泳,随后取胶转膜,半干转13V 20min,用5%的脱脂牛奶常温封闭1h,TBST×3次每次15min,加入多克隆一抗(SIRT2:兔抗小鼠,1∶300,Santa Cruz;Actin:羊抗小鼠,1∶1000,Santa Cruz)4℃摇晃过夜,TBST×3次 每次15min,加入二抗(羊抗兔,1∶5000,Beyotime;兔抗羊,1∶5000,Beyotime)常温下摇晃 1h,TBST ×3 次每次15min,随后在膜表面加入化学发光底物(1∶1混合,Thermo),1min后在化学发光检测系统中显影(Bio-rad)。
1.4 RNA 检测
1.4.1 组织中RNA提取 处死小鼠后,断头取脑,在动物显微镜下分离缺血侧皮质和纹状体,分别放入1.5ml的 EP管中,加 Trizol试剂,每100mg组织对应1ml Trizol混匀,4℃离心(12000r/min×10min),取上清液加入 200μl氯仿,混匀,4℃离心(12000r/min×15min),取上清液加入等体积异丙醇,摇匀,室温静置10min,4℃离心(12000r/min×10min),白色沉淀即为mRNA。弃上清,用1ml 75%乙醇洗 mRNA,4℃离心(7500r/min×5min),弃上清,生物安全柜开风机晾干沉淀,每管加20ml的DEPC(diethypyrocarbonate,焦碳酸二乙酯)水溶解。分光光度计OD260/280测总RNA浓度,-70℃冻存。
1.4.2 逆转录cDNA 引物序列 SIRT2 F:5’-GCCTGGGTTCCCAAAAGGAG-3’ R:5’-GAGCGGAAGTCAGGGATACC-3’;内参 GAPDH F:5’-CCTTCATTGACCTCAACTAC-3’R:5’-GGAAGGCCATGCCAGTGAGC-3’。均由上海生工生物工程公司合成。以前面提取的总RNA为模板,Oligo(dT)18为引物,Quant qRT-PCR(SYBR Green I)Kit进行逆转录反应,严格按说明书操作程序执行,获得的反应产物(cDNA)置入-20℃冰箱保存,待下一步实验使用。
1.4.3 Real-time PCR 反应 在 200μl的灭菌离心管中加入:(25ml反应体系)模板cDNA 0.5μl,上游引物 0.5μl,下游引物 0.5μl,SYBR green supermix 12.5μl,去离子水 11μl。把离心管迅速放入PCR扩增仪,按扩增程序进行PCR扩增(94℃预变性 5min;94℃ 30s,57℃ 30s,72℃ 30s,40 个循环;72℃延伸7min)。
1.5 免疫荧光染色
1.5.1 冰冻切片的制备 麻醉动物后断头,取脑,将脑组织置于-80℃的异戊烷中冷冻,以OCT包裹脑组织后用冰冻切片机(Leica德国)切片,取材部位从距离嗅球2mm开始到见到腹侧海马为止,切片置于-80℃冰箱内保存待用。
1.5.2 SIRT2免疫荧光染色 将冰冻切片从-80℃冰箱取出,在室温下风干30min,用4%的多聚甲醛固定10min,PBS(1×)清洗3次,每次5min,然后加入10%的BSA封闭30min,加入一抗(兔抗小鼠,1∶300,Santa Cruz),4℃冰箱中放置过夜,PBS×3次,每次 5min,加入荧光抗体(1∶200,Alex568),常温孵育1h,PBS ×3 次,每次 5min,加入DAPI孵育5min,PBS×3 次,每次5min,用防猝灭剂封片液封片,在激光共聚焦显微镜下(Leica德国)观察,获取图像(×400)。
1.6 再灌注后24h梗死体积计算 再灌注后24h,过量麻醉小鼠致死,取脑,将脑切成2mm的冠状脑片,共5片。将脑片放入2%的2,3,5-氯化三苯基四氮唑(TTC)中,37℃,孵育20min,放入4%多聚甲醛中;梗死部位显现白色,而鲜红色代表未缺血的部位,缺血侧的梗死面积用Image J软件分析,梗死体积计算:第一片和最后一片的体积按照圆锥体来算则V=2/3×(S+√S),中间部分则按梯形体来算 V=2/3×[(Sn+Sn+1+√(Sn+Sn+1)],梗死总体积则将两部分相加。
1.7 再灌注后24h神经功能损害评分 采用CHOPP评分标准[11]对神经功能损害进行评分。
1.8 MPO和SOD活性测定 分别按照MPO、SOD活力试剂盒(南京建成)中说明书的方法对缺血侧脑组织中的MPO和SOD活性进行检测。
2 结果
2.1 不同时间点假手术组和I/R组小鼠皮质中SIRT2 mRNA和蛋白的表达变化 皮质中,与对照组比较,SIRT2 mRNA水平在再灌注后6、12、24h表达逐渐升高(P<0.05),并且在24h升高最为明显(见图1);和mRNA的结果相符,SIRT2的蛋白水平在再灌注后12、24h表达升高(P<0.05)(见图2、图3)。
2.2 假手术组和I/R 24h小鼠皮质中SIRT2免疫荧光染色结果 通过免疫荧光染色发现与假手术对照组相比,再灌注损伤24h后,可以看到皮质区的SIRT2的表达上调(见图4,I-II);并且在再灌注24h后,皮质中的SIRT2和假手术组一样也是表达在细胞质中(见图4,II)。
2.3 再灌注后24h梗死体积测定和神经功能评分结果 AGK-2是一种特异性的SIRT2活性抑制剂[9],当侧脑室注射不同浓度的AGK-2后,发现AGK-2(5.0mmol/L)组和DMSO对照组比较梗死体积增大(28.99 ± 3.34mm3,16.48 ± 1.09mm3,P=0.028),神经功能缺损加重(9.43 ±0.53,6 ±0.46,P=0.002);而 AGK-2(2.5mmol/L)和对照组相比梗死体积(15.31 ±1.21mm3,16.48 ±1.09mm3,P=0.5)和神经功能评分(6.38 ±0.42,6 ±0.46,P=0.58)均无明显差异(见图5、图6)。
2.4 假手术组和再灌注后24h SOD和MPO测定的结果 分别利用SOD、MPO试剂盒来检测缺血侧/左侧脑组织中SOD和MPO的活性,得出AGK-2(5.0mmol/L)组和DMSO组相比显著增加MPO活性(2.72 ±0.50 活力单位/克湿片,0.39 ±0.03 活力单位/克湿片,P=0.019),减少 SOD 活性(5.29 ±1.04U/mgprot,13.80 ± 1.04U/mgprot,P=0.004);AGK-2(2.5mmol/L)和 DMSO 组比较对 MPO(0.59±0.12 活力单位/克湿片,0.39 ±0.03 活力单位/克湿片,P=0.2),SOD 活性(13.03 ±2.50U/mgprot,13.80 ± 1.04U/mgprot,P=0.30)影响不大;DMSO对照组和假手术组比较 MPO(0.39±0.03活力单位/克湿片,0.15 ±0.03 活力单位/克湿片,P=0.02)和 SOD 活性(13.80 ±1.04U/mgprot,25.01 ±1.16U/mgprot,P=0.002)均有统计学差异(见图7)。

图1 再灌注后不同时间点和假手术组皮质中SIRT2 mRNA表达水平比较
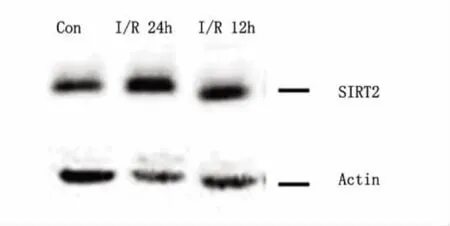
图2 假手术组和再灌注后12、24h皮质中的SIRT2蛋白表达(Western blot)
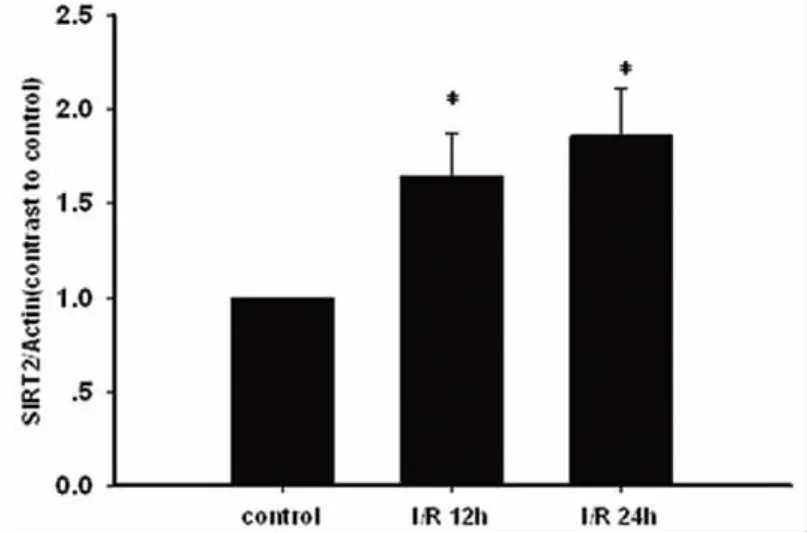
图3 再灌注后12、24h皮质中和假手术组SIRT2蛋白表达水平比较
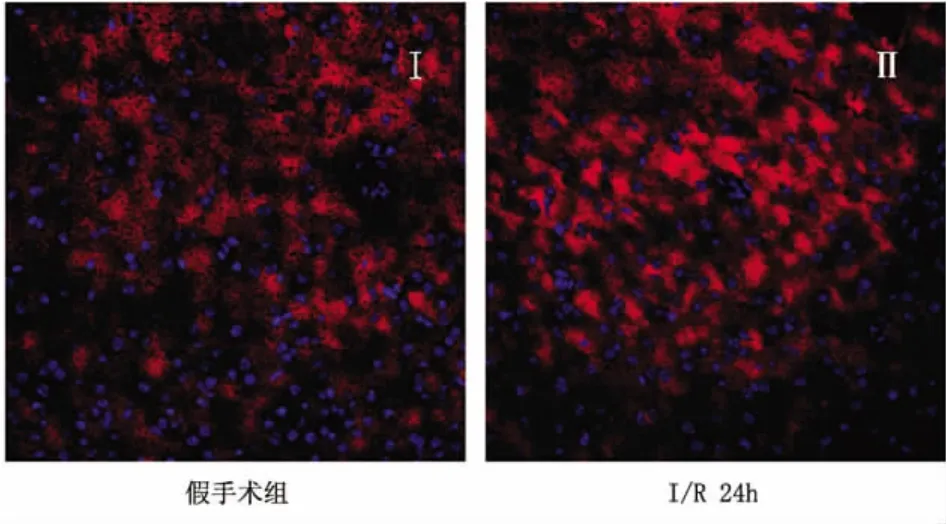
图4 对照组和缺血再灌注后24h皮质中SIRT2的表达

图5 AGK-2给药组和DMSO对照组TTC染色
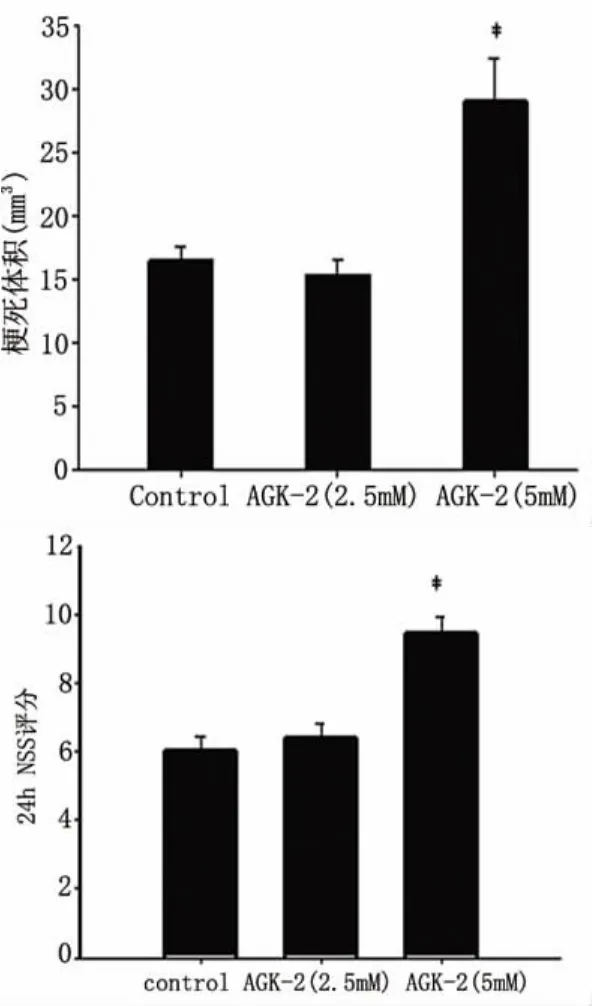
图6 AGK-2给药组和DMSO对照组再灌注后24h梗死体积和行为学评分统计图
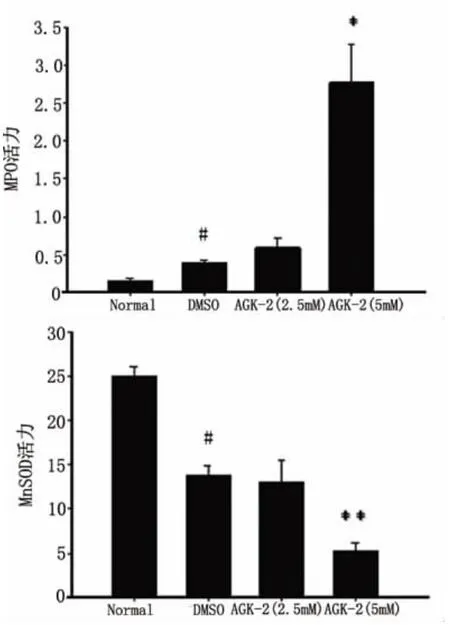
图7 假手术组、AGK-2组和DMSO组的MPO、SOD活性统计图
3 讨论
SIRT2是Sirtuin家族中的一种,表达在细胞质中,Wang等人在细胞中给予双氧水(100μmol/L或500μmol/L)刺激24h后 SIRT2的 mRNA水平上调[7],并且在心肌细胞中,给予缺氧再充氧后,随着缺氧时间的增加SIRT2 mRNA的表达也是逐渐增加的[12],在本次实验中,缺血再灌注后 6、12、24h,皮质中的SIRT2 mRNA水平表达上调,并且与mRNA结果相符,在再灌注后12、24h皮质中的SIRT2蛋白水平表达增高。SIRT2在脑组织中的表达很丰富,在体内和体外研究中都提示SIRT2主要表达在少突胶质细胞中,也可以在一些神经元中表达[13~15]。几乎所有的研究都证实,在有丝分裂后的细胞中,无论是少突胶质细胞还是神经元SIRT2都只是表达在细胞质中[14];同样在双氧水刺激后,Wang等人也并没有在细胞核中发现SIRT2的存在[7],并且Karin等人研究证实在细胞给予IL-6刺激后,同样不会引起SIRT2往核内的转移[8],在本次实验中我们也发现和假手术对照组相比,脑缺血再灌注后皮质中SIRT2没有和细胞核融合。
我们利用SIRT2特异性的活性抑制剂AGK-2,将其定位注射至侧脑室中,可以发现高浓度的AGK-2(5mmol/L)可以加重缺血再灌注后的神经损害作用,提示SIRT2对于缺血后的脑组织有保护作用。炎症和氧化应激是参与脑缺血再灌注损伤的重要的两个因素,既往研究证实不论是抑制缺血后脑组织中的炎症反应还是降低脑组织中的氧化应激水平都具有神经保护作用[16,17],因此我们利用 MPO 和SOD试剂盒分别对给药组和对照组脑组织中的炎症和氧化应激水平进行检测,发现高浓度的AGK-2可以加重缺血后脑组织中的炎症水平,而降低其氧化应激水平;但是对于在缺血后脑组织中AGK-2调控炎症和氧化应激的机制目前尚不清楚,但有研究证实在给予双氧水刺激的细胞中,SIRT2可以促进FOXO3a的转录活性,刺激MnSOD的表达,增加细胞的抗氧化应激的能力,并且Karin等人研究发现在炎症因子的刺激下,细胞中SIRT2可以使得NF-κB去乙酰化,从而减少其的转录活性,减少炎症介质如 IL6、MMP9 和 COX-2 的表达[8],以上证据提示SIRT2可能分别是通过调控 NF-κB和 FOXO3a影响脑缺血再灌注损伤后的炎症和氧化应激水平,这还需要动物实验去证实。
SIRT2对脑缺血再灌注损伤的神经保护还可能有其他的机制参与,有研究报道在体外实验中,过表达SIRT2可以去乙酰化P53,使得P53的转录活性降低从而减少细胞的凋亡[18],相反SIRT2的下调可以导致P53的细胞内聚集而导致细胞的凋亡[19];在氧化应激情况下SIRT2还可以加重细胞内的ATP值的下降[9],以上提示SIRT2可能也可以通过调控凋亡和细胞内的ATP水平对缺血再灌注损伤起到保护作用,但还需动物实验去证实。
通过本次实验,我们得出和假手术组相比,缺血再灌注损伤皮质中SIRT2的mRNA和蛋白的表达增高;并且SIRT2可以通过降低脑组织中炎症和氧化应激水平来减轻缺血再灌注引起的脑组织损伤。
[1] Jensen ON.Interpreting the protein language using proteomics[J].Nat Rev Mol Cell Biol,2006,7:391 -403.
[2] Haberland M,Montgomery RL,Olson EN.The many roles of histone deacetylases in development and physiology:implications for disease and therapy[J].Nat Rev Genet,2009,10:32 -42.
[3] Polevoda B,Sherman F.The diversity of acetylated proteins[J].Genome Biol,2002,3(5):reviews0006.
[4] Yang XJ,Seto E.HATs and HDACs:from structure,function and regulation to novel strategies for therapy and prevention[J].Oncogene,2007,26:5310 -5318.
[5] Yang YH,Chen YH,Zhang CY,et al.Cloning and characterization of two mouse genes with homology to the yeast Sir2 gene[J].Genomics,2009,69:355 -369.
[6] Vaquero A,Scher MB,Lee DH,et al.SirT2 is a histone deacetylase with preference for histone H4 Lys 16 during mitosis[J].Genes Dev,2006,20:1256 -1261.
[7] Wang F,Nguyen M,Qin XF,et al.SIRT2 deacetylates FOXO3a in response to oxidative stress and caloric restriction[J].Aging cell,2007,6:505 -514.
[8] Karin MR,Erener S,Waibei S,et al.SIRT2 regulates NF-Kb-dependent gene expression through deacetylation of P65 Lys310[J].J Cell Sci,2010,123(24):4251 - 4258.
[9] Nie H,Chen H,Han J.Silencing of sirt2 induces cell death and a decrease in the intracellular ATP level of PC12 cells[J].Int J physiol Pathophysiol Pharmacol,2011,3(1):65 -70.
[10] Guo YY,Betz AL.Reperfusion-induced injury to the blood-brain barrier after middle cerebral artery occlusion in rats[J].Stroke,1994,25:1658 -1664.
[11] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005 -1011.
[12] Edward GL,Christopher JM,Jeorey PG.SIRT2 is a negative regulator of anoxia-reoxygenation tolerance via regulation of 14-3-3 f and BAD in H9c2 cells[J].FEBSLetters,2008,582:2857 -2862.
[13] Taylor DM,Maxwell MM,Luthi-Carter R,et al.Biological and potential therapeutic roles of sirtuin deacetylases[J].Cell Mol Life Sci,2008,65:4000 -4018.
[14] Pandithage R,Lilischkis R,Harting K,et al.The regulation of SIRT2 function by cyclin-dependent kinases affects cell motility[J].J.Cell Biol,2008,180:915 - 929.
[15] Li W,Zhang B,Tang J,et al.Sirtuin 2,a mammalian homolog of yeast silent information regulator-2 longevity regulator,is an oligodendroglial protein that decelerates cell differentiation through deacetylating alpha-tubulin[J].J Neurosci,2007,27:2606 -2616.
[16] Denes A,Thornton P,Rothwell NJ,et al.Inflammation and brain injury:Acute cerebral ischemia,peripheral and central inflammation[J].Brain Behav Immun,2010,24,708 -723.
[17] Niizuma K,Endo H,Chan PH.Oxidative stress and mitochondrial dysfunction as determinants of ischemia neuronal death and survival[J].J Neurochem.2009,109(suppl 1),133 -138.
[18] Jin YH,Kim YJ,Kim DW.SIRT2 interacts with 14-3-3 beta/garmma and down regulates the activity of P53[J].Biochem BiophysRes Communic,2008,368:690 -695.
[19] Li Y,Matsumori H,Nakayama Y,et al.SIRT2 down-regulation in Hela can induce P53 accumulation via P38 MAPK activation-dependent P300 decrease evevtually leading to apoptosis[J].Gene Cells,2011,16(1):34 -45.

