奈达铂与调强适形同步放化疗治疗中晚期食管癌疗效分析
杨敬儒,金和坤,江啸音
(湖南省肿瘤医院放疗科,湖南长沙,410013)
食道癌是我国高发的消化道恶性肿瘤,多数患者就诊时已是中晚期,失去了手术治疗机会,但是单一局部放疗或化疗的5年存活率仅为10%,或者出现局部未控,远处转移的结果,因此,同步放化疗的综合治疗手段已成为中晚期食道癌的首选模式[1]。同步放化疗的化疗方案一般以顺铂为主,其反应较大,部分病人不能耐受,奈达铂作为第二代铂类药物,不仅保留了顺铂的疗效,且毒副作用较小,因此奈达铂化疗方案逐步为广大医生所接受。本院对2007年1月~2007年12月收治的局部晚期食道癌患者60例,采用奈达铂同步调强放疗与单纯调强放疗比较,并取得较满意的效果,现总结如下。
1 资料与方法
1.1 一般资料
本院放疗科于2007年1月~2007年12月收治60例局部晚期食管癌患者,均为无手术可能的无锁骨上淋巴结转移、无远处转移的初治病人,KPS评分>70分,均经病理学确诊,其中鳞癌57例、腺癌3例,男 43例,女17例,年龄35~ 69岁,中位年龄50岁,病变长度均>3 cm,预计生存期超过3个月。60例患者随机分为2组:单纯调强放疗组(以下简称单纯放疗组)30例,其中鳞癌29例,腺癌1例,男 22例,女8例,胸上段病变6例,胸中段23例,胸下段病变1例;调强放疗同步奈达铂组(以下简称放化疗组)30例,鳞癌28例,腺癌2例,男 21例,女 9例,胸上段病变 4例,胸中段25例,胸下段1例。
1.2 治疗方法
2组患者均采用8MV-X线全程实施调强适形放疗。患者用热塑网膜做体位固定,行胸部CT增强扫描,局域网传送CT扫描图像至物理室MASTERPLAN治疗计划系统,结合食道吞钡或PET-CT等影像资料勾画GTVnx,GTVnd,CTVnx,包括上下各30~50 mm的正常食道和食道周围外放8~10 mm,PTVnx=CTVnx+5 mm,CTVnd则包括GTVnd外放5 mm和相应的淋巴引流区域,而PTVnD=CTVnd+5 mm,副主任以上的医师确定并认可治疗靶区,由物理师设计优化治疗计划,上级医师认可治疗计划,CT模拟复位校对并确定治疗中心点,放疗技术人员在加速器上验证并实施照射计划。靶区GTV为食管原发灶,肿大转移淋巴结为GTVnd,CTV包括GTV和GTVnd+淋巴引流区,并在GTV和GTVnd左右前后方向均放0.8 cm左右,上下方向均放3~5 cm,PTV在CTV基础上各外放0.5 cm,放疗剂量95%GTV 68~70 Gy/28~30次,95%PTV 56~60 Gy/28~30次。放化疗组的患者在放疗第一天开始每周给予NDP 40 mg/m2静脉滴注化疗,放疗5周半~6周;单纯放疗组为单纯的调强适形放疗。2组每周复查血常规,保证放疗能按疗程正常完成。
1.3 疗效评价
依据体格检查、胸部CT、食管钡餐等结果,按照RECIST实体瘤疗效评价标准(2000年)[2]将疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)4级,有效(RR)为(CR+PR),SD、PD为无效。按WHO(1999年)抗癌药物毒性判断标准,将不良反应分为0~Ⅳ度。
1.4 随访情况
单纯放疗组随访12~26个月,中位随访期16个月,放化疗组随访12~27个月,中位随访期17个月,观察患者生存情况。
2 结 果
2.1 2组患者近期疗效比较
放化疗组总有效率为90.0%,单纯放疗组总有效率为66.7%,2组总有效率比较有显著性差异(P<0.05)。见表1。

表1 2组患者近期疗效比较[例]
2.2 2组患者远期疗效比较
1年生存率放化疗组为66.7%,单纯放疗组为60.0%,2组无显著性差异(P>0.05)。2年生存率放化疗组为60.0%,单纯放疗组为33.3%,2组差异显著(P<0.05)。

表2 2组患者1年、2年生存率比较[n(%)]
2.3 不良反应
患者不良反应以骨髓抑制(白细胞减少和血小板减少)、放射性食道炎为主。单纯放疗组中,白细胞减少6例,占20.0%,其中Ⅱ度5例、Ⅲ度1例;血小板减少1例,为Ⅱ度,占 3.3%;放化疗组中,白细胞减少 12例,占 40.0%,其中Ⅱ度8例、Ⅲ度3例、Ⅳ度1例;血小板减少6例,占20.0%,其中Ⅱ度4例、Ⅲ度1例、Ⅳ度1例。单纯放
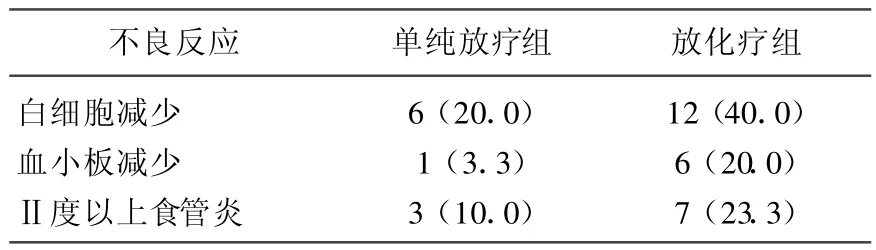
表3 2组不良反应发生率比较[n(%)]
疗组中,Ⅱ度以上放射性食道炎3例,占10.0%;放化疗组中,Ⅱ度以上放射性食道炎7例,占23.3%。2组WBC减少、血小板减少、Ⅱ度放射性食道炎发生率无显著性差异(P>0.05),且对症处理后均可控制,详见表3。
3 讨 论
对失去手术根治机会的食管癌患者进行单纯放疗的疗效较差,目前国内外大多采用同步放化疗[3-4]。化疗与放疗联合既有明显的相互增敏作用,又可预防肿瘤耐药基因的表达,同步放化疗治疗中晚期食管癌,可以提高原发病及全身隐匿病灶的疗效以及局部病灶控制率,降低远处转移率,提高近期疗效和生活质量,延长生存期限[5]。
相关报道显示[6-7],氟脲嘧啶(5-Fu)和顺铂(DDP)联合治疗食管癌的有效率达89%~93.8%,5-Fu+DDP方案治疗食管癌的近期疗效佳,已成为目前食管癌治疗上常用的方案,但由于DDP的毒副反应较大,患者用药后消化道反应明显,生活质量差,且患者不能耐受化疗,往往不能完成治疗,国内外肿瘤专家均致力于寻求高效低毒的铂类药物代替DDP。奈达铂作为第二代铂类化学药物,化学名为顺?二氨基甘醇酸铂,其毒性小,抗癌作用机制与顺铂相似,可结合DNA并抑制DNA复制与癌细胞增殖。但奈达铂的毒性谱与顺铂不同,其肾毒性和胃肠道反应发生率均较低,用药期间无需水化碱化尿液,其剂量限制性毒性主要为骨髓抑制所致的血小板减少、白细胞减少等。奈达铂引起的血小板和白细胞下降较多见,但多数是可逆的轻度损害,经过对症处理可恢复正常,本组资料与国内相关报道[8-9]基本一致,显示含有奈达铂的方案治疗食管癌是安全的。
食管常规放疗的疗效多年来无明显提高,其主要原因是肿瘤的局部未控率和复发约为60~70%[10],肺损伤、脊髓及心脏的耐受量限制了局部肿瘤剂量的提高。食道癌的调强适形放疗是近年开展的新技术,其特征是利用三维治疗计划系统设计共面或非共面的不规则野进行分次照射,通过对照射野内各点的输出剂量率的调整,实现高剂量的等剂量线面与靶区在三维空间上形态一致,从而最大限度杀灭肿瘤细胞,同时,尽量保护周围正常组织及器官,实现在不增加正常组织并发症概率的前提下,提高肿瘤的局部照射剂量和局部控制率[11]。
本次研究表明,2组病例近期及远期疗效均较常规放射治疗明显提高。奈达铂同步调强适形放疗与单纯调强适形放疗其疗效比较有显著差异,虽然放化疗组出现血液学毒性及放射性食管炎较多,但多为轻度反应,经积极处理后,不影响治疗过程。因此,调强适形放疗+奈达铂同步放化疗能进步提高肿瘤的局部控制率,降低转移率,从而提高生存率,改善病人的生活质量,将成为中晚期食管癌治疗的常用方案。
[1] 蓝玉宏,潘秀花,魏 崴.同期放化疗、单纯放疗治疗不能手术的食管癌的疗效比较[J].中国现代药物应用,2009,3(14):3.
[2] Therasse P,Arbuck S G,Eisenhauer E A,et al.New guidelines to evaluate the response to treatment in solid tumors.European Organization for Research and T reatment of Cancer,National Cancer Institute of the United States,National Cancer Institute of Canada[J].J Natl Cancer Inst,2000,92(3):205.
[3] 罗建文,郑俊琼,郑秋香,等.紫杉醇、奈达铂化疗序贯放疗用于晚期食道癌临床观察[J].实用临床医药杂志,2010,14(19):49.
[4] 侯盘长,杨学峰.同步放化疗治疗老年中晚期食管癌108例临床观察[J].中国现代医生,2010,48(25):141.
[5] Zhang X,Li Y,Pan X,et al.Intensity-modulated proton therapy reduces the dose to normal tissue compared with intensity-modulated radiation therapy or passive scattering proton therapy and enables individualized radical radiotherapy for extensive stage IIIB non-small-cell lung cancer:a virtual clinical study[J].Int J Radiat Oncol Biol Phys,2010,77(2):357.
[6] 戴荣军,叶宏勋.局部晚期食管癌同步放化疗疗效观察[J].现代肿瘤医学,2010,18(12):2371.
[7] 郭恒照.顺铂加氟脲嘧啶化疗同步放射治疗98例食管癌临床研究[J].泰山医学院学报,2009,30(7):496.
[8] 刘向明,钱碧云,屈大望,等.奈达铂联合氟尿嘧啶治疗中晚期食管癌的临床观察[J].临床肿瘤学杂志,2006,11(6):437.
[9] 葛含天,张 剑.奈达铂周剂量同步放化疗治疗老年中晚期食管癌近期疗效观察[J].海南医学院学报,2009,15(9):1123.
[10] 乔红梅,丁富强,宋丽萍,等.食管癌根治术后放射治疗的疗效分析[J].现代肿瘤医学,2010,18(10):1982.
[11] Tillman G F,Pawlicki T,Koong A C,et al.Preoperative versus postoperative radiotherapy for locally advanced gastroesophageal junction and proximal gastric cancers:a comparison of normal tissue radiation doses[J].Dis Esophagus,2008,21(5):437.
——再论奈达对翻译本质属性的认知

