结核分枝杆菌链霉素耐药临床分离株rpsL基因突变特征分析*
魏淑贞,赵秀芹,刘志广,万康林
2.福建省疾病预防控制中心,福州 350001
结核病是结核分枝杆菌(Mycobacteriumtuberculosis,MTB)引起的慢性消耗性传染病。目前,结核病疫情日益恶化,耐药及耐多药现象十分严重。其中链霉素(streptomycin,SM)耐药比例居高不下。第4次全国结核病流行病学调查获悉我国结核分枝杆菌SM耐药率为17.3%,仅次于异烟肼(isoniazid,INH)耐药[1],引起有关人士的高度关注。SM是最早用于治疗结核病的一线药物,由于结核分枝杆菌生长缓慢,运用传统的方法从分离,鉴定到获得药物敏感性结果往往需要6~8 w。因此,结核分枝杆菌SM耐药的快速诊断方法尤为重要,日益受到国内外学者的关注。为了解我国结核分枝杆菌SM耐药的情况和耐药基因突变的特点,以及为进一步快速检测SM耐药方法的建立提供依据,我们对从福建省、河南省、湖南省、安徽省和四川省及西藏自治区收集的结核分枝杆菌进行了SM耐药的相关研究。
1 材料与方法
1.1 菌株来源 302株菌株由福建省(76株)、河南省(17株)、湖南省(58株)、安徽省(10株)和四川省(31株)及西藏自治区(110株)的结核病防治机构提供,结核分枝杆菌标准株H37Rv购买于中国生物制品药品检定所。
1.2 菌株分离鉴定和药物敏感性试验 菌株用改良罗氏培养基进行培养,用含对硝基苯甲酸(PNB)和噻吩-2-羧酸肼(TCH)的培养基鉴别结核分枝杆菌,牛结核杆菌和非结核分枝杆菌。根据WHO推荐的比例法[1]进行药物敏感性测定,含药培养基的药物临界浓度分别是:INH 0.2μg/m L,RFP 40 μg/m L,SM4μg/m L,EMB 2μg/m L和PAS 0.5 μg/m L。
1.3 提取DNA 乱取常规L-J培养基上生长良好的结核菌落,一菌环溶于400μLTE(p H8.0)中,在旋涡振荡器上震荡至块状固体菌落均匀溶于TE中,沸水浴15 min,快速离心,取上清备用。
1.4 扩增rpsL基因及测序检测rpsL基因(GeneID888259)是结核分枝杆菌染色体上的结构基因,全长375 bp,其编码核糖体蛋白S12。用Primer Premier5.0设计引物,扩增产物片段长为608 bp。上游引物为5′GGC GGC TTA CGC TTG ATG3′;下游引物为5′TCC GTA GAC CGG GTC GTTG3′。引物由赛百盛公司合成。PCR缓冲液,MgCl2,d NTP,Taq酶从上海生物工程公司购买。采用50μLPCR反应体系,其中包括模板DNA 9μL、1.5 mmol/L MgCl2、0.2 mmol/L d NTP、上下游引物各15 pmol和1.5 U Taq DNA酶。PCR的反应条件是:94℃5 min,94℃45 s,55℃30 s,72℃45 s,72℃5 min,30个循环。扩增整个rpsL基因。PCR产物先用1.5%琼脂糖凝胶电泳判断目的片段的位置(如图1),确认是单一的目的条带后直接送到上海生工公司进行纯化测序。
1.5 测序结果比对 测序序列以纯文本形式查询序列输入到 www.ncbi.nlm.nih.gov的BLAST的查询框中,与H37RV的序列进行比对。同时排除测序引起的误差判断测序结果。
1.6 分析数据 菌株背景及测序结果用统计软件SPSS13.0分析相关数据,经χ2检验,P<0.05为有统计学意义。
2 结 果
2.1 药物敏感性试验结果 302株结核分枝杆菌临床分离株,SM 敏感株120株,占39.74%(120/302),其中59株对抗结核药物——INH、RFP、SM、EMB,PAS全部敏感,对SM敏感的耐药株有61株(其中耐多药46株);对SM耐药的菌株有182株(其中耐多药150株),耐药率为60.26%(182/302),其中单耐SM 的菌株有6株,占3.30%(6/182),以含耐SM两种及以上药物耐药的菌株为主,占96.70% (176/182)。总 耐 多 药 率 为 64.90%(196/302)。具体的药物敏感性结果见表1。

表1 302株结核分枝杆菌药物敏感性试验结果Tab.1 Results of drug susceptibility test(DST)for 302 MTB isolates
2.2 PCR扩增产物电泳图片 用Premier5.0自行设计的引物扩增整个结核分枝杆菌rpsL基因,扩增产物片段长为608 bp。如图1所示为扩增产物,含整个rpsL基因片段。
图1 结核分枝杆菌rpsL基因PCR结果M:100bp分子量标准;0:阴性对照;H:结核分枝杆菌标准株;1~4:结核分枝杆菌临床分离株Fig.1 PCR results of rpsL in MTB M:DNA marker;0:Negative;H:H37Rv;1-4:MTB isolates
2.3 测序结果 302株结核分枝杆菌rps L基因测序结果经BLAST比对,168株没有检测到突变;134株存在突变。96株结核分枝杆菌rpsL基因第43位密码子发生AAG→AGG(Lys43 Arg,赖氨酸转变为精氨酸)突变 ,其中95株为SM耐药,SM耐药株发生突变的频率为52.20%(95/182)。37株菌株第88位密码子发生突变,其中5株SM敏感株发生AAG→AGG(Lys88 Arg,赖氨酸转变为精氨酸)的突变;32株SM耐药株第88位密码子发生突变,涉及4种突变类型,其中28株发生AAG→AGG(Lys88 Arg,赖氨酸转变为精氨酸)突变,Lys88Arg突变率为15.38%(28/182),有2株 AAG→ATG(Lys88Met,赖氨酸转变为蛋氨酸)突变,突变率为1.10%(2/182),AAG→CAG(Lys88Gln,赖氨酸转变为谷氨酰胺)和AAG→ACG(Lys88Thr,赖氨酸转变为苏氨酸)各有1株,突变率均为0.55%(1/182)。另外有1株SM耐药菌株第86位密码子发生CGG→CAG(Arg86Gln,精氨酸转变为谷氨酰胺)突变,突变率为0.55%。
2.4 药物敏感性结果与rpsL基因突变的关系59株结核分枝杆菌全敏感株rpsL基因没有发生突变。61株对SM敏感的耐药株中有6株菌株的rpsL基因发生突变。因此,SM敏感株rpsL基因突变率是5.00%(6/120)。182株SM 耐药株检测到基因突变的菌株有128株,SM耐药株的突变率是70.33%。SM敏感株和SM耐药株突变率的比较见表2。
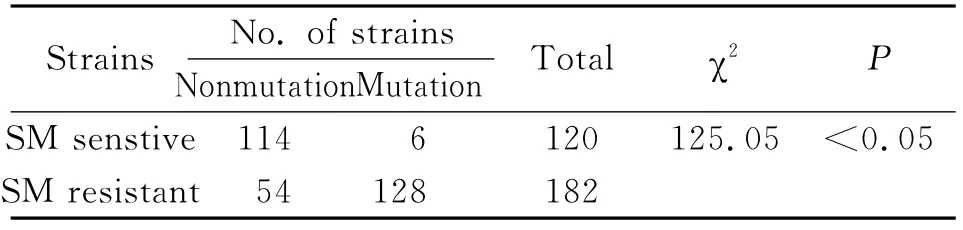
表2 SM敏感株和耐药株基因突变率的比较Tab.2 Comparison of gene mutation rates in SM sensitive and SM resistant strains
2.5 耐多药菌株rpsL基因突变特点 196株耐多药菌株中有46株对SM敏感,150株对SM耐药。耐多药菌株中有110株rps L基因发生突变。对SM耐药且发生基因突变的106株耐多药菌株当中,有78株43位密码子AAG→AGG突变,占73.58%;有27株88位密码子发生突变,共4种突变类型,依次为23株AAG→AGG突变,占21.70%,2株 AAG→ATG 突变,占1.89%,AAG→CAG突变和AAG→ACG突变各1株,均占0.94%;另有1株86位密码子CGG→CAG(Arg→Gln)突变,占0.94%。详见表3、4。
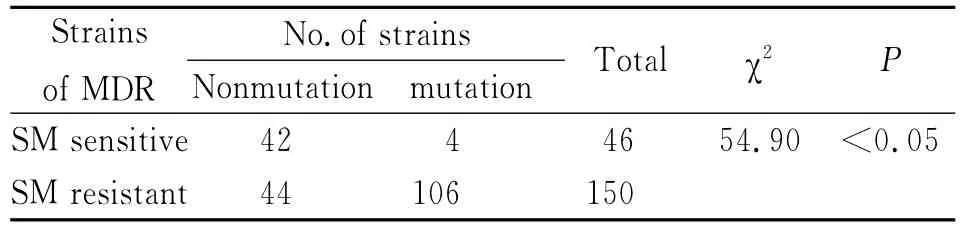
表3 耐多药含SM敏感或耐药的菌株与rpsL基因变异的关系Tab.3 Relationship between rpsL mutation in MDR strains and SM susceptibility

表4 耐多药菌株基因突变位点与SM耐药的关系Tab.4 Relationship between mutation sites in MDR and SM resistance
3 讨 论
SM是第一个发现与核糖体相互作用的抗生素。1944年,Selman Waksman发现SM可用于治疗结核病,并与INH(H)、RFP(R)、EMB(E)成为治疗结核病的一线药物[2]。早在1946年,就已经有关于结核分枝杆菌对SM 产生耐药性的报道[3]。SM是在核蛋白体水平上干扰细菌蛋白质合成的。它主要的作用部位是核蛋白体的30S亚基,该亚基是由21种核蛋白体和1种16Sr RNA组成的。SM与核蛋白体30S亚基结合,抑制A位点功能,引起遗传密码的错读SM、翻译启动的抑制及异常校正,最终抑制蛋白质合成从而表现为抗菌活性[4-5]。核糖体蛋白S12的正常作用可能是维持读码过程中的一些轻微的不准确性,而突变的S12核蛋白却严格要求核糖体只使用与每一个密码子对应的氨酰-t RNA,从而抑制了SM诱导的遗传密码错读而产生耐药性[6]。
本研究对经药物敏感性试验确认为结核分枝杆菌的302株临床分离株进行rpsL基因的扩增测序,分析检测到的突变。SM敏感株120株,59株全敏感结核分枝杆菌临床分离株经测序没有发现点突变。61株SM敏感的耐药株中有6株发生点突变,其中1株43位密码子发生AAG→AGG(Lys→Arg)突变,5株88位密码子发生AAG→AGG(Lys→Arg)突变,故SM 敏感株的突变率是5.00%(6/120)。
182株SM耐药株包括6株SM单耐药和174株含耐SM的多耐药株,其中主要是以耐多药(HRS,HRES,HRSP,HRESP)为主,占81.87%(149/182),耐多药率是49.34%(149/302),远远高于第4次全国结核病调查显示的我国耐多药率(10.7%)[1]。这可能和标本的来源和标本的选择有关,本研究的标本均来自结核病防治医院,一般在医院治疗的病人多为结核病重症病例。SM耐药菌株发生的点突变主要以43位密码子和88位密码子均发生AAG→AGG(Lys→Arg)为主,43位密码子突变比88位密码子突变常见,这和国内外相关的报道一致[7]。研究发现88位密码子的改变涉及4种突变类型,除了常见的AAG→AGG(Lys→Arg)外,还发生AAG→ATG(Lys→Met),AAG→CAG(Lys→Gln)和AAG→ACG(Lys→Thr)突变,该位点的这些罕见突变[8]也曾经被报道过。由此可见,88位密码子的突变类型具有多样性。而在耐多药菌株中,SM敏感菌株与SM耐药株的88位密码子突变率之间的差异没有统计学意义(χ2=3.47,P=0.062)。本研究还发现1株86位密码子发生CGG→CAG(Arg→Gln)突变,目前没有见到国内外有相关报道,该突变位点与耐药的关系需要进一步验证。这些罕见的突变均发生于耐SM的耐多药菌株当中。
测序检测到SM耐药株有128株发生突变,突变率是70.33%(128/182),SM 敏感株的突变率是5.00%(6/120),两者之间的差异经卡方分析具有统计学意义(χ2=125.05,P<0.05)。耐多药含SM耐药的菌株rpsL基因突变率明显高于耐多药但SM敏感的菌株rps L基因突变率,经分析,两者之间的差异有统计学意义的(χ2=54.90,P<0.05)。耐多药含SM耐药的菌株rpsL基因43位密码子突变率明显高于耐多药,但SM敏感的菌株rpsL基因43位密码子突变率,经分析,两者之间的差异有统计学意义(χ2=36.32,P<0.05)。进一步证实了rpsL基因突变与结核分枝杆菌SM耐药高度相关,其中43位密码子AAG→AGG(Lys→Arg)突变是主要突变类型,PCR-DS检测rps L基因突变可以用于临床结核菌SM耐药的快速检测。本研究还有一部分SM耐药株没有检测到突变,提示SM耐药可能存在其他的耐药机制,有待于进一步的研究。正如Finken等曾报道了约25%结核分枝杆菌耐SM的临床分离株中存在正常的核蛋白S12和16Sr RNA,提示存在其它的耐药机制[9]。
[1]刘宇红,姜广路,赵立平,等.第四次全国结核病流行病学抽样调查——结核分枝杆菌耐药性分析与评价[J].中华结核和呼吸杂志,2002,25(4):224-227.
[2]Schatz A,Waksman S A.Effect of streptomycin and other antibiotic substances uponMycobacteriumtuberculosisand related organism[J].Proc Soc Exp Bio Medical,1944,57:244-248.
[3]Klein M,Kimmelman L J.The role of spontaneous variants in the acquisition of streptomycin resistance by the shigellae[J].J Bacteriol,1946,52:471-479.
[4]Ogle JM,Ramakrishnan V.Structural insights into translation fidelity[J].Annu Rev Biochem,2005,74:129-177.
[5]Allen P N,H F Noller.Mutations in ribosomal S4 and S12 influence the higher order structure of 16S ribosomal RNA[J].J Mol Biol,1989,208:457-468.
[6]Bohmann K,Ruusala T,Jelenc P C,et al.Kinetic impairment of restrictine streptomycin resistant ribosomes[J].Mol Gen Genet,1984,198:90-99.
[7]Srinand S,XiPan,Stockbaner KE,et al.Characterization of rpsl and rrs mutations in streptomycin-resistantMycobacteriumtuberculosisisolates from diverse geographic locatilies[J].Antimicro Agents Chemoth,1996,40:1024-1026.
[8]Honore N,Marchal G,Cole S T.Novel Mutation in 16Sr RNA associated with streptomycin dependence in mycobacterium tuberculosis[J].Antimicro Agents Chemother,1995,39:769-770.
[9]Finken M P,Kirschner A,Meier A,et al.Molecular basis of streptomycin resistance inMycobacteriumtuberculosis:alterations of the ribosomal protein S12 gene and point mutations within a functional 16S ribosomal RNA pseudoknot[J].Mol Microbiol,1993,9:1239-1246.

