TET2突变检测在血液肿瘤中的临床价值
罗 婧综述,刘立根审校
(复旦大学附属上海市第五人民医院血液科、复旦大学血液病研究中心,上海 200240)
1 TET2基因的起源与结构
TET家族中包括TET1、TET2及TET3。TET1位于染色体10q22,在急性髓系白血病(AML)相关的染色体易位t(10;11)(q22;q23)中作为混合性白血病(MLL)的融合配体出现在少数AML中。TET1编码2-酮戊二酸和二价铁离子依赖性的双加氧酶,它们可以在胚胎干细胞中催化5-甲基胞嘧啶与5-羟甲基胞嘧啶的转化,而这种转化可能促进DNA的去甲基化[1]。由于TET家族的高度保守,可以推断TET2和TET3也可能有类似作用。Tahiliani等[1]推测TET2的突变可以加强DNA甲基化,从而为突变细胞提供潜在的生长优势,形成肿瘤。TET3位于染色体2p13.1,其功能现在还未知。
2005年,Viguie等[2]在4例AML患者中发现4q24上的基因重排,通过BAC克隆和荧光原位杂交显示出伴有4q24断裂点处0.5Mb的缺失区域。4例患者中一例患者同时存在T细胞淋巴瘤,因此推测缺失可能发生于早期造血干细胞。2008年,Delhommeau等[3]报道了在骨髓增殖性肿瘤(MPN)患者染色体4q24上获得性的杂合现象缺失(LOH,loss of heterozygosity),这也是关于TET2突变的第一次较明确的报道。TET2突变最先在 JAK2 V617F阳性的MPN患者中被发现,后来在JAK2 V617F阴性的MPN、系统性肥大细胞增多症(SM)、急性髓系白血病(AML)和骨髓增生异常综合征(MDS)等中也相继被发现。
近年来TET2与血液肿瘤的关系逐渐成为人们关注的热点。现在TET2普遍被认为是位于染色体4q24上含11个外显子的肿瘤抑制基因,长度为150 kb并且作为转录本在体内广泛表达,特别是在髓系白血病细胞系、脐带血的CD34+细胞和正常的粒细胞中。此外,TET2又分为很多亚型,其中包括TET2亚型A(NM 001127208 2002氨基酸)和亚型B(NM 017628 1165氨基酸),现阶段对于亚型A的研究较多。
2 TET2基因的突变类型
TET2突变的种类有缺失、插入、移码突变、无义突变、错义突变及钝化等几种类型[4,5,6]。常见的突变时移码突变与截断突变,多发生在外显子3及外显子11,导致移码或终止密码子改变[4]。这种改变常导致截短翻译或潜在的肿瘤抑制蛋白的不充分表达[4,7]。所有TET2突变都发生于体细胞,而非种系(germline)突变。正是这些突变使TET2基因转录成无功能的TET2蛋白,从而导致肿瘤形成。
3 血液肿瘤患者TET2基因突变的检测
Delhommeau等[8]推测MDS、MPN和AML的造血干细胞在早期阶段有相同的遗传学变异,联合使用分子生物学、细胞遗传学、比较基因组杂交和单核甘酸多态性分析等方法研究上述疾病中抑癌基因的共同特点,发现了这种候选的抑癌基因—TET2。Delhommeau等进一步测定了320名患者的TET2基因编码序列,并使用体外克隆分析以及将肿瘤细胞植入小鼠体内等方法分析TET2基因缺失或突变后果。结果发现,81例MDS患者中15例(19%)、198例MPN患者中24例(12%)(有或无JAK2V617F突变),21例继发性AML中5例(24%),9例慢性粒单核细胞白血病患者中2例(22%)存在有TET2基因缺陷。TET基因缺陷存在于造血干细胞中,而且分析发现有5例MPN患者的TET2基因缺陷先于JAK2 V617F突变。
随后有研究报道,10%-20%的MDS、MPN、继发性AML和慢性粒单核细胞白血病存在TET2突变[9]。TET2突变被发现存在于各类AML的亚型中,也可以与以往报道的致癌基因(如JAK2、FLT3及RAS)共存于同一患者[10]。
Kosmider等[11]收集88例慢性粒单核细胞白血病(CMML)慢性期患者和14例确诊CMML后发生急变的患者的血标本和骨髓细胞,发现在88例慢性期CMML患者中有44例检测到TET2突变。随后,该研究小组在96例MDS患者中也发现23%患者存在TET2突变。[5]
Tefferi等[7]报道,在SM患者中TET2有着更高的突变频率。Tefferi等用高通量DNA序列分析48例SM患者骨髓DNA,其中包括42例符合系统性肥大细胞增多症WHO 2008诊断标准的患者和6例有FIP1L1-PDGFRA融合基因的患者。结果发现,12例(29%)SM患者存在TET2突变,6例FIP1L1-PDGFRA患者均未检测到TET2突变[12]。
Ce′cile Saint-Martin[13]研究分析了来自42个家庭中的 61例MPN病人的 TET2基因突变,12例(20%)JAK2V617F阳性或阴性的病人中发现了15个明显突变。Langemeijer等[14]通过SNP微列分析发现在MDS患者中4q的反复缺失及杂合体型无功能拷贝的缺失,并对102例MDS患者进行的序列分析显示,有26%的病例发生了TET2突变。Abedl-Wahab等[15]发现在91例AML患者中12%突变。Metzeler等[16]检测了427例细胞遗传学正常的原发AML患者,104例患者发生141个突变,突变阳性率为23%。
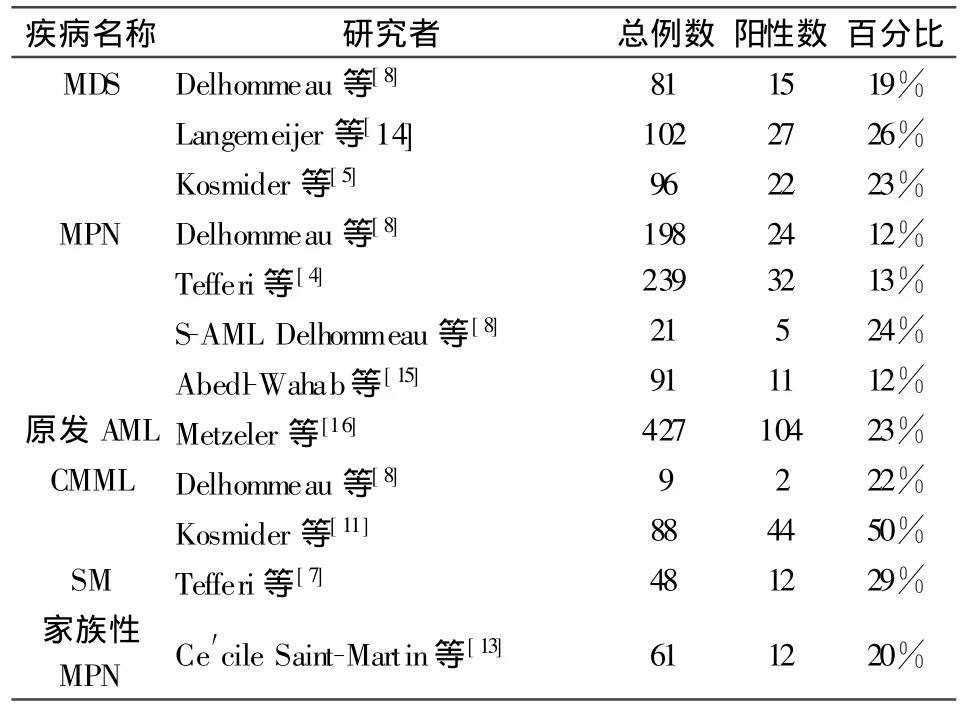
表1 几种常见血液肿瘤患者TET2突变的检测结果
4 TET2基因的作用机制
TET2被发现高表达于正常CD34(+)祖细胞、粒细胞、单核细胞、淋巴细胞、NK细胞和红系前体细胞,并且在AML细胞系的粒系分化加强时出现增量调节,这与TET2在正常髓系造血过程中的作用类似[17]。Acquaviva等[18]推测TET2的失活可能使得早期造血干细胞及骨髓细胞分化过程失控,从而造成一系列后果。目前认为,TET2基因编码的TET2蛋白可阻止细胞不可控的生长,从而阻止肿瘤形成。因此TET2突变通过不同方式使TET2蛋白成为一种无功能的蛋白,而这些无功能的TET2蛋白可能导致造血干细胞不可控的生长及分化。
5 TET2基因检测在各血液肿瘤中的临床价值
5.1 TET2与MDS
目前为止,TET2是MDS中发现的突变最频繁的基因。Langemeijer等[14]采用SNP阵列的基因组分析和基因组测序对102例MDS患者进行研究,其中26%的患者出现TET2基因的缺失、错义、无义突变,进一步利用等位基因分析在大多数骨髓细胞中检测到TET2突变(中位数96%)。TET2突变还被发现在各种不同分化谱系中,其中包括CD34+祖细胞,表明TET2突变发生在疾病演化的早期。Flach等[19]报道一组RARS-T的患者中TET2的突变发生率为26%。
Kosmider等[5]的研究纳入了96例MDS患者,发现22例(22.9%)患者存在各种形式的TET2突变。进一步预后分析发现,突变患者5年生存率为76.9%,而无突变患者为18.3%。Cox比例风险模型中无TET2突变患者危险度增至4.1倍。TET2突变发生在国际预后评分系统(IPSS)定义的所有亚型中,并且在低危(41%)和中危I(27%)组中比中危II(13%)和高危(14%)组中出现的频率要高。然而,TET2在多系列细胞减少和原始细胞增多的病例中出现的并不频繁。Kosmider等[5]分析发现无突变患者的五年总生存率和三年无病生存率分别为18%和64%,显著低于突变者的77%和89%,表明TET2突变是MDS预后良好的指标之一。
5.2 TET2与CMML
Tefferi等[7]和Delhommeau等[8]报道在CMML中TET2的突变率为15%-22%,Kosmider等[11]报道的突变率则高达50%。Kosmider等进一步分析初诊患者TET2突变的检出率为42%(18/43),疾病进展期患者检出率为58%(26/45),且与患者生存率较低有关;对符合WHO 2008 CMML-1的患者29例进行分析,存在TET2突变的患者生存率低于无突变患者,其差异具有统计学意义。因此,TET2突变在CMML患者中较在其他造血系统疾病亚群中更为常见,并且是患者预后不良的影响因素。在已经观察到的系统性肥大细胞增多症的患者中TET2基因的改变和单核细胞增多之间具有联系,这可以表明在单核细胞谱系的分化控制上TET2基因发挥负性作用[11],这也许是TET2影响CMML的机制。
5.3 TET2与AML
AML可以是原发的,也可以由MDS、MPN或其他血液疾病转化而来。TET2是位于染色体4q24的断裂点,而这个断裂点也同时包括许多其他AML相关的染色体改变,如t( 3;4)(q26;q24),t(4;5)(q24;p16),t(4;7)(q24;q21)和 del(4)(q23q24)[4],因此或者可以推断TET2突变与AML的发生具有一定的相关性。
在MDS导致的继发性AML,Tefferi等[7]发现7例MDS转化AML患者中有3例存在TET2突变,Delhommeau等[8]报道了21例MDS转化AML患者中TET2突变率为24%。
Abdel-Wahab[20]等分析了63例由MPN转化的AML患者,TET2突变率为26.3%,与MDS转化AML和原发AML之间没有明显差别。将每例患者MPN慢性期与继发AML期配对研究发现,5例JAK2 V617F阳性患者TET2突变出现在继发的AML期而不出现在与MPN慢性期,其中2例在继发AML期JAK2 V617F转为阴性,也发现了JAK2/TET2野生型的MPN患者转变成为了JAK2野生型/TET2突变型的AML。因此,作者认为TET2突变可在MPN向白血病转化的过程中获得,此与Delhommeau等[8]认为在MPN的发病机理中TET2是先于JAK2 V617F获得的说法刚好相反。Couronne等[21]的研究数据显示并不是所有继发于JAK2 V617F阴性MPN的AML患者能够检测到TET2突变,与Abdel-Wahab等的发现一致,提示TET2突变可以同其他突变一起导致不依赖于JAK2 V617F的AML。
Abdel-Wahab等[15]检测了原发和继发AML患者93例,TET2突变率为12%,8例突变患者5年总生存率显著低于无突变患者。该组研究突变患者仅8例,尚需要大样本的研究进一步证实。
Klaus等[16]对细胞遗传学正常的原发急性髓系白血病(CN-AML)患者基因序列进行分析后发现,有23%的患者存在TET2突变,并且与野生型TET2患者相比,这种突变与年龄(P<0.001)和治疗前的高白细胞计数有关(P<0.04)。根据欧洲白血病网分类,在有CEBPA突变和(或)NPM1突变,但无FLT3-ITD的CN-AML患者中(预后良好组),有TET2突变者比TET2野生型患者有相对低的无事件生存(P<0.01)和无病生存(P=0.03),同时也具相对低的完全缓解率与总生存率。而在野生型CEBPA、野生型NPM1和(或)FLT3-ITD的CN-AML患者中(中危组),TET2突变与否和患者预后无明显相关。这表明在CN-AML预后良好组中,TET2突变的检测对患者预后的判断有一定价值。
5.4 TET2与MPN
MPN是一组造血干细胞肿瘤增殖性疾病,它包括特发性血小板增多症(ET)、真性红细胞增多症(PV)和原发性骨髓纤维化(PMF)。这些疾病的共同特点是骨髓细胞的过度增生,并且高风险向AML转化。Delhommeau[8]等报道有或无 JAK2V617F突变198例MPN患者有24例(12%)出现TET2突变,发现MPN的不同亚型和不同阶段TET2突变的频率明显不同。研究数据还显示ET患者的TET2突变率较低,可能与本病发病年龄相对小有关。
Tefferi[4]等评估239例BCR-ABL1阴性的MPN,如 PV、ET、PMF、继发PMF 及幼稚细胞期的 MPN,发现TET2突变率为13%,且突变在大于等于60岁以上老年人为23%,要远高于其在年轻人中的突变率(4%)。
MF患者在诊断后的第一个10年向AML转化的发生率为8%-23%,PV和ET患者诊断后18年内向AML转化率为4%-8%,且普遍预后不佳。Abdel-Wahab等[15]认为MPN向AML转变与TET2突变的获得有关,其中14例此类患者中有6例发生了突变。
5.5 TET2与系统性肥大细胞增多症(SM)
SM是一种皮肤、骨骼、淋巴结、内脏及单核-巨噬细胞系统中肥大细胞异常增生为特征的较少见的疾病。根据肥大细胞侵犯的器官不同,临床上可分为皮肤受累型、皮肤及骨骼受累型、骨骼/肝脾淋巴结受累型及肥大细胞增生症合并肥大细胞性白血病四种类型。
Tefferi等[12]用高通量DNA序列分析了48例SM患者的骨髓DNA,其中包括42例符合WHO 2008诊断标准的患者和6例有FIP1L1-PDGFRA融合基因的患者。12例(29%)SM患者存在TET2突变,FIP1L1-PDGFRA阳性患者未发现TET2突变。多变量分析显示TET2突变与单核细胞增多和女性两个因素有关。Tefferi还发现在大多数受侵袭的患者中,KIT D816V可能需与TET2突变共同决定表型遗传,两者相互独立影响临床表型,为TET2突变和单核细胞增多之间惊人的联系提供了强有力的论据[11]。
5.6 TET2与家族性骨髓增殖性肿瘤
家族性骨髓增殖性肿瘤具有家族集聚发病的特点,已经发现的JAK2 V617F突变不能解释在家族性骨髓增殖性肿瘤中出现的表型差异。Saint-Martin等[13]研究分析来自42个家族61例MPN患者TET2基因突变,12例JAK2 V617F阳性或阴性的患者中发现了15个明显突变。对一例有两个TET2突变患者不同阶段选取的五个样本分析显示JAK2 V617F和TET2突变在疾病演化过程中伴随出现。家族分离分析证实,TET2突变并非遗传而是后天获得的。家族性MPN患者与散发MPN患者的TET2突变频率和突变类型相似,且家族性MPN中不出现表型分离。因此,对于家族性骨髓增殖性肿瘤TET2的检测还有待于进一步研究。
5 结语
综上所述,TET2基因突变频繁的出现在各种髓系肿瘤中,与疾病的发生和预后相关。TET2突变是MDS的一个独立的有利预后指标,对于CMML患者则为预后不良的指标,在有CEBPA突变和(或)NPM1突变但无FLT3-ITD的CN-AML患者提示着不良预后。TET2突变对SM的表型有相对独立的影响,但对SM预后影响仍有待研究。
[1]Tahiliani M,Koh KP,Shen Y,et al.Conversion of 5-methylcytosine to 5-hydroxymethylcytosine inmammalian DNA by MLL partner TET1[J].Science,2009,324(5929):930.
[2]Viguie F,Aboura A,Bouscary D,et al.Common 4q24 deletion in four cases of hematopoietic malignancy:early stem cell involvement[J].Leukemia,2005,19:1411.
[3]Delhommeau F,Dupont S,James C,et al.TET2 is a novel tumor suppressor gene inactivated in myeloproliferative neoplasms:identi?cation of a pre-JAK2V617F event.ASH AnnuMeet Abstr2008;112:lba-lb3.Latebreaking abstract.
[4]Tefferi A,Pardanani A,Lim KH,et al.TET2 mutations and their clinical correlates in polycythemia vera,essential thrombocythemia andmyelofibrosis[J].Leukemia,2009,23:905.
[5]KosmiderO,Gelsi-Boyer V,Cheok M,et al.TET2mutation is an independent favorable prognostic factor in myelodysplastic syndromes(MDS)[J].Blood,2009,114:3285.
[6]Saint-Martin C,Leroy G,Delhommeau F,et al.Analysis of the ten-eleven translocation 2(TET2)gene in familial myeloproliferative neoplasms[J].Blood,2009,114:1628.
[7]Tefferi A,Lim K-H,Abdel-Wahab O,et al.Detection of mutant TET2 in myeloid malignancies other than myeloproliferative neoplasms:CMML,MDS,MDS/MPN and AML[J].Leukemia,2009,3:1343.
[8]Delhommeau F,Dupont S,Della Valle V,et al.Mutation in TET2 in myeloid cancers[J].N Engl J Med,2009,360(22):2289.
[9]Ross L.Levine,Martin Carroll,et al.A Common Genetic Mechanism in Malignant Bone Marrow Diseass[J].N Engl J Med,2009,360(22):2355.[10]Ross L.Levine.Mechanisms of mutations inmyeloproliferative neoplasms[J].Best Pract Res Clin Haematol,2009,(22):489 494.
[11]Kosmider O,Gelsi-Boyer V,Ciudad M,et al.TET2 gene mutation is a frequent and adverse event in chronic myelomonocytic leukemia[J].Haematologica,2009,94(12):1676.
[12]Tefferi A,Levine RL,Lim,K-H,et al.Frequent TET2 mutations in systemic mastocytosis:clinical,KITD816V and FIP1L1-PDGFRA correlates[J].Leukemia,2009,23:900.
[13]Saint-Martin C,Leroy G,Delhommeau F,et al.Analysis of the Ten-Eleven Translocation 2(TET2)gene in familial myeloproliferative neoplasms[J].Blood,2009,114:1628.
[14]Langemeijer SM,Kuiper RP,Berends M,et al.Acquired mutations in TET2are common in myelodysplastic syndromes[J].Nat Genet,2009,41:838.
[15]Abdel-WahabO,Mullally A,Hedvat C,et al.Genetic character-ization of TET1,TET2,and TET3 alterations in myeloid malignancies[J].Blood,2009,114:144.
[16]Metzeler KH,Maharry K,RadmacherMD,et al.TET2Mutations Improve the New European Leukemia Net Risk Classification of Acute Myeloid Leukemia A Cancer and Leukemia Group B Study[J].J Clin Oncol,2011,29(10):1373.
[17]Langemeijer SMC,Kuiper RP,Berends M,et al.Acquired mutations in TET2are common in myelodysplastic syndromes[J].Nature Genetics,2009,41(7):838.
[18]Acquaviva C,Gelsi-Boyer V,Birnbaum D.Myelodysplastic syndromes:lost between two states?[J].Leukemia,2010,24:1.
[19]Flach J,Dicker F,SchnittgerS,et al.Mutations of JAK2 and TET2,but not CBL are detectable in a high portion of patientswith refractory anemia with ring sideroblasts and thrombocytosis[J].Haematologica,2010,95(3):518.
[20]Couronne L,Lippert E,Andrieux J,et al.Analyses of TET2 mutations in post-myeloproliferative neoplasm acute myeloid leukemias[J].Leukemia,2010,24(1):201.
[21]Abdel-Wahab O,Manshouri T,Patel J,et al.Genetic Analysis of Transforming Events That Convert Chronic Myeloproliferative Neoplasms to Leukemias[J].Cancer Res,2010,70(2):447.

