结核分枝杆菌重组Ag85A、Ag85B蛋白免疫原性的研究
尹文东,于 庭,梁 艳,阳幼荣,肖 漓,王 兰,王 莹,史迎昌,张俊仙,吴雪琼*
(1.吉林大学第二医院,吉林长春 130041;2.中国人民解放军309医院全军结核病研究所北京 100091)
结核病是一种非常古老且迄今为止仍然严重影响人类健康的呼吸道传染病。具有近百年历史的卡介苗,由于其亚系的变异性和有限的保护作用,在应用中备受争议[1]。母牛分枝杆菌菌苗(Mycobacterium Vaccae,MV)具有与结核分枝杆菌(Mycobacterium tuberculosis,MTB)相似的抗原[2],富含介导保护性免疫反应的抗原,缺少介导变态反应的抗原,是一种良好的双向免疫治疗制剂[3]。Ag85复合物(主要由Ag85A、Ag85B和Ag85C组成)是MTB分泌的重要蛋白,具有分枝菌酸转移酶(Mycolyl-transferase)活性,在细胞壁的合成阶段发挥重要作用[4]。该复合物可以激发较强的细胞免疫,这对于以细胞免疫为主的机体抗结核反应具有重要意义。本研究将结核分枝杆菌rAg85A和/或rAg85B蛋白与MV联合免疫小鼠,通过动物实验观察两种蛋白的免疫效果,以期研发现有结核病治疗性疫苗的增强剂。
1 材料与方法
1.1 实验动物17-20 g、SPF级6-8周龄雌性BALB/c小鼠60只,购自中国人民解放军军事医学科学院实验动物中心。
1.2 主要试剂及其来源rAg85A、rAg85B蛋白由解放军309医院全军结核病研究所克隆、表达、纯化;冻干皮内注射用卡介苗购自成都生物制品研究所;冻干注射用母牛分枝杆菌菌苗(22.5 μ g/支)购自安徽龙科马生物制药有限责任公司;辣根过氧化物酶(HRP)标记的山羊抗鼠 IgG、IgG1和 IgG2a购自Southern Biotech;小鼠 ELISPOT试剂盒、Fluorescein Isothiocyanate(FITC)标记的抗鼠 IFN-γ、Phycoerythrin(PE)标记的抗鼠白介素-4(IL-4)、CD3-Percp、CD8-APC、溶血剂、破膜剂和γ 2a/γ同型对照购自美国BD公司。
1.3 动物分组与处理60只小鼠随机分为下列6组:(1)PBS组:每只小鼠肌肉注射 100 μ l PBS(pH7.4);(2)BCG组:每只小鼠皮内注射 100 μ l BCG;(3)MV 组:每只小鼠肌肉注射100 μ l MV(22.50 μ g);(4)rAg85A-MV 组:每只小鼠肌肉注射100 μ l的rAg85A 蛋白(100 μ g)和 MV(22.50 μ g);(5)rAg85BMV组:每只小鼠肌肉注射 100 μ l的rAg85B蛋白(100 μ g)和 MV(22.50 μ g);(6)rAg85A-rAg85B-MV组:每只小 鼠肌肉注射 100 μ l的 rAg85A(100 μ g)、rAg85B 蛋白(100 μ g)和 MV(22.50 μ g);每2 周免疫1次,共免疫3次。末次免疫结束后第14天,摘眼球采血,分离血清用于抗体检测,抗凝血用于流式细胞术检测;解剖小鼠取脾脏,分离T淋巴细胞,检测脾脏分泌IFN-γ的T淋巴细胞斑点数。
1.4 ELISA测定血清抗体以100 μ l rAg85A/rAg85B蛋白(终浓度分别为5 μ g/ml)包被于酶标板中,4℃过夜;用PBST(含0.05%吐温20的PBS)洗板3次 ;每孔加入 200 μ l含 10%胎牛血清(FBS)的PBS,37℃封闭1小时,PBST洗板3次;加入1∶100倍稀释的待测血清,37℃温育2小时,PBST洗板5次;加入1:6000倍稀释的HRP标记的羊抗鼠IgG、IgG1和IgG2a抗体,37℃温育1小时,PBST洗板7次;加入TMB底物显色15分钟,2 mol/L硫酸终止反应。以空白对照调校零点,酶联免疫检测仪测定450 nm的OD值,以两孔平均值作为终结果。
1.5 ELISPOT检测脾脏分泌IFN-γ的T淋巴细胞斑点数小鼠脾脏在200目细胞筛上研磨,将悬液离心,用淋巴细胞分离液和细胞培养液RPMI-1640离心、洗涤、制备淋巴细胞悬液,调节脾淋巴细胞浓度为4×106/ml。每份标本需微孔板3孔,先向每孔加入100 μ l淋巴细胞悬液,再向阴性孔、阳性孔和检测孔中分别加入细胞培养液、植物血凝素(终浓度为20 μ g/ml)、rAg85A/rAg85B 蛋白(终浓度分别为 20 μ g/ml),置 37℃CO2温箱中温育 48小时,按照ELISPOT试剂盒说明操作。以各组小鼠空白对照孔为对照,计算各组小鼠检测孔的细胞斑点数。
1.6 流式细胞术检测全血单个核细胞内Th1、Th2百分比每个标本取一支有盖的Faclon管,各加入500 μ l抗凝血 、500 μ l细胞培养液 RPMI-1640 和22 μ l rAg85A/rAg85B蛋白(终浓度分别为20 μ g/ml),混匀后置于37℃避光孵育4-6小时;每份标本取两支试管 ,标记1-对照 ,2-样本,每管各加入 200 μ l刺激好的血,再分别加入CD3-Percp和CD8-APC,混匀后置室温避光孵育10分钟;加入破膜的A液,混匀后避光孵育5分钟;用蒸馏水按1∶10稀释溶血素,每管各加入2 ml,混匀后避光孵育10分钟;取出后1 200 rpm离心5分钟,弃去上清,加入破膜的B液,同时加入胞内荧光抗体,1管加入同型对照γ 2a/γ,2管加入IFN-γ-FITC/IL-4-PE,振荡混匀,室温避光孵育15分钟;每管各加入含2%FBS的PBS,1 200 rpm离心5分钟,弃上清;各加入500 μ l PBS,应用BD 公司FACSCalibur流式细胞仪进行分析。
1.7 统计学分析所有计量数据均用¯x±s表示。使用SPSS11.5统计软件进行单因素方差分析。假设检验的显著性水准取 α=0.05。
2 结果
2.1 小鼠血清抗体水平通过ELISA方法检测各组小鼠血清中抗rAg85A/rAg85B蛋白抗体IgG、IgG1和IgG2a的结果见表1。三个实验组小鼠血清抗体水平均显著高于三个对照组(P<0.001),三个实验组间无显著差异(P>0.05);BCG组和MV组小鼠抗体水平也显著高于PBS组(P<0.05);各组小鼠IgG2a水平均略高于IgG1。
2.2 小鼠脾脏分泌IFN-γ的T淋巴细胞斑点数用ELISPOT方法检测各组小鼠脾脏分泌IFN-γ的T淋巴细胞斑点数的结果见表2。三个实验组和两个阳性对照组分泌IFN-γ的T淋巴细胞斑点数均显著高于PBS组(P<0.05),升高最多的是BCG组,其次是rAg85A-rAg85B-MV组和MV组,这三组间无显著差别(P>0.05)。
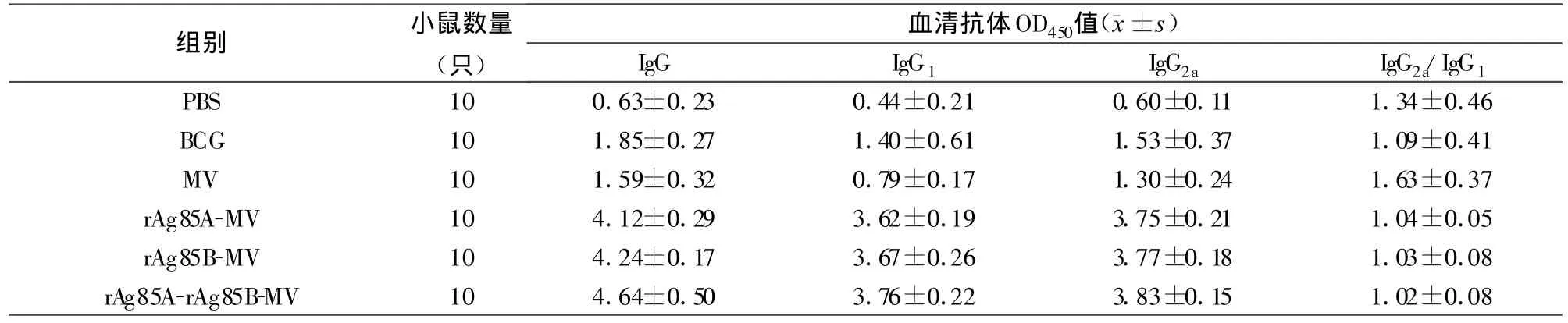
表1 各组小鼠血清中抗rAg85A/rAg85B蛋白抗体水平

表2 小鼠脾脏分泌IFN-γ的 T淋巴细胞斑点数
2.3 全血单个核细胞内Th1、Th2百分比及 Th1/Th2比值流式细胞术检测小鼠全血单个核细胞内Th1、Th2百分比及Th1/Th2比值的结果见表3。Th1百分比结果显示:rAg85A-rAg85B-MV组小鼠较其它5组升高最显著(P<0.001);MV组较阴性对照组升高较多(P<0.05),低于三个实验组分泌水平(P<0.05),与BCG组无显著性差异(P>0.05);rAg85AMV组与rAg85B-MV组无显著差别(P>0.05)。Th2百分比结果显示:MV组较阴性对照组和三个实验组升高显著(P<0.05),与 BCG组差别不大(P>0.05);三个实验组与PBS组间也无显著差别(P>0.05)。三个实验组Th1/Th2比值均明显高于三个对照组(P<0.05),rAg85A-rAg85B-MV组较其它5组升高最显著(P<0.001)。
表3 全血单个核细胞内 Th1、Th2的百分比及Th1/Th2 比值 (±s)
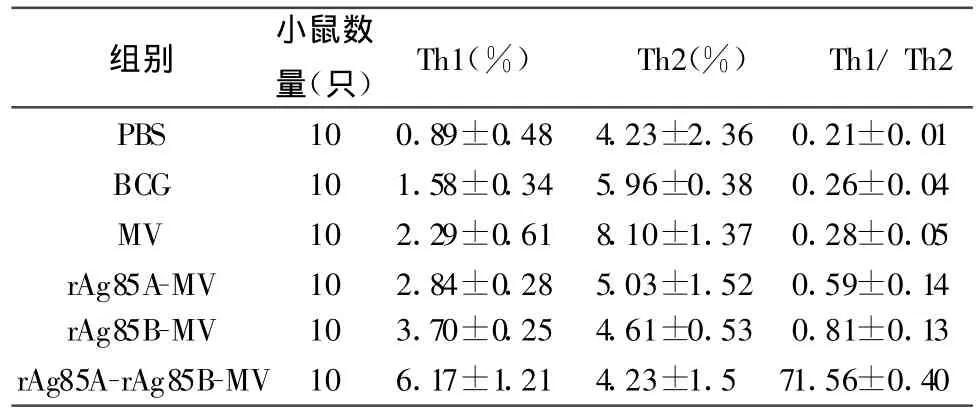
表3 全血单个核细胞内 Th1、Th2的百分比及Th1/Th2 比值 (±s)
组别 小鼠数量(只)Th1(%) Th2(%) Th1/Th2 PBS 10 0.89±0.48 4.23±2.36 0.21±0.01 BCG 10 1.58±0.34 5.96±0.38 0.26±0.04 MV 10 2.29±0.61 8.10±1.37 0.28±0.05 rAg85A-MV 10 2.84±0.28 5.03±1.52 0.59±0.14 rAg85B-MV 10 3.70±0.25 4.61±0.53 0.81±0.13 rAg85A-rAg85B-MV 10 6.17±1.21 4.23±1.5 71.56±0.40
3 讨论
世界卫生组织20世纪90年代关于结核病研究与发展规划中指出:MV是唯一被推荐的免疫治疗制剂。其药效学和免疫学研究显示:MV能促进T淋巴细胞的增殖反应;启动Th1型细胞免疫,刺激机体产生IFN-γ和IL-2。动物实验证明:用MV免疫小鼠,再感染MTB后,小鼠脾脏分泌多量IFN-γ和IL-2[5],可有效的抵御MTB的感染。MV用于人类结核病治疗具有一定的促进菌阳肺结核阴转、空洞闭合、缩短疗程的作用。Johnson[6]等报道:选择新近诊断的肺结核病人,化疗7天后,实验组加用MV,对照组加用安慰药,实验组1个月后痰菌阴转率及6个月后胸片改善情况均好于对照组(P<0.05)。曹赋[7]等收治了328例复治肺结核患者,随机分为MV+化疗组和单纯化疗组,经过半年治疗后,发现MV联合化疗组的空洞闭合率较单纯化疗组明显升高(P<0.001)。因MV应用方法简便,无毒性反应,不良反应轻微,目前在临床上已广泛用于结核病的辅助治疗。
Ag85复合物是目前在结核病疫苗研制方面最受关注的抗原。周晔[8]通过实验证明:重组Ag85A蛋白具有较好的免疫原性,能有效刺激外周血单个核细胞产生细胞增殖反应和细胞毒活性。Giri[9]应用Ag85AB融合蛋白疫苗治疗小鼠结核病模型,实验组小鼠脾脏和肺脏细菌数较对照组显著减少(P<0.05),治疗后的小鼠不但增强了Th1型免疫反应,而且抑制了IL-4的分泌。综合以上研究报道,本实验将rAg85A、rAg85B蛋白与MV联合应用,研究其免疫效果,以寻求提高MV治疗效果的增强剂。目前国内外尚未见报道。
本文研究结果显示,rAg85A和/或 rAg85B蛋白与MV联合免疫后,小鼠血清中抗 rAg85A和/或rAg85B蛋白抗体水平均显著高于三个对照组,说明rAg85A和rAg85B蛋白具有较好的免疫原性,与MV联合免疫成功。姜德华[10]等用Ag85B/ESAT6融合蛋白,联合DDA/MPL为佐剂免疫BALB/c小鼠,其产生的特异性IgG抗体效价较对照组明显升高,本实验中MV本身具有免疫佐剂作用,与Ag85联合应用,无需另外加佐剂便可获得较好的免疫效果。目前研究表明BALB/c小鼠IgG2a升高代表机体主要是以Th1型反应为主,IgG1升高代表机体主要是以Th2型反应为主。本研究各组小鼠血清IgG2a水平均略高于IgG1,说明各组小鼠的免疫状况以Th1型反应为主。Giri[11]等用Ag85AB复合蛋白免疫小鼠后,产生了抗Ag85AB蛋白的特异性IgG抗体,且IgG2a水平较高。本实验结果与报道符合。
IFN-γ是Th1类细胞分泌的最重要的免疫分子,贯穿于抗结核的整个过程,它不仅可以激活巨噬细胞,酸化吞噬体,还可增强自然杀伤细胞的能力,刺激细胞毒T淋巴细胞的增殖分化。Young[12]以一种高度减毒的牛痘病毒(modified vaccinia ankara virus,MVA)为载体,将编码Ag85A的基因导入其中,组成重组疫苗免疫小鼠,激发了强烈的Th1型反应。本文通过ELISPOT方法检测各组小鼠脾脏分泌IFN-γ的T淋巴细胞斑点数,结果显示三个实验组和两个阳性对照组小鼠的T淋巴细胞斑点数均高于阴性对照组,证明 BCG、MV、rAg85A 和/或 rAg85B蛋白与MV联合免疫均具有较强的刺激T淋巴细胞分泌IFN-γ的能力。
全血单个核细胞内Th1、Th2百分比及Th1/Th2比值可以反应机体的免疫应答类型,Th1百分比升高代表机体以细胞免疫为主,Th2百分比升高代表机体以体液免疫为主。本研究通过流式细胞术检测发现,三个实验组Th1型细胞百分比及Th1/Th2比值较三个对照组均有升高,进一步证明rAg85A和rAg85B蛋白联合MV可以明显增强小鼠的Th1型细胞免疫反应;BCG组和MV组小鼠Th2百分比升高较高,说明二者不仅可以产生细胞免疫,也可刺激机体产生较强的体液免疫。Malowany[13]等也获得类似的结果,他们将表达Ag85A的树突状细胞制成疫苗,发现其在提高CD4+T细胞、CD8+T细胞百分比及CD4+/CD8+比值方面均较单独Ag85A蛋白疫苗升高显著。Lozes[14]等用Ag85A、Ag85B和Ag85C疫苗免疫小鼠,结果显示:前两种DNA疫苗的免疫效果较好,可刺激小鼠产生较高的IFN-γ,IL-12和肿瘤坏死因子,而IL-4、IL-6和IL-10水平较低或检测不出,间接反映出Ag85A和Ag85B能够升高Th1型细胞比例,抑制Th2型细胞分泌。
总之,结核分枝杆菌rAg85A和rAg85B蛋白具有很强的免疫原性,与MV联合免疫可增强其Th1型细胞免疫应答。我们将在结核病动物模型上进一步研究它们联合免疫的治疗效果。
[1]Zwerling A,Behr MA,et al.The BCG World Atlas:A Database of Global BCG Vaccination Policies and Practices[J].PLos Medicine,2011,8(3):1001.
[2]Stanford JL,BahrGM,et al.Immunotherapy with Mycobacterium vaccae as an adjunct to chemotherapy in the treatment of pulmonary tuberculosis[J].Tubercle,1990,71(2):87.
[3]陈兰举,潘家华,等.结核感染小鼠肺部病理变化与T细胞免疫关系的实验研究[J].中国微生态学杂志,2008,20(3):213.
[4]Nagdev KJ,Kashyap RS,et al.Comparative evaluation of a PCR assay with an in-house ELISA method for diagnosis of Tuberculous meningitis[J].Med Sci Monit,2010,16(6):289.
[5]Skinner MA,Yuan S,et al.Immunization with heat-killed Mycobacterium vaccae stimulates CD+8 cytotoxic T cells specific formacrophages infected withMycobacterium tuberculosis[J].Infection and Immunity,1997,65(11):4525.
[6]Johnson JL,Kamya RM,et al.Randomized controlled trial of Mycobacterium vaccae immunotherapy in non-human immunodeficiency virus-infected ugandan adults with newly diagnosed pulmonary tuberculosis[J].J Infect Dis,2000,181(4):1304.
[7]曹 赋,李文志,等.母牛分枝杆菌菌苗治疗难治性肺结核病疗效观察[J].中国社区医师,2010,23(12):26.
[8]周 晔,蒋天舒,等.结核杆菌Ag85A重组蛋白的免疫原性研究[J].中国实验诊断学,2007,11(9):1153.
[9]Giri PK,Verma I,et al.Adjunct immunotherapy with Ag85 complex proteinsbased subunit vaccine in a murine model of Mycobacterium tuberculosis infection[J].Immunotherapy,2009,1(1):31.
[10]姜德华,孔 维.结核分枝杆菌融合蛋白疫苗(Ag85B-ESAT6)的构建及免疫学特性研究.吉林大学硕士学位论文,2010.
[11]Giri PK,Verma I,et al.Enhanced immunoprotective potential of Mycobacterium tuberculosis Ag85 complex protein based vaccine against airway Mycobacterium tuberculosis challenge following intranasal administration[J].FEMS Immunol Med Microbiol,2006,47(2):233.
[12]Young SL,Slobbe LJ,et al.Immunogenicity and protective efficacy of mycobacterial DNA vaccines incorporating plasmid-encoded cytokines against Mycobacterium bovis[J].Immunol Cell Biol,2010,88(6):651.
[13]Malowany JI,McCormick S,et al.Development of cell-based tuberculosis vaccines:genetically modified dendritic cell vaccine is a much more potent activator of CD4 and CD8 T cells than peptide-or protein-loaded counterparts[J].Mol Ther,2006,13(4):766.
[14]Lozes E,Huygen K,et al.Immunogenicity and efficacy of a tuberculosis DNA vaccine encoding the components of the secreted antigen 85 complex[J].Vaccine,1997,15(8):830.

