肝癌射频消融后肝内局部复发的相关因素
文兆明
(萍乡市湘雅萍矿合作医院,江西萍乡 337000)
目前,射频消融(radiofrequency ablation RAF)等局部微创治疗某种程度上已成为肝癌(尤其小肝癌)患者外科手术的良好补充和替代。射频消融治疗疗效好、创伤小、并发症少而轻,可重复性强,患者恢复快、生活质量高[1][2]。我院较早进行了RFA规范化治疗研究,对中晚期为主的肝癌采用诸多治疗策略,取得了较好疗效,但实践中常发现射频消融后肝内肿瘤复发的现象[3],本研究通过总结我院有随访记录的HCC患者262例的治疗资料,以探讨RFA后肝内肿瘤复发的发生机制和影响因素。
1 对象与方法
1.1 对象2004年2月至2005年3月我院RFA治疗341例肝癌,均为首发癌,根据超声、CT或MRI等影像学表现及甲胎蛋白(AFP)加以确诊,并对其中173例实施针刺活检加以诊断。患者中132例因多发、高龄、严重心血管或其他脏器疾病、肝功能损害等原因不能或不宜肝脏外科切除术,其余患者拒绝手术而选择RFA。肿瘤大小0.6-10.4 cm,平均4.3 cm。男191例,女 71例。年龄 31-81岁,平均 55岁。肝功能Child-Pugh A,B,C级分别为88、143、31例。
1.2 仪器和方法射频治疗仪为美国产RITA 1500型,314例HCC在超声引导下经皮进行治疗,27例HCC行开腹射频治疗。所有患者均在术后通过回院复查、电话和信件等方式进行随访,262(76%)例患者得到有效随访记录。通常的做法是,术后两年内每隔2-3个月复查一次,以后每隔3-6个月复查一次。复查项目主要包括AFP、B超、胸片,必要时加做CT、MRI等,以评估治疗效果及复发情况。随访时间为3年。将20项可能对RFA治疗后的复发产生影响的因素进行量化赋值,采用Kaplan-Meier模型及log-rank检验进行了生存分析,各组之间的复发率比较采用了χ2或Fisher exact分析,单因素分析有意义的变量采用Binary logistic方法进行多因素分析。P<0.05为差异有统计学意义,统计软件使用SPSS l3.0软件。
2 结果
2.1 生存率至2008年7月,25例肝脏转移癌(胃癌、胰腺癌等)、237例原发性肝癌(HCC)存活164例,死亡98例,采用Kaplan-Meier方法计算原发性肝癌RFA治疗后1,2,3年的生存率(表1)及生存曲线(图1)。

表1 237例HCC射频消融生存率
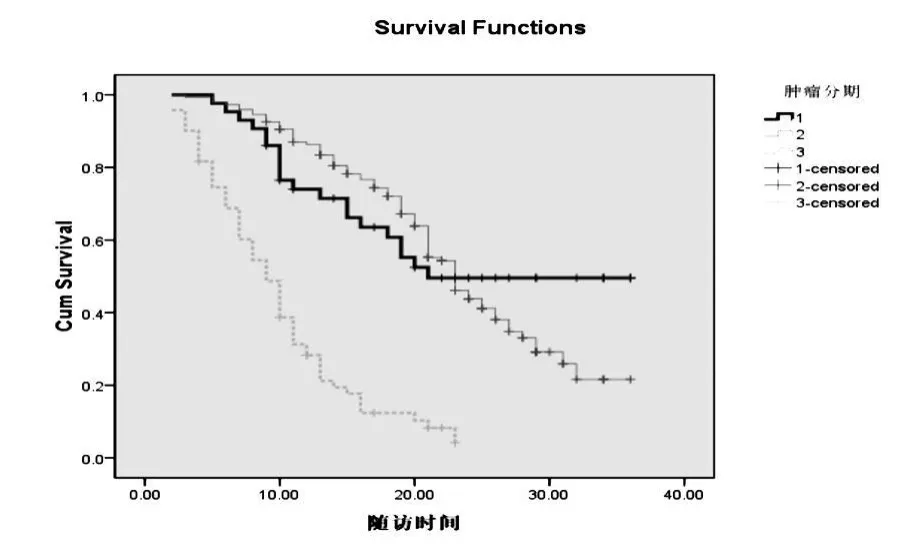
图1
2.2 单因素分析20项指标中,1肿瘤病理分级、2距肝内大血管距离、3治疗安全范围,4肿瘤定位、5肿瘤大小、6血管癌栓、7门脉癌栓共计7项因素与肿瘤术后复发影响较大(表2)。性别、年龄、肝功能Child-Pugh分级、肿瘤形状、RFA前甲胎蛋白(AFP)水平、发现方式、肿瘤占据叶数、肿瘤数目、肝硬化、肝功能酶学指标、门静脉高压、治疗中针尖温度、射频仪器阻抗等13项指标,对生存期的影响差异无统计学意义(P>0.05)
2.3 多因素分析将单因素分析有统计学意义的因素引人logistic模型,筛选出与预后相关的多因素为:(1)治疗安全范围,(2)离大血管的距离,(3)病理分级,(4)肿瘤大小(表3)。
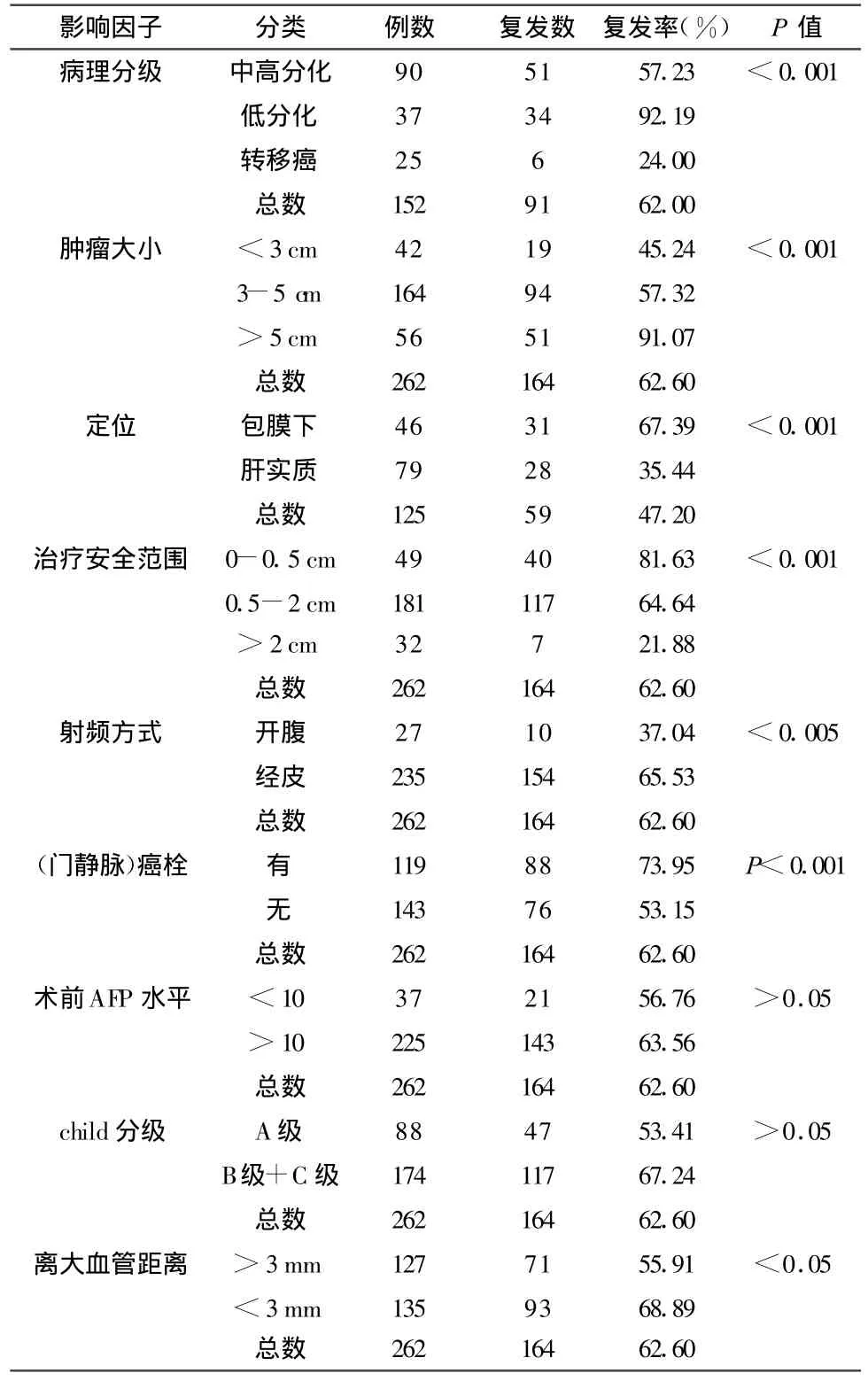
表2 262例肝癌射频治疗后肿瘤复发的单因素分析
3 讨论
肝癌的AJCC分期对肿瘤的愈合有较强的预测价值。本研究显示Ⅰ、Ⅱ、Ⅲ期肝癌患者RFA治疗后预后生存率差异明显,其中Ⅰ期患者愈合较佳,与多数医院手术切除后的生存率相近。
本组资料将肝癌病理类型分为高分化型、中低分化型和转移癌3组,单因素及多因素分析均显示3组复发率有明显差异。肿瘤的分化程度是反映肿瘤生物学特性的指标之一,肿瘤术后复发与肿瘤的生物学特性有关,肿瘤坏死后细胞间黏附力减低,低分化癌较高分化癌更易发生侵袭和转移,这是导致术后复发的重要因素,也可能是导致生存期较短的原因。
此前有研究[4]发现肿瘤体积是局部复发的重要危险因素,本研究也再次证实了这一点,RFA装置单次最大消融灶为5 cm,治疗较大肿瘤需多点布针重叠消融。为了达到使肿瘤完全灭活的目的,治疗区域需完全覆盖肿瘤周边0.5-1.0 cm以上,并按计算出的覆盖肿瘤所需消融灶数目进行规范化治疗。肿瘤直径较小的情况下,单次热凝即可覆盖肿瘤及其边缘,而较大直径的肿瘤,虽然可以反复多点毁损,但因组织碳化或坏死过程中出现汽化干扰观察,难以准确定位,各个球形的毁损区间可能会留下无法重叠到的盲区,致使肿瘤毁损不彻底,不规则的某个边缘可能存活肿瘤细胞造成局部的复发。而且当肿瘤过大、肿瘤邻近重要脏器结构(如隔肌、消化管、肝门区等)可使治疗范围明显受限,不能或者难以应用超过肿瘤周边的治疗方案,致肿瘤复发率明显升高。
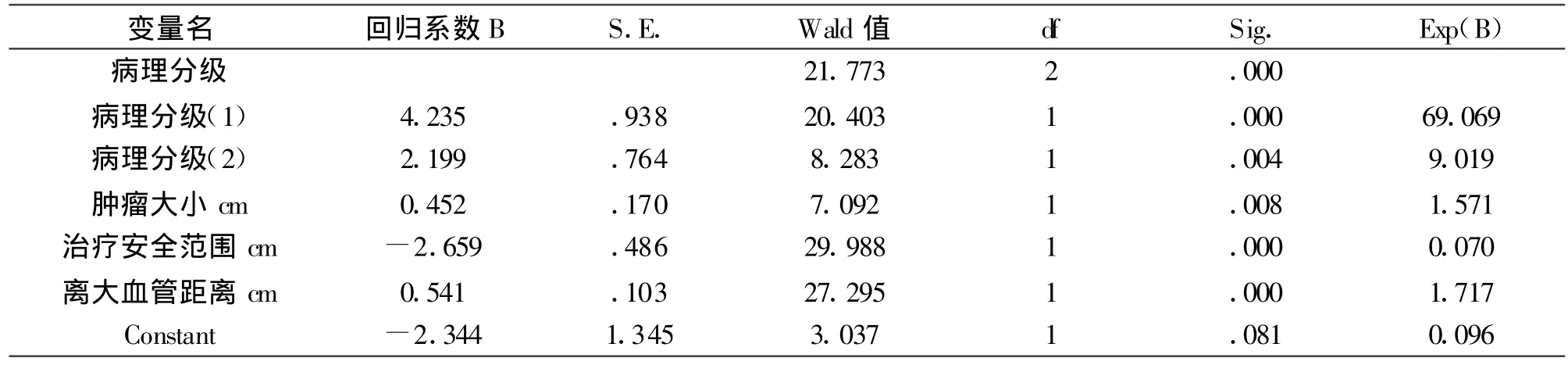
表3 262例肝癌多因素logistic回归分析结果
多数报道证实RFA消融范围扩大达1 cm以上时消融更为彻底[5]。本研究中的单因素分析可知,安全范围小于0.5 cm组局部复发率明显高于0.5 cm以上组。说明当肝功能及肿瘤局部解剖条件允许时,应尽可能扩大消融范围到肿瘤周边0.5 cm甚至2.0 cm以上,可以获得更好疗效。多因素分析也证明,治疗的安全范围对术后复发有明显作用[6]。这主要是由肿瘤组织向周围浸润!而早期肉眼无法看到,据报道小肝癌向肉眼可见的边界外浸润的发生率是60%,而大肝癌中向肉眼可见的边界外浸润的发生率是67%[7]。Nakazawa T[8]通过研究证实,5 mm是射频消融和手术切除的最低范围,少于5 mm的治疗范围将会使复发率明显升高。
多因素和单因素分析均表明,肿瘤离大血管越近,越容易复发,这是因为(1)肿瘤血行播散的机率会相对增大,引起肝内外复发。(2)大量的血液可将部分热量带走,局部温度下降,靠近大血管一侧的肿瘤达不到治疗温度,肿瘤无法完全灭活,从而使治疗不完全。(3)RFA期间能量的释放可能增加了肿瘤内部的压力,助长了肿瘤在血管内的播散,可张开式电极展开的针有可能推动有迁移能力的肿瘤细胞进入血管分支。(4)对肿瘤血管进行栓塞化疗后,对于直径小于3 cm的肿瘤,可明显减少肿瘤术后的局部复发,主要是减少了肿瘤的血性播散[9]。
肿瘤位于肝包膜下是复发的又一危险因素。对于经皮射频消融治疗而言,当肿瘤位于肝包膜下,为避免损伤临近的器官(膈肌、腹壁等),以及损伤肝包膜至大出血,因此进针常常偏深,热凝常不能完全覆盖肿瘤边缘区域,致使治疗不彻底而容易复发[10]。
单因素分析表明,经腹腔镜以及开腹射频毁损的复发率低。主要原因是开腹的情况下,经超声的观察更清晰,更准确地定位。开腹外科手术对电极的操作更为容易,可以到达到一些经皮治疗难以到达的位置,便于反复多次操纵,对于肿瘤可以确保覆盖肿瘤周围的区域,卫星灶也能够不被遗漏。同时外科手术可避免损伤膈肌(腹壁等肝周围器官),对于肝包膜下的肿瘤治疗也更为彻底[11]。
本研究还发现血管浸润也与术后局部复发有关,这可能与门脉癌栓患者更容易发生广泛播散,或者在射频治疗前肝内可能已经形成多个转移的微环境有关,治疗后肿瘤周围的不可见卫星结节仍旧存在活力,射频治疗后便快速生长起来。此外由于卫星结节可能来源于门静脉系统的肝内转移,先前存在的微转移灶也可能与门脉癌栓有关.射频的热效应可能增加了肿瘤的恶性潜力,造成术后复发[12]。
本研究的单因素分析发现肿瘤位于肝包膜下、手术入路和血管癌栓与复发有关,Logistic回归分析却不支持二者作为RFA后肿瘤复发的独立影响因素,但从上述分析得知,这三种因素目前不能排除,有待更多的临床资料加以验证。
本研究说明射频消融疗效确切[13,14],但对病例选择和治疗必须谨慎,对于肿瘤体积较大、位于肝脏主要血管附近的低分化肿瘤,伴有血管癌栓的肿瘤,情况充许时最好射频消融前首先实施TACE治疗,以最大限度减少术后发生肿瘤复发的风险。射频时应用合理规范的治疗方案,包括完全不遗漏地覆盖消融肿瘤,尽可能的扩大射频的范围,能提高肿瘤灭活率,减少复发,获得良好预后,有助于提高肝癌RFA远期生存率[15]。
[1]Ren ZG,Gan YH,Fan J,Chen Y,et al.Treatment of postoperative recurrence of hepatocellular carcinoma with radiofrequency ablation comparing with repeated surgical resection[J].Zhonghua Wai Ke Za Zhi,2008,46(21):1614.
[2]Liang HH,ChenMS,Peng ZW,et al.Percutaneous radiofrequency ablation versus repeat hepatectomy for recurrent hepatocellular carcinoma:a retrospective study[J].Ann Surg Oncol,2008,15(12):3484.
[3]Eisele RM,SchumacherG,Neuhaus P.Local recurrence following hepatic radiofrequency ablation:diagnosis and treatment[J].Strahlenther Onkol,2008,184(11):598.
[4]Zytoon AA,Ishii H,Murakami K,et al.Recurrence-free survival after radiofrequency ablation of hepatocellular carcinoma.A registry report of the impact of risk factors on outcome[J].Jpn J ClinOncol,2007,37(9):658.[5]Kudo M.Local ablation therapy for hepatocellular carcinoma:current status and future perpectives[J].J Gastroenterol,2004,39(3):205.
[6](Kei SK,Rhim H,Choi D,et al.Local tumor progression after radiofrequency ablation of liver tumors:analysis of morphologic pattern and site of recurrence[J].AJR Am J Roentgenol,2008,190(6):1544.)(Okuwaki Y,Nakazawa T,Shibuya A,et al.Intrahepatic distant recurrence after radiofrequency ablation for a single small hepatocellular carcinoma:risk factors and patterns[J].J Gastroenterol,2008,43(1):71.)
[7]Lai EC,You KT,Ng IO,et al.The pathological basis of resection margin for hepatocellular carcinoma[J].World J Surg,1993,17(6):786.
[8]Nakazawa T,Kokubu S,Shibuya A,et al.Radiofrequency ablation of hepatocellular carcinoma:correlation between local tumor progression after ablation and ablative margin[J].AJR Am J Roentgenol,2007,188(2):480.[9]Berber E,Siperstein A.Local recurrence after laparoscopic radiofrequency ablation of liver tumors:an analysis of 1032 tumors[J].Ann Surg Oncol,2008,15(10):2757.
[10]Paulet E,Aubé C,Pessaux P,et al.Factors limiting complete tumor ablation by radiofrequency ablation[J].Cardiovasc Intervent Radiol,2008,31(1):107.
[11]Ishiko T,Beppu T,Sugiyama S,et al.Radiofrequency ablation with handassisted laparoscopic surgery for the treatment of hepatocellular carcinoma in the caudate lobe[J].Surg Laparosc Endosc Percutan Tech,2008,18(3):272.
[12]De Raffele E,Mirarchi M,Bassi F,et al.Hepatocellular carcinoma with neoplastic thrombosis of the common hepatic duct[J].Chir Ital,2008,60(6):849.
[14]Hur H,Ko YT,Min BS,et al.Comparative study of resection and radiofrequency ablation in the treatment of solitary colorectal liver metastases[J].Am J Surg,2008,
[15]Ng KK,Poon RT,Lo CM,et al.Analysis of recurrence pattern and its influence on survival outcome after radiofrequency ablation of hepatocellular carcinoma[J].J Gastrointest Surg,2008,12(1):183.

