薯蓣皂苷元诱导人胃低分化粘液腺癌MGC-803细胞凋亡依赖caspase-3途径
何忠梅,张显涛,王铁成
(1.吉林农业大学,吉林长春 130118;2.修正药业集团长春高新制药有限公司;3.吉林天药科技有限公司)
薯蓣皂苷元(Diosgenin,Dio)是从我国特有的薯蓣科植物穿龙薯蓣Dioscorea nipponicaMakino中分离得到的一种植物甾体化合物,具有降血脂[1]、降血糖[2]、促进胆汁分泌[3]、抗血栓[4]、抗心肌缺血[5]、抗风湿[6]、抗炎[7]等作用,而它的抗肿瘤作用[8-10]更是引起了研究者的极大关注。Dio能够诱导人红白血病细胞和人白血病细胞分化和凋亡[11],诱导人骨肉瘤细胞凋亡和人黑色素瘤细胞凋亡[12],具有明显抑制移植胃低分化粘液腺癌(MGC-803)荷瘤裸鼠肿瘤生长的作用[13],Dio还能明显抑制MGC-803细胞的分裂和集落形成[14],能引起其形态改变并影响其DNA的合成[15],而关于Dio是否能诱导MGC-803细胞凋亡及其凋亡途径的研究,至今尚未见报道。本实验主要在离体条件下,探讨Dio对MGC-803细胞的促凋亡作用及caspase-3对凋亡的影响。
1 材料与方法
1.1 实验材料、仪器与试剂
MGC-803细胞株购自吉林省肿瘤医院。CK2TRC-3荧光倒置显微镜(OLYMPUS公司);D-63450-CO2培养箱(Hera公司);FCANF129004酶标仪(TECAN公司);流式细胞仪(BD公司);96孔培养板和培养瓶(NUNCTM);RPMI-1640培养基(Hyclone);新生牛血清(北京元亨圣马生物技术研究所);Annexin V-FITC和APO-BRDU细胞凋亡检测试剂盒、四唑蓝(MTT)、Ac-DEVD-CHO和 A-DEVD-AFC均为Sigma公司产品。Diosgenin亦为Sigma公司产品,用无水乙醇和二甲基亚砜配制成高浓度溶液备用,二者的终浓度均低于0.1%。
1.2 实验方法
1.2.1 细胞培养 按常规方法培养传代,取对数生长期细胞用于实验。
1.2.2 细胞生长抑制实验 以每孔1×104个细胞的密度接种于96孔板中,培养12 h后加入diosgenin浓度分别为 0,1.875,3.75,7.5,15,30,60 μ g◦ml-1,分别于0,24,48,72 h用MTT方法测定细胞死亡率。或者在加入 caspase-3抑制剂Ac-DEVD-CHO 60min后,再加入不同浓度的diosgenin。
1.2.3 Annexin V-FITC检测凋亡早期细胞 按照Annexin V-FITC细胞凋亡检测试剂盒说明书操作。
1.2.4 APO-BRDU检测凋亡晚期细胞 按照APOBRDU Kit说明书操作。
1.2.5 Caspase-3活力测定 将细胞接种到培养瓶中,培养12 h后加入diosgenin浓度分别为0,15,30 μ g◦ml-1,24 h 后收集细胞 ,加入 100 μ l裂解液重悬细胞,冰浴10 min。12 000 rpm,4℃,3 min沉淀细胞碎片。上清液转至另一新管中,加入100 μ l 2×反应buffer,加 入 A-DEVD-AFC 使其 终浓 度为 50 μ M,混匀,37℃,60 min水浴后转移至不透光96孔板中,酶标仪(Ex=400 nm,Em=505 nm)测定荧光。结果以给药组的荧光与对照组的荧光的比值表示即F(treatment)/F(control),简称 F(t)/F(c)。
2 结果
2.1 Dio对MGC-803细胞增殖的影响
Dio对MGC-803细胞增殖的抑制作用呈明显的时-效和量-效关系。随着Dio浓度的增加,作用时间的延长,其杀伤MGC-803细胞的能力也随之增强。经SPSS软件统计,用直线回归方程计算其作用24、48、72 h IC50值为 56.290、27.837、17.723 μ g◦ml-1。当 diosgenin 达到较高浓度(30、60 μ g◦ml-1)时,对MGC-803细胞的增殖抑制作用在48和72 h已十分接近,因此,48 h高浓度Dio已基本发挥较大效用。
2.2 Annexin V-FITC检测Dio处理后的凋亡早期细胞
细胞浆膜不对称性丧失导致磷脂酰丝氨酸(PS)外翻是细胞凋亡的早期过程,Annexin V可与PS特异性强烈结合,被用来检测细胞早期凋亡。Annexin V-FITC+/PI-双标检测可见,与阴性对照组比较,随着作用浓度的不断提高,Dio组凋亡细胞呈剂量依赖性增多,结果见表1。

表1 通过Annexin V-FITC检测Dio是否诱导MGC-803细胞发生早期凋亡
2.3 APO-BRDU检测Dio处理后的凋亡晚期细胞
核酸内切酶活化是凋亡晚期细胞的一个特征变化,活化的内切酶将DNA断裂成不连续的、不同倍数的180-200 bp的小核酸片段。这是目前判断细胞凋亡的一项重要生化指标,这种凋亡细胞的DNA断裂碎片,可以通过APO-BRDU试验进行检测。实验结果显示,随Dio剂量增大,DNA断裂碎片增多,凋亡细胞逐渐增多,当Dio浓度达到60 μ g/ml时,凋亡细胞百分数已由阴性对照组的1.48%增至30.08%,见表2 。
2.4 Dio对MGC-803细胞中caspase-3活性的影响
Caspase-3被认为是凋亡的执行者,在肿瘤细胞凋亡中起着十分重要的作用。结果显示,15、30 μ g/ml Dio作用MGC-803细胞24 h后,MGC-803细胞中caspase-3活性显著增加(见图1)。随Dio作用浓度的增大,caspase-3活性也随之增强。

表2 通过APO-BRDU检测Dio是否诱导MGC-803细胞发生晚期凋亡
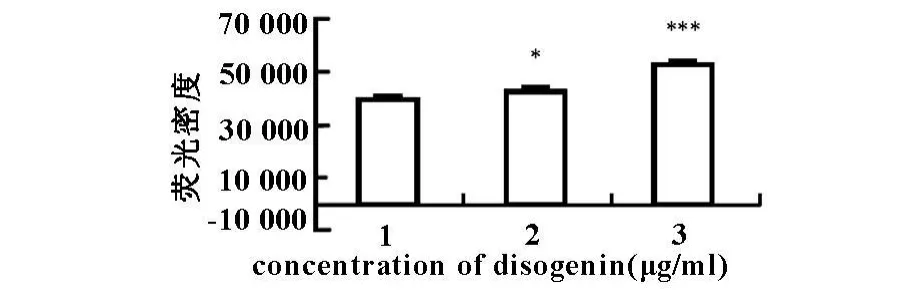
图1 Dio对MGC-803细胞中 caspase-3活性的影响
2.5 Caspase-3特异性抑制剂DEVD-CHO对Dio诱导MGC-803细胞死亡的影响
15 μ g/mL Dio 作用MGC-803 细胞 24 h,对细胞的生长抑制率为46.91%,而先用DEVD-CHO预处理细胞1 h后再用Dio作用细胞,其对细胞生长的抑制率已降为18.79%(见表3)。实验结果提示,caspase-3抑制剂DEVD-CHO能阻断Dio诱导MGC-803细胞死亡。

表3 DEVD-CHO对Dio抑制MGC-803细胞生长的影响
3 讨论
从天然产物中寻找活性成分,已经成为当今抗肿瘤药物发展战略之一。Dio是从天然中草药薯蓣科植物中提取的抗肿瘤活性成分。在对Dio进行抗MGC-803细胞作用机制的研究中,我们用AnnexinVFITC试剂盒检测到了凋亡细胞早期的变化即细胞浆膜不对称性丧失导致磷脂酰丝氨酸(PS)外翻,在APO-BRDU分析中,检测到凋亡细胞断裂的DNA碎片,证实了Dio诱导人胃低分化粘液腺癌MGC-803细胞凋亡。
药物诱导细胞凋亡的分子机理十分复杂,许多基因的变化参与此过程,但经典途径是caspases途径。为进一步探讨Dio诱导凋亡的机制,我们主要考察了caspase-3在此过程中的作用。实验结果表明,Dio能激活MGC-803细胞中的caspase-3,增强caspase-3活力,caspase-3特异性抑制剂DEVD-CHO能阻断Dio诱导MGC-803细胞死亡的作用,证实Dio诱导MGC-803细胞凋亡依赖于caspase-3途径。
霍锐等人报道Dio未导致人黑色素瘤细胞A375-S2中caspase-3活力升高[14],而我们的实验证明Dio能激活MGC-803细胞中的caspase-3,增强caspase-3活力,说明Dio通过不同途径诱导不同肿瘤细胞发生凋亡。
虽然我们的实验证明Dio诱导MGC-803细胞凋亡依赖于caspase-3的激活,但如何激活caspase-3还不清楚。caspase-3主要位于整个信号传导的下游,caspase-8和caspase-9均位于其上游,Dio诱导MGC-803细胞凋亡具体是通过caspase-8介导的死亡受体途径还是caspase-9介导的线粒体途径,还有待于进一步探讨。
[1]Son I S,Kim J H,SohnHY,et al.Antioxidative and hypolipidemic effects of diosgenin,a steroidal saponin of yam(dioscorea spp.)on high-cholesterol fed rats[J].Biosci Biotechnol Biochem,2007,71(12):3063.
[2]McAnuff M A,Omoruyi F O,Morrison E S,et al.Changes in some liver enzymes in streptozotocin-induced diabetic rats fed sapogenin extract from bitter yam(Dioscorea polygonoides)or commercial diosgenin[J].West Indian Medical Journal,2005,54(2):97.
[3]Nibbering CP,Groen AK,Ottenhoff R,et al.Regulation of biliary cholesterol secretion is independent of hepatocyte diosgenin-fed rat model[J].J Hepatol,2001,35(2):164.
[4]宁可永,李贻奎,高会丽,等.薯蓣皂苷元对大鼠体内外血栓形成及血液黏度的影响[J].中药新药与临床药理,2008,19(1):3.
[5]宁可永,李贻奎,高会丽,等.薯蓣皂苷元对大鼠急性心肌缺血的治疗作用[J].中药新药与临床药理,2008,19(1):1.
[6]Liagre B,LegerDY,Beneytout JL.Diosgenin,a proapoptotic molecule,increases COX-2 expression by stimulating the activation o1f p38 MAP kinase in human rheumatoid synovial cells[J].Prostaglandins&Other Lipid Mediators,2006,79(1-2):177.
[7]Huang CH,Ku CY,Jan TR.Diosgenin attenuates allergen-induced intestinal inflammation and IgE production in a murine model of food allergy[J].Planta Med,2009,75(12):1300.
[8]Shabbeer S,Sobolewski M,Anchoori R K,et al.Fenugreek a naturally occurring edible spice as an anticancer agent[J].Cancer Biology&Therapy,2009,8(3):268.
[9]Raju J,Mehta R.Cancer chemopreventive and therapeutic effects of diosgenin,a food saponin[J].Nutrition and Cancer-an International Journal,2009,61(1):27.
[10]江洋珍,王俊俊,梁继超,等.薯蓣皂苷元对大鼠成骨细胞增殖、分化及OPG/RANKL mRNA表达的影响[J].中华中医药杂志,2010,25(1):134.
[11]李晶华,历艳志,张沐新,等.薯蓣皂苷元对HL-60细胞增殖及细胞周期的影响[J].吉林农业大学学报,2003,25(5):533.
[12]霍 锐,周秋丽,王本祥,等.薯蓣苷元诱导人黑素瘤细胞A375-S2凋亡依赖半胱天冬酶和MAPK途径[J].中国药理学与毒理学杂志,2003,17(4):270.
[13]陈声武,王岩,孙长江,等.薯蓣皂苷元对移植人低分化胃腺癌荷瘤裸鼠肿瘤重量的影响[J].吉林大学学报(医学版),2003,29(2):145.
[14]李晶华,李春爱,霍锐,等.薯蓣皂苷元对人低分化胃腺癌细胞株生长的抑制作用[J].吉林大学学报(医学版),2004,30(2):198.
[15]宋宇,梁长青,何忠梅,等.薯蓣皂苷元体外抗肿瘤作用的研究[J].中国肿瘤,2004,13(10):651.

