利用稻草液体发酵产纤维素酶及酶粉提取的研究*
谭 宏,刘选明,盛培科,廖胜辉,黄小峰,何 迪
(湖南大学 生物学院,湖南 长沙 410082)
纤维素酶是降解纤维素生成葡萄糖的一组酶的总称[1-2].纤维素在地球上的有机质中分布最广,含量最丰富.湖南省的纤维素资源十分丰富,每年仅稻草就多达数千万吨.因此,纤维素的开发利用与转化对于解决工农业原料来源、世界能源危机、环境污染等问题具有重要意义.纤维素酶已广泛应用于饲料、医药、食品加工、生物能源、油井开采、细胞生物工程和工业洗涤剂等行业.
纤维素酶的工业化生产目前主要有固体发酵法和液体深层发酵法2种[3-4].固体法工艺简单,易污染,难控制.液体深层发酵技术水平先进,难度大,仅有美国、日本等几个国家掌握并用于生产,特点是发酵原料利用率高,生产条件易控制,是当今世界纤维素酶生产的主攻方向.纤维素酶的提取方法有盐析法、有机溶剂沉淀法等[5].盐析法的根据是蛋白质在稀盐溶液中,随盐浓度增高到一定数值时,蛋白质表面电荷被中和,引起蛋白质分子间互相凝聚并从溶液中析出[6].有机溶剂沉淀法是用与水可混溶的有机溶剂,如乙醇等,使蛋白质溶解度降低并析出,但此法易使蛋白质变性,应在低温下进行[7].本研究综合各方面因素拟用盐析法提取纤维素酶.生产纤维素酶的菌种有很多,如细菌、真菌等,唯以真菌所产纤维素酶组份最齐全,且是胞外酶,故是工业生产的首选菌种[8].本课题选用的 HC-415菌株,属真菌中的里氏木霉,可利用稻草分泌高活性的纤维素酶;同时,还可产生许多半纤维素酶、果胶酶、淀粉酶和蛋白酶等.
1 材料、仪器与试剂
菌种:里 氏 木 霉 (Trichodermareesei)HC-415,湖南大学生物学院提供.材料与试剂:稻草粉,豆粕,麸皮,羧甲基纤维素钠,新华1号滤纸等.仪器设备:30L规模发酵罐,旋转式摇床,高速冷冻离心机等.
2 培养基
斜面种培养基:PDA培养基.一级种培养基(%,w/v):麸皮2,葡萄糖3,(NH4)2SO40.15,pH 5.5~6.0.二级产酶培养基(%,w/v):稻草粉5,豆粕粉1,KH2PO41.0,CaCl20.6,聚 醚0.6,pH 5.5~6.0.一级种接种量为15%(v/v).
3 实验方法
3.1 纤维素酶液体深层发酵法
将HC-415菌斜面种的孢子液接入一级种培养基,28~30℃旋转式摇床上培养40h,再接入30L规模罐二级产酶培养基中进行液体深层产酶发酵试验.
3.2 酶活性测定方法
羧甲基纤维素(CMC)酶活性测定:DNS法.
滤纸糖酶(FPA)活性测定:参照 Mandels[9]、蒋传葵[10]DNS法.1mL适当稀释的酶液中加入1 mL 0.05mol/L (pH4.6)缓冲液和1条1cm×6 cm新华1号滤纸.50℃酶解60min,加3mL DNS试剂.沸水浴10min,测还原糖,扣除空白后计算酶活性.
酶液酶活性单位规定为:1h水解生成1mg葡萄糖的酶量为1个活性单位(U).酶粉酶活性使用国际单位(IU):1min水解生成1μmol葡萄糖的酶量为1个国际单位(IU).
3.3 纤维素酶的提取
酶粗提取液的制备:放罐收集的发酵液,离心除去稻草等固型物,上清液即为酶粗提取液,粗酶液应立即进行后续处理,否则,应放入4℃冰箱保存.
硫酸铵盐析:在酶粗提取液中缓慢加入20%饱和度硫酸铵[11],静置2h,4℃离心20min,除去杂蛋白,取上清液缓慢加入80%饱和度硫酸铵,溶解后6 500r/min 4℃离心20min,沉淀用pH 5.0醋酸盐缓冲液溶解,得纤维素酶浓缩液,于4℃冰箱保存.
浓缩液透析:向透析袋中加入浓缩液,预留约1/3的空间.在50%甘油的pH4.6的0.1mol/L醋酸-醋酸钠缓冲液中透析4h.
纤维素酶粉的制取:将纤维素酶浓缩液放入冷冻干燥机中进行冷冻干燥,冷阱温度为-50℃,真空度14~16Pa,冷冻24h制得纤维素酶粉.
4 结果与讨论
4.1 30L规模罐中HC-415菌产纤维素酶发酵过程动态变化
30L规模发酵罐装液量20L,搅拌速度为200~450r/min,通气量0.25~0.6L/(min·L),发酵温度30±1℃,罐压0.01~0.03MPa,培养144h.消泡剂聚醚添加量为0.6%.发酵过程中,间隔2h测定并记录pH、通气量、温度、搅拌速度、泡沫等的变化;每隔12h取样检测酶活性,结果表明,如图1,24h前CMC酶和FPA酶活性很低,基本处于停滞期.之后酶活性快速增长,CMC酶和FPA酶活性在120h达到高峰,120~132h酶活性处于高峰稳定期,综合各因素,最适发酵周期为132h.
4.2 纤维素酶提取时酶的活性及酶活性得率
30L规模罐发酵液纤维素酶提取及酶活性得率结果见表1.冻干酶粉CMC酶活性平均为355.0 IU/g,最高为388.3IU/g,FPA平均为44.3IU/g,最高为58.2IU/g.相对发酵液得率平均为16.00 g/L.酶粉对发酵液CMC酶活性平均得率为77.16%,最高为89.14%,FPA酶活性平均得率为58.10%,最高为82.95%.

图1 30L规模罐中HC-415菌产纤维素酶液体发酵动态曲线图Fig.1 The graph of cellulase liquid fermentation by HC-415fungus in 30Lfermenter
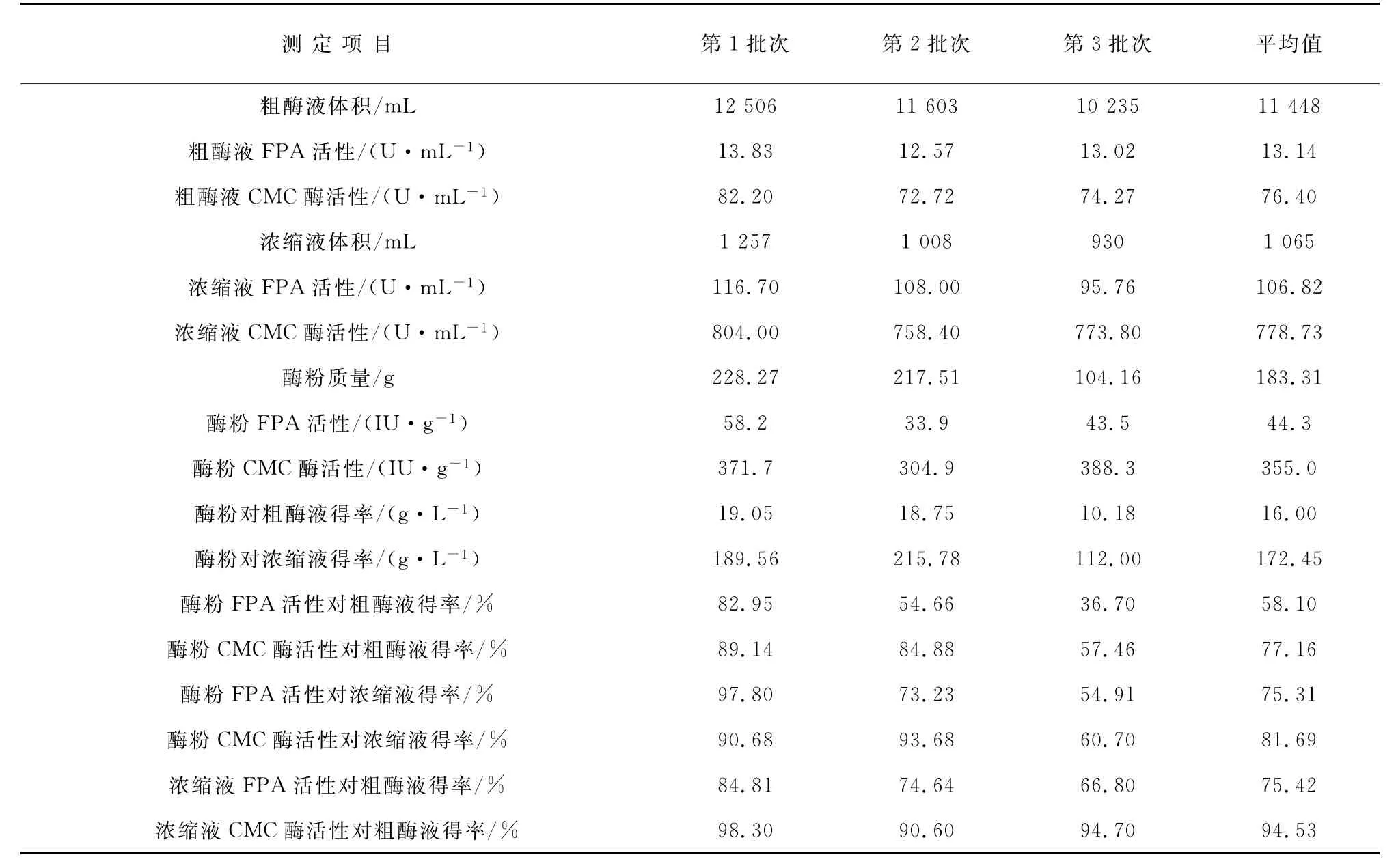
表1 30L规模罐发酵液纤维素酶活性及酶活性得率Tab.1 Cellulase activity and yield from 30Lfermenter broth
4.3 透析对纤维素酶活性得率的影响
将第3批次的纤维素酶浓缩液进行透析,如表2,透析后体积缩小了35.0%,CMC酶活性得率为96.0%,FPA酶活性得率为95.5%.表明通过透析起到了浓缩的作用,而酶活性损失很少.透析后的浓缩液制得的酶粉活性为:CMC酶634.9IU/g,FPA84.7IU/g,表明透析还起到了脱盐纯化作用.
4.4 HC-415菌所产纤维素酶的最适pH
配制pH为3.0~9.0的磷酸氢二钠和柠檬酸缓冲液,将HC-415菌所产纤维素酶液稀释到适当倍数,测定各pH 值的FPA酶活性(图2),表明HC-415菌所产纤维素酶的最适pH值在4.0~5.0之间.
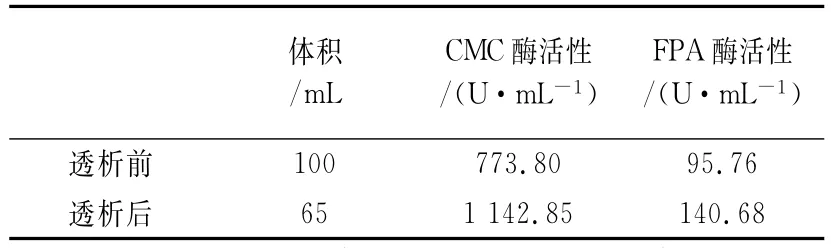
表2 透析对纤维素酶活性的影响Tab.2 The effect of dialysis for cellulase activity
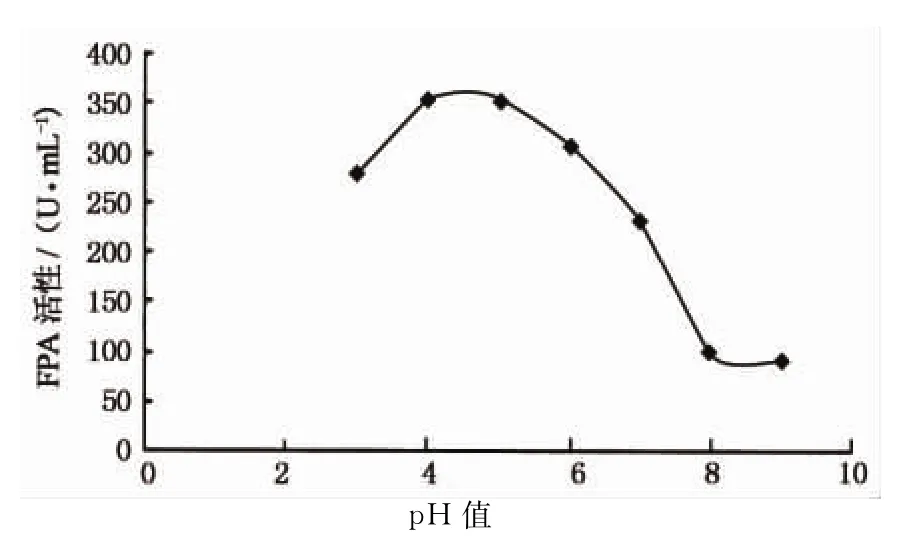
图2 不同pH下的HC-415菌FPA酶活性变化趋势Fig.2 FPA variation tendency in different pH buffer solution
4.5 HC-415菌所产纤维素酶的最适反应温度
将HC-415菌所产纤维素酶液稀释到适当倍数,在30~70℃的水浴锅中测定该菌FPA活性(图3),表明其最适反应温度在50~60℃之间.
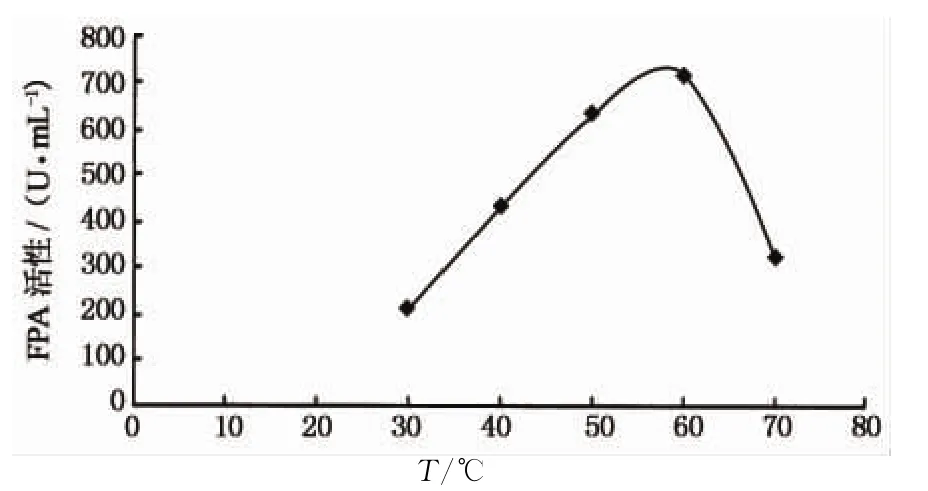
图3 不同反应温度下的HC-415菌FPA酶活性变化趋势Fig.3 FPA variation tendency in different reaction temperature buffer solution
4.6 HC-415菌纤维素酶粉性质比较
几种纤维素酶粉有关特性及酶活性测定结果见表3.溶解性方面,HC-415与 ONOZUKA R-10酶粉均易容于稀醋酸盐缓冲液,溶液淡黄透明.上海酒精二厂的纤维素酶粉仅溶解一部分,呈棕色混浊状.HC-415与 ONOZUKA R-10酶粉均呈砂色.HC-415菌纤维素酶粉比上海酶粉FPA酶活性高29.9 IU/g.所以,在溶解性、色泽及FPA活性等方面,HC-415菌所产纤维素酶粉已接近或达到国内、国外商品酶酶粉指标.

表3 不同纤维素酶粉性质及活性比较Tab.3 Qualities and activity for several different cellulase powders
[1] WOOD T M.Cellulase of trichoderma koningii[J].Methods in Enzymology,1988,160(24):221-223.
[2] WOOD W A,KELLOGG S T.Cellulose and hemicellulose[M].USA:Academic Press Inc,1988.
[3] 谭宏,谢小保,莫勇,等.里氏木霉液体发酵产纤维素酶的研究[J].工业微生物,1996,26(1):7-11.TAN Hong,XIE Xiao-bao,MO Yong,etal.Production of cellulase using submerged fermentation byTrichodermareeseiHC-415[J].Industrial Microbiology,1996,26(1):7-11.(In Chinese)
[4] 张树政.酶学研究技术(上册)[M].北京:科学出版社,1987.ZHANG Shu-zheng.Enzymology research technology(rudin)[M].Beijing:Science Press,1987.(In Chinese)
[5] 曹军卫.微生物工程[M].北京:科学出版社,2002.CAO Jun-wei.Microbiology engineering[M].Beijing:Science Press,2002.(In Chinese)
[6] 高培基,曲音波,王祖农.绿色木霉的内切葡聚糖酶在纤维素水解中作用机制的研究 [J].自然科学进展,1992,21(3):253-259.GAO Pei-ji,QU Yin-bo,WANG Zu-nong.The study on cellulose hydrolysis mechanism forTrichodermareeseiendoglucanase[J].Progress in Natural Science,1992,21(3):253-259.(In Chinese)
[7] 崔福绵,刘菡,韩辉.康宁木霉CP88329纤维素酶产生条件的研究[J].微生物学通报,1995,22(2):72-76.CUI Fu-mian,LIU Han,HAN Hui.Studies on the conditions for cellulase production fromTrichodermakoningiiCP88329[J].Microbiology,1995,22(2):72-76.(In Chinese)
[8] 叶姜瑜.一种纤维素分解菌鉴别培养基[J].微生物学通报,1997,24(4):251-252.YE Jiang-yu.A new differential medium for cellulose decomposing microorganisms[J].Microbiology,1997,24(4):251-252.(In Chinese)
[9] MANDELS M.Cellulose as a chemical and energy resource[J].Biotechnol Bioeng,1975(5):81-85.
[10] 蒋传葵.工具酶的活力测定[M].上海:上海科学技术出版社,1982:79-81.JIANG Chuan-kui.The activity determinations on tool enzymes[M].Shanghai:Shanghai Scientific and Technical Publishers,1982:79-81.(In Chinese)
[11] 谭宏,刘淑欢,李剑英,等.长梗木霉纤维素酶的产生及提取[J].微生物学通报,1993,20(2):90-93.TAN Hong,LIU Shu-huan,LI Jian-ying,etal.Studies on the cellulase production and extraction fromTrichoderma Longibrachiatum[J].Microbiology,1993,20(2):90-93.(In Chinese)

