一株酒精酵母的分离及其发酵性能分析
双 宝,李 明,李 慧,矫洪涛,李海涛,王 晴,向文胜,高继国
(1.东北农业大学生命科学学院,哈尔滨 150030;2.东北农业大学司法鉴定中心,哈尔滨 150030)
随着科技的不断发展,人们对燃料型能源的需求日益加大。这使得石油及煤炭等资源的价格持续上升。然而这些资源不仅污染环境,而且这些资源都是不可再生资源。为此,许多国家都开始将目光转向再生清洁的能源。以生物合成的酒精作为一些燃料能源的代替品或部分代替品可以缓解上述问题。
国内许多学者都对酒精发酵这一领域进行了大量的研究。韦珂等进行了玉米免蒸煮生料的酒精发酵,并对影响其发酵的主要因素进行了正交试验研究[2]。他们发现,发酵剂添加量占原料0.7%,料水比1∶4,起始 pH 5.5,35℃条件下发酵 4~5 d,发酵效果较好。卢晓霆[3]等人用10 L发酵罐为玉米生料进行发酵,通过正交试验得到最佳条件为:酵母0.2%,糖化酶250 U·g-1,纤维化酶0.1%,料水比1∶2.5,搅拌为 140 r·min-1,发酵温度 29 ℃,发酵时间为 85~95 h。
本研究分离了一株酒精发酵酵母,并对其进行了发酵性能分析,为酒精的大量生产奠定了基础。
1 材料与方法
1.1 原料
生玉米粉。
1.2 酒糟
生产废弃酒糟。
1.3 主要试剂
麦芽浸粉(北京奥特星生物技术责任有限公司);α-淀粉酶:酶活力4 000 U·g-1,(北京奥特星生物技术责任有限公司);糖化酶:酶活力100 000 U·g-1(北京奥特星生物技术责任有限公司),酵母粉、蛋白胨(进口);琼脂 (Agar Powder)Genebase Gene-Tech co.Ltd;葡萄糖 (天津市特迪化工有限公司);其余化学试剂均为分析纯。
1.4 主要仪器和设备
超净工作台 (苏净集团安泰公司制造),PHS-3TC型酸度计 (上海天达仪器有限公司),721型分光光度计(上海第三分仪器有限公司),HWS24型电热恒温水浴锅 (上海益恒实验仪器有限公司制造),DNP-9162型电热恒温培养箱 (宁波江南仪器厂),HZQ-R振荡器 (哈尔滨东联电子技术开发有限公司),高压蒸汽灭菌锅(长春百奥生物仪器有限公司)等。
1.5 菌种的分离
1.5.1 配制YEPD培养基
2%葡萄糖,1%酵母膏,2%蛋白胨,121℃条件灭菌20 min。
1.5.2 分离方法
将少量酒糟接种于含氨苄青霉素(Amp)的盛有3 ml YEPD培养基的试管中,30℃摇床培养12 h。将试管菌液稀释106倍,用涂布棒涂YEPD板(含Amp),30℃过夜培养,待长出菌落后,挑取具有典型酵母菌特征的单菌落进行石炭酸碱性复红染色[1]镜检,将符合酵母细胞形态的菌落,接种于试管培养基中摇床培养,当菌体达一定密度后,转接入盛有100 ml YEPD培养基的三角瓶中摇床培养,用于后面试验。
1.6 种子培养基的浓度梯度筛选
1.6.1 麦芽汁培养基的配制
配制0、0.5%、1%、2%、4%浓度梯度的麦芽汁培养基各100 mL于500 mL三角瓶,pH 6.4,121℃条件灭菌20 min。
1.6.2 接种
将少量三角瓶培养基中的酵母菌分别接种于以上浓度麦芽汁培养基中30℃恒温摇床培养,每隔1 h测1次OD600值(600 nm下光吸收度),记录菌体的生长情况,筛选出最适合酵母菌生长浓度的麦芽汁培养基,用于发酵种子培养基。
1.7 1 L三角瓶发酵接种量的梯度筛选
1.7.1 接种量梯度
在1 L三角瓶中,按料水比为1∶2,60℃温水调浆,加0.1%的α-淀粉酶,70℃水浴50 min,迅速冷却至60℃,调pH至4.5~5,加100 U·g-1的糖化酶,冷却至30℃,接种量按0、10%、13%、16%和20%的梯度接种,密封,30℃静止发酵72 h,定时测定发酵液中酒精度、残余总糖、蛋白质含量等指标。
1.7.2 发酵液中总糖测定
发酵液中总糖的水解和提取:取15 mL发酵液,放入100 mL三角瓶中,加10 mL 1 mol·L-1HCl,沸水浴加热30 min。冷却后,用6 mol·L-1NaOH中和水解液至中性,过滤,定容获得总糖提取液。用斐林法测定总糖含量[1]。
1.7.3 发酵液中蛋白质测定
发酵液样品做四种方式处理:①发酵液静止沉淀,取上清液测定;②发酵液用滤布过滤,取滤液测定;③发酵液离心(4 000 r·min-1,20 min),取上清液测定;④发酵液经滤纸过滤后测定。蛋白质含量测定采用考马斯亮蓝G-250法[1]。
1.7.4 发酵液中酒精含量测定
发酵液样品处理同上。用比色法测定[1]。
1.8 发酵罐扩大性试验
在发酵罐中前述试验的最佳接种量、最佳糖化酶及淀粉酶的加入量,静止发酵72 h,并定时测定各项指标,方法同上。
2 结果与分析
2.1 菌株的菌落形态及细胞形态
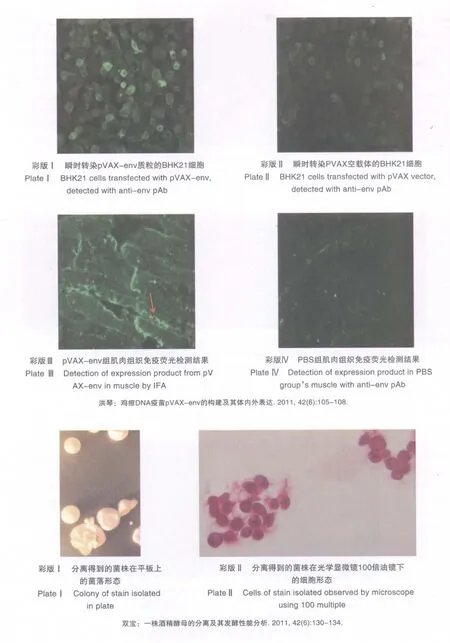
将分离得到的菌株挑单菌落接种于含有100 μg·mL-1Amp的YEPD液体培养基中,30℃ 220 r·min-1摇床培养过夜的菌悬液稀释106倍后涂含有100 μg·mL-1Amp的YEPD平板,得到的菌落形态如彩版Ⅰ所示,菌落呈乳白色、圆形,表面光滑,中间湿润呈乳头状。经过光学显微镜100倍油镜观察,菌体细胞成卵圆形,有些区域菌体以链状分布(见彩版Ⅱ)。
2.2 不同浓度麦芽汁培养基对酵母菌生长的影响
由图1可看出,酵母菌在麦芽汁2%和4%浓度的培养基中长势好。由于在麦芽汁2%和4%的培养基中的长势接近,从成本考虑,最终选用麦芽汁2%浓度的培养基作为酵母菌发酵的种子培养基,酵母菌大约培养15 h达到对数生长期。
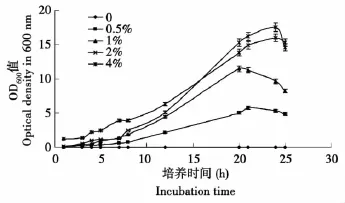
图1 不同浓度麦芽汁培养基酵母菌生长趋势曲线Fig.1 Growth curves of yeast in different consistency culture medium of wort
2.3 接种量对酵母菌发酵的影响
由图2可知,20%的接种量,发酵12 h时的酒精度达到2.86%,最终酒精度达4.71%,整个发酵过程的酒精度明显高于其他接种量。主发酵期为48 h,之后由于糖化酶的后糖化作用,发酵液中的酒精度仍有部分增加,发酵于72 h基本终止。
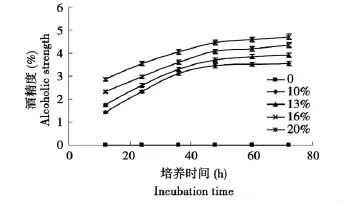
图2 不同接种量下酒精度变化曲线Fig.2 Variation curve of alcohol with different inoculation number
由图3可知,发酵48 h内总糖含量明显下降,20%的接种量,最终发酵液中残余总糖含量为9.45 mg·mL-1,明显低于其他接种量时的最终残余总糖含量。接种量越高最终残余总糖含量越低,这可能与最终菌体浓度大有关。因为,接种量大,菌体增殖速度加快,代谢旺盛,所以糖的消耗速度也会加快。
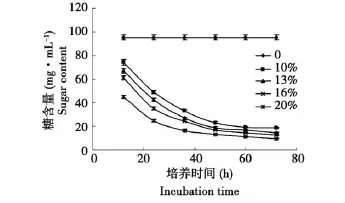
图3 不同接种量下发酵残余总糖含量变化曲线Fig.3 Variation curve of saccharide with different inoculation number
由图4可知,在整个发酵过程中粗蛋白含量相对稳定,略有增加,20%的接种量,蛋白含量最大。
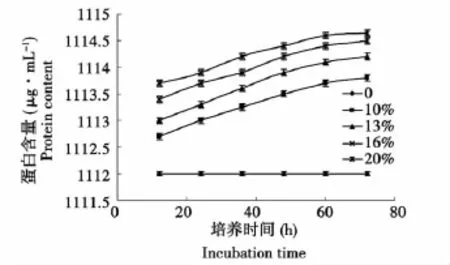
图4 不同接种量下蛋白含量变化曲线Fig.4 Variation curve of protein with different inoculation number
综上所述,接种量为20%时,发酵产生的酒精含量、总糖的利用率及总蛋白的产生都优于其他接种量,故本试验以后步骤选用20%的接种量进行。
2.4 扩大培养结果
在100 L发酵罐中按前面步骤得出的最佳接种量加入,料液总体积30 L左右,其余条件不变,按步骤活化菌种、调浆、接种,静止发酵162 h,定时测定各项指标,结果如表1所示,总糖含量不断下降,粗蛋白含量基本不变,说明该酵母利用蛋白并不明显,酒精度则不断提高,而酸度则是先下降再上升。放大到30 L体积发酵,无论从培养基组成还是培养工艺方面都发生了很大的变化,整个酒精发酵过程还受糖化剂反应速度的影响,发酵周期延长,最终酒精含量明显提高。
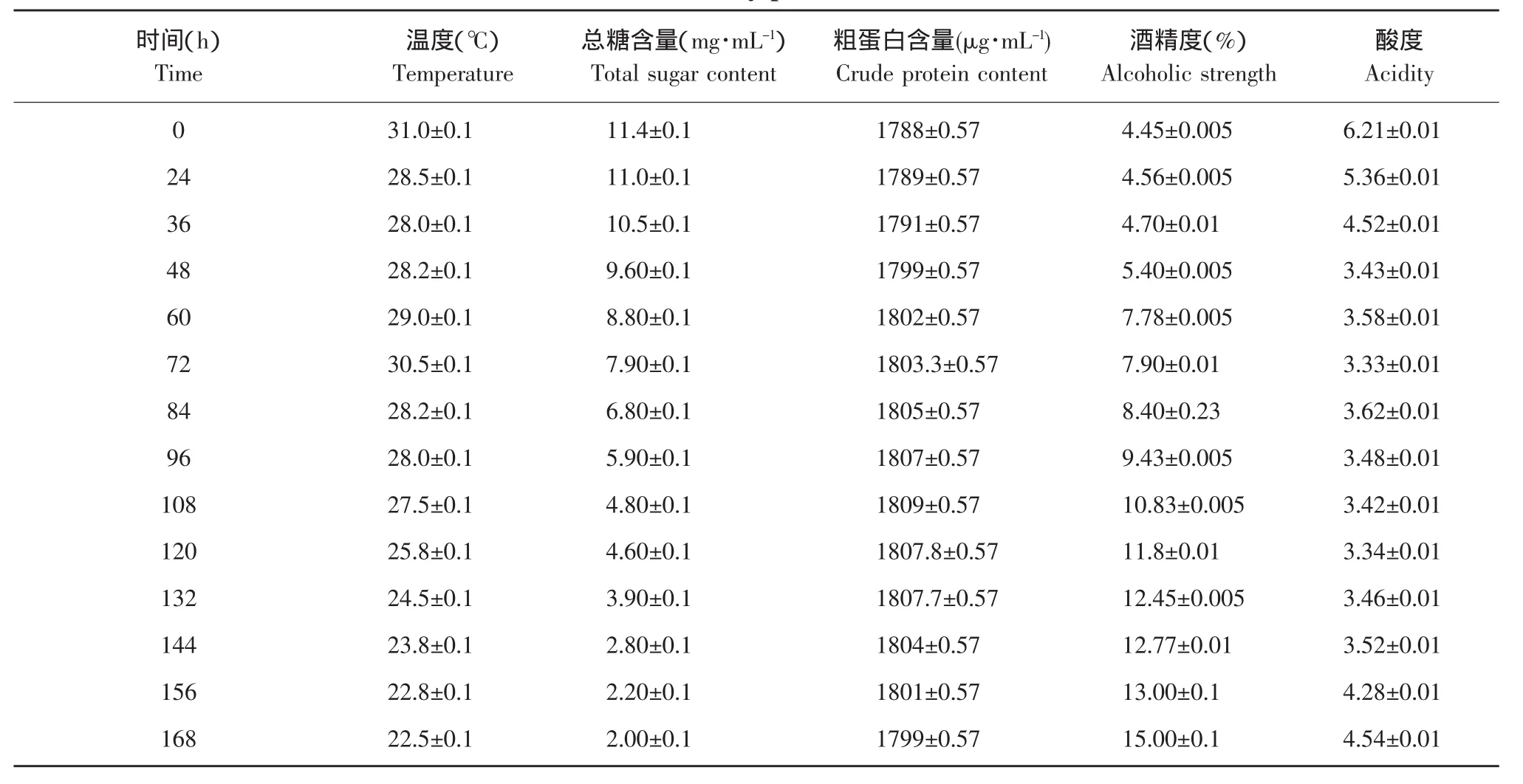
表1 一个发酵周期各项参数的变化Table 1 Variation of every parameter in fermentation
3 讨论
目前在国内,许多学者对酒精发酵的研究主要集中在培养基的筛选、培养条件的优化及抗性酵母的筛选和研究。
酒精发酵常用的培养基有玉米粉[2-5]和大米[6],也有以糖蜜、甘蔗、木薯和大麦为原料的[7-8]。本研究采用的大麦汁与前人采用的大麦原料相比更便于酵母的吸收和利用。但由于成本较高,所以仅限于实验室研究。对于生产而言,我们将进一步优化培养基。
对培养条件的优化,主要以正交试验为主,如张春野[10],叶向库[11],武贤峰利用此法最终得到了较优的工艺条件[12]。段学辉等研究了分批培养、分批补料及连续流加培养对酒精酵母细胞生长的影响[9]。本试验用的是单因子优化法,该优化方法每次都可以优化一个因子,所以设计起来比较简单,无先后顺序,对数学知识要求较少[13],当然也存在一定缺陷,那就是对于各因子之间的交互作用没有体现。
对抗逆性强的酵母的筛选和研究也有较多报道,如易弋等从酒精厂废液、糖厂废糖蜜、土壤及淤泥等七种不同样品中筛选得到了酒精耐受性较好的酵母菌株[14];宋瑶等则筛选获得1株能在33~42℃生长良好的抗高温酵母菌株[15];李荣杰研究了超高浓度酒精发酵条件下酵母菌生理代谢的变化[16]。本文采用Amp初筛酵母菌,是因为Amp主要对细菌有抑制作用。而酵母为真菌,对Amp不敏感。而且,由于分离菌株所用的材料为酒糟,这就使得筛选出酒精高耐受菌的可能性大大提高。
在国外,不少研究者,在研究酒精发酵的同时,还进行了酵母核酸方面的研究[17-19]。所以,下一步我们将通过16 SRNA对该菌进行分子生物学鉴定,并进行深入研究,为其开发应用提供科学依据。
4 结论
本文通过抗生素与稀释涂平板联用的方法从酒糟中分离出来一株酒精酵母菌株,通过单因子优化法发现,当麦芽汁为2%,接种量为20%时,该酒精酵母的发酵性能最好,为酒精发酵的进一步研究奠定了基础。
[1] 王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:2-4.
[2] 韦珂,黎金锋,覃晓霞,等.玉米淀粉质原料生料酒精发酵的研究[J].广西农业生物科学,2007,26(3):253-255.
[3] 卢晓霆,张太日,闫俊,等.玉米生料发酵生产燃料乙醇工艺研究[J].中国酿造,2009(7):128-134.
[4] 刘振,冯书晓.玉米生料发酵制乙醇 [J].酿酒,2008,35(2):42-44.
[5] 张瑞斌,刘磊,杨永录,等.玉米淀粉制备燃料酒精的工艺优化[J].应用化工,2008,37(1):109-111.
[6] 段钢,许宏贤.大米生料发酵酒精生产的研究[J].食品与生物技术学报,2008,27(1):95-102.
[7] 周尚,岳春,杜风光,等.甘蔗酒精生产试验 [J].中国酿造,2008,18:55-58.
[8] 曹喜焕,奚菊芬,陈霞,等.不同原料对酵母生长及发酵酒精结果的影响[J].食品与发酵科,2009,45(5):6-8.
[9] 段学辉,牛春铃,欧阳军梅.酒精酵母Saccharomyces cerevisiae 4-S的高密度培养及其酒精发酵性能[J].南昌大学学报,2008,30(4):311-315.
[10] 张春野,申德超.挤压加酶脱胚玉米生产酒精的试验研究[J].东北农业大学学报,2009,40(6):106-108.
[11] 叶向库,申德超.酵母在挤压膨化的酒精原料中生长变化的基础研究[J].东北农业大学学报,2002,33(3):209-212.
[12] 武贤峰,孙波,迟玉杰,等.耐高温活性干酵母在甜高梁茎汁发酵生产酒精中的应用[J].东北农业大学学报,2008,39(11):101-105.
[13] 曲音波.微生物技术开发原理 [M].北京:化学工业出版社,2005:98.
[14] 易弋,伍时华.酒精耐受性酵母茵的筛选[J].广西工学院学报,2008,19(3):42-46.
[15] 宋瑶,缪礼鸿,高素芹,等.耐高温酒精酵母菌株的筛选及发酵能力比较[J].中国酿造,2009,5:38-41.
[16] 李荣杰.超高浓度酒精发酵条件下酵母茵生理代谢的变化[J].农技服务,2009,26(9):122-123.
[17] Oliveira V A,Vicente M A,Fietto L G,et al.Biochemical and molecular characterization of Saccharomyces cerevisiae strains obtained from sugar-cane juice fermentations and their impact in cachac production[J].Applied and Environmental Microbiology,2008,74(3):693-701.
[18] Saerens S M G,Delvaux F,Verstrepen K J,et al.Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation[J].Applied and Environmental Microbiology,2008,74(2):454-461.
[19] Blieck L,ToyeG,Dumortier F O,et al.Isolation and characterization of Brewer's yeast variants with improved fermentation performance under high-gravity conditions [J].Applied and Environmental Microbiology,2007,73(3):815-824.

