一株产纤维素酶丝状真菌兼性厌氧液体发酵动力学的研究
贾翠英,欧行奇,王永辉
(1.河南科技学院生命科技学院,河南 新乡 453003;2.江南大学生物工程学院,江苏 无锡 214122)
纤维素是世界上最大的可再生有机资源,我国的纤维类资源极为丰富,仅秸秆和皮壳每年可达7×108t。目前对其主要的利用方式是作为低级燃料,腐化为肥和家畜过腹还田,因此,有效利用率低。
当前,许多国家已展开对纤维素利用的深入研究,主要集中在两个方面:首先酶的基础研究,即纤维素酶如何使一束纤维从不可溶的聚合物上脱离下来,催化的化学机制以及纤维素酶如何相互作用以实现协同效应;其次是酶在实现生物量转化过程中的应用,即利用纤维素酶转化可再生性的能源物质生产化工原料等[1]。然而,由于纤维素酶活力低,一直是阻碍大规模生产应用的瓶颈,加强纤维素酶产生菌菌种选育、发酵工艺及降解机制的基础研究,利用高效转化木质纤维素类的微生物技术,将天然纤维素降解为可利用的糖液,再进一步转化为乙醇、乳酸、菌体蛋白、气体燃料等物质,对解决能源危机和环境污染以及生态保护是可行的,同时也是必要的[2-5]。纤维素酶对纤维素的降解作用主要通过纤维素外切酶(1,4-β-D-glucan-cellbiohydrolases,EC 3.2.1.91,CBH)、内切酶(1,4-β-D-glucan-4-glucanases,3.2.1.4,EG)和纤维二糖酶(β-D-cellobiase,EC 3.2.1.21)三类酶的协同作用[6-8],不同来源的菌株其纤维素酶的分子特征和催化性质都不尽相同,且酶的最适反应条件也有所不同[9-12]。微生物反应动力学包括细胞生长动力学、代谢产物生成动力学和基质消耗动力学[13],通过对微生物反应动力学的研究和模型的建立,能更好的认识微生物发酵过程中菌体的生长和产物形成机制,以及影响这些机制的一些重要因素,最终实现发酵过程的有效控制,达到提高产物发酵指标的目的。
本文以本实验室从羊瘤胃中筛选分离保存的一株丝状真菌为研究对象,通过静置液体发酵试验,对该丝状真菌体外转化玉米秸秆产纤维素酶的发酵动力学进行了研究,并对动力学方程进行了模拟验证,获得较理想的结果,从而为进一步研究和利用其所产纤维素酶降解玉米秸秆纤维素提供必要的理论依据,同时对于环境保护、资源能源再利用等领域具有极大地实际应用价值。
1 材料与方法
1.1 供试菌株
一株产纤维素酶丝状真菌,由河南科技学院生命科技学院发酵工程实验室筛选、分离、保存并提供,该菌株经分类鉴定为子囊菌属丝状真菌(Ascomycotinas sp.)。
1.2 试验原料
玉米秸秆,新乡市郊外田地里采集,100℃烘干,粉碎,过40目筛待用。
1.3 培养基
斜面活化培养基:土豆汁100 mL,硫酸铵1%,磷酸二氢钾0.5%,葡萄糖2%,琼脂2%,pH自然。
液体种子培养基:土豆汁100 mL,硫酸铵1%,磷酸二氢钾0.5%,葡萄糖2%,pH自然。
发酵培养基:土豆汁100 mL,玉米秸秆12.5%(W/V),pH自然。
1.4 方法
1.4.1 菌种活化
无菌操作将所试丝状真菌接种于斜面培养基,37℃培养72 h,连续活化两代。
1.4.2 液体种子培养
无菌操作将所试丝状真菌斜面培养物接种于盛有50 mL液体种子培养基的250 mL三角瓶,37℃静置培养24 h,备用。
1.4.3 发酵培养
无菌操作将上述种子液按8%的接种量接种盛有50 mL发酵培养基的250 mL三角瓶内,37℃静置发酵。
1.4.4 菌体生物量的测定[14]
菌体生物量的测定采用生理指标法中的菌体含碳量测定进行描述。
1.4.5 产物CMC-Na酶活力的测定
以CMC-Na酶为代表进行产物纤维素酶活力测定,其方法采用DNS试剂法[15]。首先进行葡萄糖标准曲线绘制,然后依照葡萄糖标准曲线绘制步骤进行发酵液中产物纤维素酶活性的测定。酶活定义为:1 mL粗酶液在1 min分解底物产生1 μg葡萄糖为1个酶活单位(U)。酶活计算方法如下:酶活=稀释酶活测定值×1 000×稀释倍数/反应时间。

表1 葡萄糖标准曲线制作Table 1 Preparation of standard curve of glucose(mL)
1.4.6 底物玉米秸秆纤维素消耗的测定
利用硫酸蒽酮法测定纤维素含量[16],取6支小试管,按照表2分别加入各种试剂,塞上塞子、充分混匀后静置1 min,然后在620 nm下,测定不同含量纤维素溶液的吸光度,以测得的吸光度为纵坐标,横坐标表示纤维素含量,绘制纤维素含量的标准曲线。发酵液中纤维素含量测定同纤维素含量标准曲线绘制步骤。

表2 纤维素标准曲线制作Table 2 Preparation of standard curve of cellulose (mL)
2 结果与分析
2.1 菌体生物量标准曲线
重铬酸钾法测定生物量所制作的菌体生物量标准曲线见图1。由图1可知,菌体浓度在0.1~0.8 g·L-1范围内时,吸光度与菌体浓度成正相关,其相关系数R2=0.99546,可知该标准曲线可以用于菌体生物量的计算,可为菌体生长动力学模型建立和验证时的数据计算提供依据。

图1 菌体生物量标准曲线Fig.1 Standard curve of mycelium biomass
2.2 葡萄糖标准曲线
DNS法测定葡萄糖含量所制作的葡萄糖标准曲线见图2,由图2可以看出,当葡萄糖浓度在0.1~0.35 g·L-1范围内时,吸光度和葡萄糖浓度之间有着良好的线性关系,相关系数R2=0.99554,可知该葡萄糖标准曲线能较好地进行产物CMC-Na酶活力的测定和计算,为产物酶形成动力学模型建立和验证时的数据计算提供依据。

图2 葡萄糖标准曲线Fig.2 Standard curve of glucose
2.3 纤维素含量标准曲线
硫酸蒽酮法测定基质纤维素含量所绘制的纤维素含量标准曲线见图3。由图3可知,纤维素浓度在40~180 mg·L-1范围内,吸光度和纤维素浓度具有良好的线性相关性,其相关系数R2=0.99228。可知该纤维素含量标准曲线可用于玉米秸秆中纤维素含量变化的计算,从而用于基质纤维素消耗动力学模型建立和验证时的数据计算提供依据。

图3 纤维素含量标准曲线Fig.3 Standard curve of cellulose content
2.4 批式发酵试验结果
批式发酵结果如图4(a,b)。该丝状真菌的各个生长阶段比较分明。菌体生长的延滞期较长,18 h后逐步进入对数生长期,当发酵至72 h左右时,菌体生长达到稳定期,此后细胞生物量维持恒定,96 h获得最大菌体干重为9.046 g·L-1。纤维素基质含量的变化为逐渐降低趋势。而由产物酶的形成曲线可知,产物酶的形成与细胞的生长是同步的,其二者的关系表现为偶联型,即菌体快速生长时产物酶也大量积累生成,菌体生长稳定期时产物酶不在大量积累而基本维持恒定。此外,由图4还可知,底物纤维素消耗曲线、细胞生长曲线和产物酶的形成曲线三者有一定的相关性,即细胞在对数生长期时,对底物的利用速度较快。


图4 批式发酵试验结果Fig.4 Results of batch fermentation
2.5 细胞生长动力学模型
在子囊菌属丝状真菌(Ascomycotinas sp.)转化玉米秸秆纤维素的分批发酵过程中发现,高浓度底物对该丝状真菌产生抑制,因此,不宜采用经典的Monod模型来描述其细胞生长动力学特征。Logistic方程能很好地反映分批发酵过程菌体生长与底物浓度之间的动力学过程,具有广泛的适用性。Logistic方程为:

式中,Cx为细胞浓度(g·L-1DW),Cxm为最大细胞浓度(g·L-1DW),μm为最大比生长速率(h-1)。以t=0时,Cx=Cx0为初始条件,上式积分后,可得:
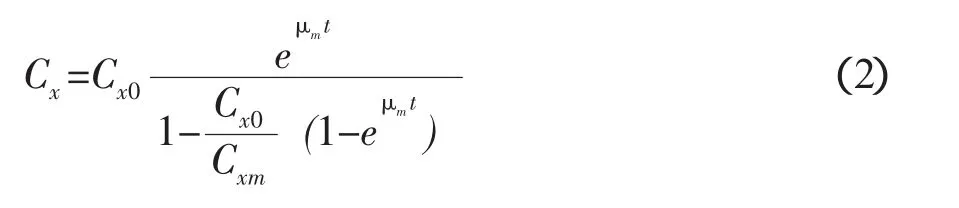
将(2)式整理后得:

2.6 产物生成动力学模型
Gaden根据产物生成速率与细胞生长速率之间的关系,将其分为三种类型:生长偶联模型;混合模型又称为Luedeking-Piret模型和非生长偶联模型。从该丝状真菌分批发酵试验结果来看,产物CMC-Na酶的生成是伴随在菌体生长过程中的,可采用生长偶联模型描述产物酶的生成动力学特征。
生长偶联模型的数学表达式为:

稳态时,dCx/dt=0,Cx=Cxm
将式(4)积分后得:

式(5)可简写为如下形式:

其中,
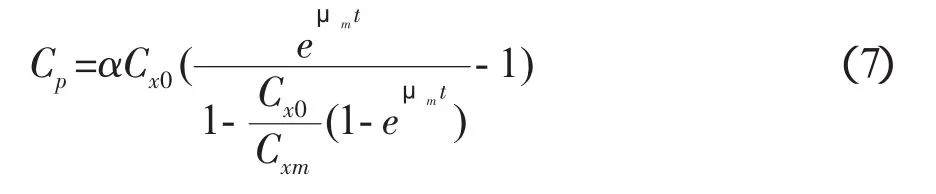
式(7)中 μm,Cxm,Cx0均已知,以 [CP] 对 A(t)作图,直线斜率即为α值。
2.7 底物消耗动力学模型
底物消耗主要用于三个方面:细胞生长消耗;细胞维持基本生命活动消耗;合成代谢产物的消耗。因此可用如下动力学方程表示:

式中,CS为基质浓度(mg·L-1),CX为细胞浓度(g·L-1,干重),CP为酶活力单位(U·L-1),m 为细胞的维持系数(s-1),Yx/s为菌体相对于基质的得率系数(g细胞·mg-1基质),其定义为生成细胞的干重与用于细胞生长而消耗基质的质量之比。Yp/s为产物相对于基质的得率系数(U·mg-1基质)。
将式(4)代入式(8)后得:
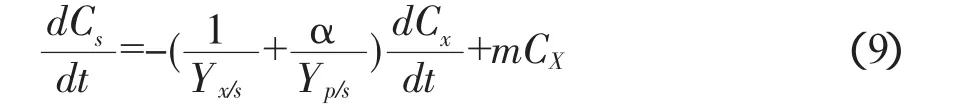
式(9)可简化为:

由于维持细胞生长的消耗很小,所以可以忽略不计,即=0
式(10)可简化为:

将式(11)积分后得:

式(12)简化为:
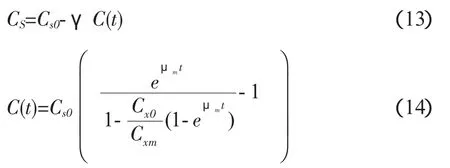
式(13)中 γ 可由式(11)得到,μm,Cxm,Cx0均已知,以[Cs0-Cs]对C(t)作图,直线斜率即为γ值。
2.8 模型求解
将上述各个动力学模型根据试验数据利用计算机模拟求解,得模型中的各个参数及试验初始条件如表3所示:

表3 动力学模型参数及初始条件Table 3 Parameters value in the kinetic models and initial conditions of batch fermentation for filamentous fungi
2.9 模型的验证
在已知试验条件下,进行丝状真菌分批转化玉米秸秆纤维素的重复试验,分别测定细胞生长,产物酶合成及底物纤维素消耗并绘制曲线,然后对分批发酵试验的试验值与动力学模型曲线的模型值进行拟合,得图5~7。
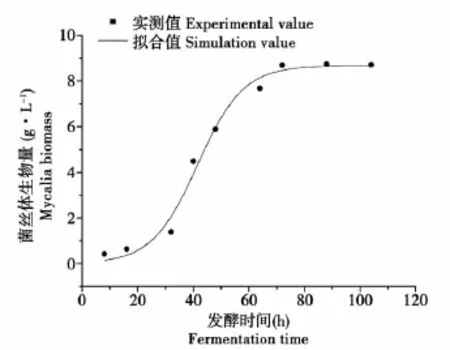
图5 细胞生长模型值与试验值比较Fig.5 Comparison of cell growth model value and test value
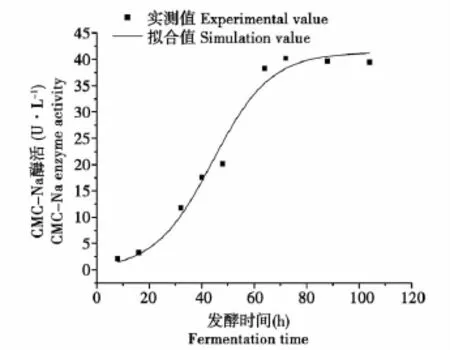
图6 产物酶动力学模型值与试验值比较Fig.6 Comparison of enzyme activity model value and test value

图7 纤维素消耗动力学模型值与试验值比较Fig.7 Comparison of cellulose consumption model value and test value
图7分别显示了细胞生长的模型值,产物酶合成的模型值和底物消耗的模型值与试验实测值拟合程度,其相对误差分别为0.1998、5.9035和0.00072,相关系数分别为 0.98827、0.98283和0.99599,结果显示了所建底物消耗动力学模型能够很好地描述丝状真菌兼性厌氧液体发酵过程中对基质的消耗规律;而所建立的细胞生长动力学模型和产物合成动力学模型只是基本能较好的反映微生物的实际生长和产酶过程,其模型值与实测值的相对误差均大于15%。分析可知造成较高相对误差的区域主要分布在菌体生长的对数期后期,此时由于菌体生长所需的营养开始出现匮乏,造成部分菌体生长速率下降甚至开始出现菌体死亡,因此,所测试验值与模型值出现较大偏差。此外,由于菌体产酶动力学特征显示其产酶与菌体生长表现为偶联型,因此造成产物酶合成的模型值与实测值也表现为较高的相对误差。再者,造成产物合成动力学模型值与试验实测值相对误差较大的另一方面的原因可能是微生物所产纤维素酶系为一复合酶系,其他酶如纤维素外切酶,β-葡萄糖苷酶等的存在可能对CMC-Na酶活大小有一定影响。
3 讨论与结论
微生物发酵动力学是生物反应工程学的理论基础,通过数学模型定量表达发酵过程中各种与微生物生长、基质消耗和产物形成有关的因素,可进一步了解微生物的生理特征,菌体生长和产物形成的合适条件,以及各发酵参数之间的关系,从而为发酵过程的工艺控制,反应器放大以及利用计算机对发酵过程实现自动化控制创造条件。
不同的微生物具有不同的生长代谢特性和代谢规律,通过建立微生物的发酵动力学数学模型可以更好地发挥微生物自身特点以实现更有效的发酵和控制,从而最大限度地获得理想产物。Logistic方程和Luedeking-Piret方程对于描述微生物生长、基质消耗和产物形成具有广泛适应性,然而,微生物发酵过程的复杂性以及影响因素的多变性,使得所建发酵动力学模型并不能完全反映实际的微生物发酵过程。为此,在以后的研究过程中需要对实际发酵过程进行多次优化以及对所建模型进行修正和补充,使模型值与试验数据拟合较好。
本文通过Logistic方程和Luedeking-Piret方程,获到了产纤维素酶丝状真菌的兼性厌氧液体发酵动力学模型包括细胞生长动力学模型、底物消耗动力学模型及产物酶合成动力学模型及模型的参数,并对试验实测值与模型值进行了验证比较。结果表明,模型计算值与试验值拟和良好,相关系数分别为:0.98827、0.98283和0.99599,所建模型能较好地描述该丝状真菌生物降解玉米秸秆产纤维素酶的发酵动力学特征,该研究不同于以往报道中的生产菌株大多为好氧微生物[17-20],该菌为兼性厌氧微生物,在发酵产酶上具有显著优势,研究其兼性厌氧发酵动力学对于进一步优化其产酶条件和提高产酶能力具有一定的参考价值和理论意义。
[1] Ragauskas A J,Williams C K,Davison B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311(5760):484-489.
[2] 杨叶东,韩袆君,张金龙.纤维素酶的研究、生产及其在纺织上的应用[J].激光生物学报,2000,9(2):151-153.
[3] Zhang Y H P,Lynd L R.Toward an aggregated understanding of enzymatic hydrolysis of cellulose:Non-complexed cellulase systems[J].Biotechnol Bioeng,2004,88:797-824.
[4] Oksanen T,Pere J,Paavilainen L,et al.Treatment of recycled Kraft pulps with Trichoderma reesei hemicellulases and cellulases[J].J Biotechnol,2000,78(1):39-48.
[5] Mach R L,Zeilinger S.Regulation of gene expression in industrial fungi:Trichoderma[J].Appl.Microbiol.Biotechnol,2003,60:515-522.
[6] Khalid M,Yang W J,Kishwar N,et al.Study of cellulolytic soil fungi and two nova species and new medium[J].J Zhejiang Univ Sci B,2006,7:459-466.
[7] 齐云,袁月祥,陈飞,等.一组纤维素分解菌的分离、筛选及其产酶条件的研究[J].天然产物研究与开发,2003,15(6):235-237.
[8] 高榕,邓迎达.高生产效率纤维素酶菌株初筛方法的研究[J].纤维素科学与技术,2004,12(3):20-24.
[9] Lynd L R,Weimer P J,Van Z W H,et al.Microbial cellulose utilization:Fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews,2002,66(3):506-577.
[10] Seo J H,Li H X,Kim M J,et al.Determination of agitation and aeration conditions for scale-up of cellulolytic enzymes production by Trichoderma inhamatum[J].KSJ1 Korean J Chem Eng,2007,24(5):800-805.
[11] Li H X,Kim M J,Kim S J.Cost-cutting of nitrogen source for economical production of cellulolytic enzymes by Trichoderma inhamatum[J].KSJ1 Korean J Chem.Eng.,2009,26(4):1070-1074.
[12] Chandra M S,Buddolla V B,Rajasekhar R.Cellulolytic enzymes on lignocellulosic substrates in solid state fermentation by Aspergillus niger[J].Indian J.Microbiol,2007,47:323-328.
[13] 武峥,张迎君,张超,等.绿色木霉T206产纤维素酶特性与酶促动力学研究[J].南方农业,2008,2(11):11-13.
[14] 中国价值百科[2011-3-4].[EB/OL].http://www.chinavalue.net/wiki/showcontent.aspx?titleid=186939
[15] 张洪斌,陈贤东,胡雪芹,等.一株里氏木霉产纤维素酶发酵研条件的研究[J].食品科学,2006,27(12):185-187.
[16] Leagene.北京雷根生物技术有限公司.[EB/OL].[2010-04-10]http://www.leagene.com/jszx/jszl/2010-04-10/1825.html
[17] 马怀良,郭文学,柴军红.常温高效纤维素分解菌的筛选[J].东北农业大学学报,2010,41(1):52-55.
[18] 刘保平,王宏燕,房红岩,等.降解秸秆的细菌和放线菌的分离与筛选[J].东北农业大学学报,2010,41(2):49-54.
[19] 刘震东,李文哲,刘爽,等.高效木质纤维素分解菌复合系的发酵特性[J].东北农业大学学报,2009,40(8):105-109.
[20] 张丹,许景钢,路伟明,等.低温降解纤维素的细菌的筛选及鉴定[J].东北农业大学学报,2008,39(1):55-57.

