铜石龙子肠道细菌数量的变化与免疫机能的关系
朱双杰,孟先科,张 莹,陈 熙
(滁州学院化学与生命科学系,滁州 安徽 239000)
肠道是动物机体最大的储菌库[1]。正常情况下,肠道菌群对宿主的作用以及它们之间的相互作用有重要的生物学意义,在宿主生长、发育过程中,许多生理、免疫功能的完善,均有赖于肠道菌群的辅助,肠道菌群之间平衡是建立在相互拮抗、协同基础上的[2]。一旦这种平衡遭到破坏,就造成微生态失调,将导致免疫力下降及各种疾病的发生[3-4]。微生态失调表现为细菌数量改变、菌群比例上的失调和细菌空间上的转移[2]。有关菌群比例失调和细菌空间上的转移对机体免疫力的影响有过报道[5],而有关肠道细菌数量的变化对机体免疫力的影响未见报道。铜石龙子(Sphenomorphus indicus)捕食农林害虫,有益于农林业,具有重要的生态价值;可入药,破石林,止痒,利小便,又具有重要的经济价值。野外的铜石龙子由于环境的变化而濒临衰退,同时人工的养殖又存在困难,因此研究影响铜石龙子的免疫机能的因素有很重要的意义。本试验以大黄、板蓝根为手段改变铜石龙子肠道细菌的数量,以探讨肠道细菌数量变化是否与铜石龙子免疫机能具有相关性,以期为蜥蜴类的研究提供参考。
1 材料与方法
1.1 采集与培养
铜石龙子采集与琅琊山,先用面包虫喂养7 d,再随机分成3组,每组25只:A组于饮用水中添加2%大黄、B组于饮水中添加2%板蓝根、C组饮水中不加中草药作对照,均于上午9:00喂饮。试验取样于第1、2、4、7、14、21和28天进行。
1.2 培养基
淡水鱼琼脂培养基(FWA)[5]。
1.3 肠道菌群计数
1.3.1 菌液制备
取新鲜的粪便0.1 g,加水10 mL,匀浆,准确移取0.5 mL匀浆液,加4.5 mL无菌水,制成原液,10倍稀释法,稀释到107倍。
1.3.2 细菌的计数
平板菌落计数法。
1.4 血清溶菌酶活性的测定
1.4.1 采血样制备血清
取样分别在开始投药饵前和投药饵后第1、2、4、7、14、21和28天的上午9:00进行。各组蜥蜴断头法取血,将血直接放入灭菌的离心管中封口,置室温下 l h,再以 2 000 r·min-1离心15 min,分离血清(用于溶菌酶活性的测定)。每次取样3条,试验重复3次。
1.4.2 溶菌酶活性的测定
酶活测定参照贾长虹[6]、李莉[5]的方法进行。
1.5 血液白细胞吞噬活性的测定
巨噬细胞活性的测定参照李莉[5]的方法进行。
2 结果与分析
2.1 饮食大黄和板蓝根后铜石龙子肠道细菌数量的变化特征
结果见表1,铜石龙子肠道细菌数量在服用大黄、板蓝根后均上升,第2天均高于对照组,大黄达(5.18±0.15)×107cfu·g-1,差异极显著(P<0.01),板蓝根组达(4.59±0.32)×107cfu·g-1,达显著水平(P<0.05)。第4天达到最大值,大黄组达(7.99±0.20)×107cfu·g-1(P<0.01),板蓝根组达(6.14±0.31)×107cfu·g-1,相对于对照组,差异极显著(P<0.01)。而后肠道细菌数量开始下降,第7天及以后测得数据,大黄组和板蓝根组与对照组无明显差异。说明:喂饮大黄和板蓝根后,铜石龙子肠道细菌数量有变化,其变化特征为:初期铜石龙子的肠道细菌的数量是增加的,但随之肠道细菌数量很快下降至对照水平。

表1 喂饮大黄、板蓝根后铜石龙子肠道细菌数量的变化Table 1 Change of number of bacteria in skink's alimental tract after drinking rhubarb and isatidis root(107cfu·g-1)
2.2 喂饮大黄和板蓝根后铜石龙子蜥蜴血液中溶菌酶活性的变化
溶菌酶为正常机体免疫防御机制的组成部分,具有溶解病原细菌细胞壁的作用。结果见表2,铜石龙子在喂饮大黄和板蓝根后,铜石龙子血液中溶菌酶活性呈上升趋势。大黄组:第2天达84.72±0.35 μg·mL-1,方差分析,显著高于对照组(P<0.05),第7天及以后测得数据为113.04±0.31、116.52±0.29、98.37±0.43 和 102.33±0.31 μg·mL-1,均显著高于对照组,差异极显著(P<0.01)。板蓝根组:溶菌酶的活性从第2天达到104.31±0.27 μg·mL-1,显著高于对照组,方差分析差异极显著(P<0.01),第4、7、14、21、28天此所测溶菌酶的活性均极显著高于对照组(P<0.01)。说明:喂饮大黄和板蓝根后,铜石龙子血液溶菌酶的活性显著增加。

表2 喂饮大黄和板蓝根后铜石龙子血液溶菌酶活性的变化Table 2 Effect of rhubarb and isatidis root on activity of lysozyme of microphage in blood of skink(μg·mL-1)
2.3 喂饮大黄和板蓝根后白条草蜥体液中抗体含量的变化
由表3可知,在喂饮大黄和板蓝根,两组后均表现出对抗原的免疫应答现象。两试验组在免疫后第4天两试验组的OD值分别为0.40、0.38,相比对照组的抗体效价OD值0.23差异显著(P<0.05),出现了免疫应答效应;并且,抗体效价继续上升,两试验组在第7、14、21、28天大黄组的OD值分别为0.68、0.74、0.62、0.60,板蓝根组的OD值分别为0.60、0.67、0.50、0.55,抗体效价的OD值均极显著高于对照组的OD值(P<0.01)。说明在喂饮大黄和板蓝根后,白条草蜥血液抗体效价均显著增加。

表3 大黄和板蓝根对白条草蜥体液中抗体效价的影响(OD490nm)Table 3 Effect of rhubarb and isatidis root on antibody's valence in blood of takydromus wolteri
2.4 喂饮大黄和板蓝根后铜石龙子血液中白细胞吞噬活性的变化
巨噬细胞来自血液中单核细胞,内含溶酶体,具有粘附能力和强大的吞噬功能,在生物体内是扮演清道夫角色,巨噬细胞的活性表现在两个方面,一是全部巨噬细胞中参与吞噬的细胞数,另一个是每个巨噬细胞的吞噬能力。
由表4可知,大黄组,血液中的白细胞吞噬百分比在第7天为(70.69%±0.26%),显著高于对照组(55.69%±0.38%)(P<0.05),并随着喂药饲养天数的增加而上升,吞噬百分比在14 d达到(78.75±0.37),极显著的高于对照组(57.32%±0.39%)(P<0.01),吞噬百分比在21、28 d分别为(77.83%±0.36%)、(77.67%±0.28%),均极显著高于对照组(P<0.01)。板蓝根组,第4天吞噬百分比为(64.19%±0.40%),显著高于对照组(57.83%±0.32%)(P<0.05),此后血细胞的吞噬百分比均显著高于对照组,其中在第21、28天的吞噬百分比为(70.49%±0.32%)、(67.77%±0.30%),于对照组相比,差异极显著(P<0.01)。说明:铜石龙子在饮用大黄和板蓝根后,巨噬细胞的活性先呈上升趋势,很快高于对照组,并与对照组保持显著差异。
在喂饮大黄和板蓝根后,铜石龙子巨噬细胞的吞噬指数(PI)上升。大黄组,吞噬指数在第4天为(1.99%±0.05%),开始和对照组1.83±0.07显出差异(P<0.05),第 7天吞噬指数达(2.08%±0.05%),和对照组1.82表现出差异极显著(P<0.01),这种极显著的差异保持到实验结束。板蓝根组,在喂饮大黄和板蓝根后,吞噬指数迅速上升,第2天的吞噬指数为1.95。相比对照组(1.81%±0.06%),差异显著(P<0.05),第4天的吞噬指数为(2.04%±0.02%),显著高于对照组(1.83%±0.07%),方差分析差异极显著,此后的吞噬指数均极显著的高于对照组(P<0.01),(见表5)。说明铜石龙子在饮用大黄、板蓝根后,每个巨噬细胞的吞噬指数明显增加。

表4 喂食大黄、板蓝根后铜石龙子血液巨噬细胞吞噬百分比的变化Table 4 Effect of rhubarb and isatidis root on phagocytic percentage of microphage in blood of skink(%)
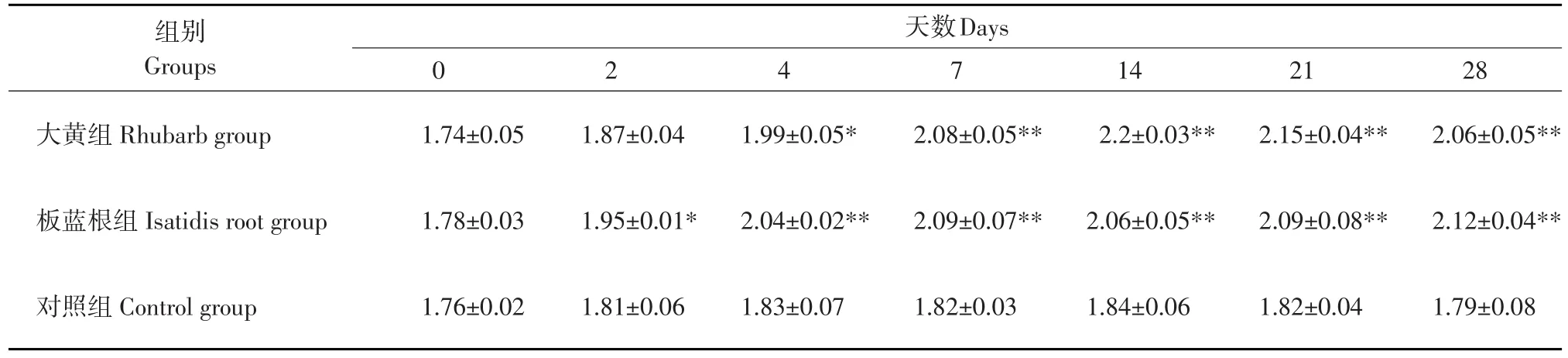
表5 大黄和板蓝根对铜石龙子噬细胞吞噬指数的影响Table 5 Effect of rhubarb and isatidis root on phagocytic indices of microphage in blood of skink
由以上两个结果的分析可以看出,铜石龙子在饮用大黄和板蓝根后,其血液里的巨噬细胞的吞噬活性迅速增加,并保持着和对照组的显著差异。
3 讨论
肠道细菌在肠道中起着生物屏障,有选择性地抑制外源细菌的作用,使之不能定植[7]。消化道菌群除了直接抑制致病菌定植之外,还对动物的免疫系统产生影响[8]。动物体内的正常菌群对于维护机体自身的免疫力有重要的作用,其免疫指标如巨噬细胞、免疫球蛋白、抗体等都与肠道细菌有着密切的相关性[9]。肠道细菌数量改变或种群比例上的失调或细菌空间上的转移都可能是影响动物体的免疫力因素。在本试验中,铜石龙子在饮用大黄和板蓝根后,其消化道细菌数量变化特征是先增加,但很快就降至对照组水平,而与动物体免疫力相关的抗体效价、溶菌酶活性和巨噬细胞的吞噬能力是很快增加的,并且在增加后均保持着和对照组显著的差异。肠道细菌变化的特征明显和免疫力相关的抗体效价、溶菌酶的活性和巨嗜细胞的活性变化特征不同,没有表现出相关性,说明肠道细菌数量的变化没有对石龙子的免疫力产生影响。但本实验中,铜石龙子的免疫力表现出了增强,这有可能是大黄和板蓝根本身引起的,也可能是大黄和板蓝根引起肠道菌群比例改变,益生菌在肠道内比例增加,从而增强了铜石龙子的免疫机能,具体机制有待于进一步研究。
4 结论
a.大黄和板蓝根对白条草蜥的免疫力具有促进作用,这种促进作用表现在大黄和板蓝根提高了白条草蜥的抗体效价、溶菌酶活性以及巨噬细胞的吞噬活性。
b.大黄和板蓝根对白条草蜥肠道细菌数量的改变有一定的作用,但这种作用与白条草蜥的免疫力无直接相关性。
[1] 金显文,黄山,吴孝兵.山地麻蜥消化道内分泌细胞的免疫组织化学研究[J].中国组织化学与细胞化学杂志,2008,17(1):51-55.
[2] 康白.微生态学[M].大连:大连出版社,1988,110-119.
[3] 梁庆红,张琳,段恕诚,等.肠道菌群失调对小鼠免疫和造血功能状态的影响[J].中华儿科杂志,2004,42(9):711.
[4] 王坚钱,汤瑾.益生菌对大鼠肠道菌紊乱和细菌易位的影响[J].上海交通大学学报:医学版,2006,2(26):163-165.
[5] 李莉.草鱼肠道菌群的变化和免疫机能的关系[D].武汉:华中农业大学,2003.
[6] 贾长虹,李向东,刘海山.溶菌酶标准酶活曲线测定方法的改进[J].河北理工大学学报:自然科学版,2009,31(3):121-123.
[7] 韩海棠.竞争性排斥培养物对肉鸡沙门氏菌定植、免疫力及血液生化指标的影响[D].乌鲁木齐:新疆农业大学,2000.
[8] 刘伟,丁伟群.益生菌对结肠炎大鼠乳膜细胞因子表达的影响[J].中华消化杂志,2006,5(12):801-803.
[9] 易力,汪洋.不同微生态制剂对肉仔鸡免疫器官指数和红细胞免疫功能的影响[J].中国兽医杂志,2005,10(4l):14-16.

