J亚群禽白血病病毒gp85单抗1E3株抗原识别表位的初步分析
莫虹斐,余 多,孙 淼,陈福勇,曹 红
(1.中国农业大学动物医学院,北京 海淀 100193;2.西北农林科技大学动物医学院,陕西 杨凌 712100)
J亚型禽白血病是由J亚群禽白血病病毒(ALV-J)引起的一种以成髓细胞增生、免疫抑制、生长发育受阻为特点的传染性肿瘤疾病[1-2],于1988年由英国的Payne博士[3]等首次发现。该病近年来在我国的发病率呈逐年上升趋势。ALV-J基因组主要含有3个基因,即gag、pol和env,其中env基因编码的囊膜表面蛋白gp85是病毒抗原的主要成分,决定病毒亚群特异性和宿主范围[4]。2000年,秦爱建、崔治中等[5]首次在国内研制了抗J亚群禽白血病病毒囊膜糖蛋白特异性单克隆抗体,并分析了其识别的ALV-J囊膜糖蛋白的分子量为90~94kD,识别的未糖基化的囊膜蛋白分子量约为53kD;2003年,杨玉莹、秦爱建等[6]首次克隆表达了gp85基因,证明gp85蛋白具有病毒的抗原特异性。但目前国内外尚无ALV-J gp85单克隆抗体识别的具体表位的相关报道。
本试验为了初步确定ALV-J gp85单克隆抗体1E3株所识别的抗原位点,将S1株的gp85基因进行了分段克隆表达,并通过免疫印迹的方法进行分析,结果发现1E3株单抗识别的抗原表位位于gp85蛋白N端第69至112个氨基酸之间。此项研究为进一步分析ALV-J中国分离株S1的抗原性变异及gp85蛋白的抗原表位所在位点奠定了基础,为建立以表位为基础的抗原抗体诊断方法提供了必要的物质材料支持,对于深入了解ALV-J的亚群特性、致病机理以及诊断和预防均具有重要的理论和实践意义。
1 材料与方法
1.1 菌种与质粒 感受态细胞DH5α及BL21购于北京博大泰克生物基因技术有限责任公司,原核细胞表达载体pGEX-6p-1、重组质粒pET-28a-J gp85,均为本实验室保存。
1.2 主要试剂及试剂盒 ALV-J S1gp85特异性单克隆抗体1E3株,为本实验室制备;限制性内切酶Bam HⅠ、XhoⅠ、10×K Buffer,购自 TaKaRa公司;Taq plus DNA聚合酶、10×PCR Buffer、HRP标记的羊抗鼠IgG,购自北京鼎国昌盛生物技术有限责任公司;dNTPs、IPTG,购自北京盛旭百川生物科技有限公司;抗GST标签小鼠单克隆抗体、高灵敏化学发光检测试剂盒,购自北京康为世纪生物科技有限公司;高纯度质粒小量提取试剂盒,购自北京威格拉斯生物技术有限公司;DNA纯化与浓缩-25试剂盒、凝胶DNA回收试剂盒,均购自Zymo Research公司。
1.3 基因片段的初次分段亚克隆 对重组表达质粒pET-28a-J gp85进行测序及同源性分析,根据ALV-J S1株病毒gp85基因序列,设计两对特异性引物A和B,用于扩增gp85基因A片段(1~687 bp)和B片段(337~921bp),在上、下游引物中分别引入酶切位点Bam HⅠ和XhoⅠ(下划线),同时还加入保护性碱基和终止密码子。扩增产物经1%DNA琼脂糖凝胶电泳分析。

1.4 重组原核表达质粒pGEX-6p-1-J gp85-A、pGEX-6p-1-J gp85-B的构建 PCR产物经过回收和纯化,用限制性内切酶Bam HⅠ和XhoⅠ进行双酶切,同时表达载体也进行双酶切。将目的基因和载体用SolutionⅠ酶连接,构建成重组质粒,转化入感受态细胞DH5α并进行扩增培养,挑取单个菌落并提取质粒进行PCR鉴定和双酶切鉴定,将双阳性质粒送检测序。阳性重组质粒转化入感受态细胞BL21,构建基因重组表达工程菌。
1.5 重组蛋白的诱导表达和Western-blot鉴定37℃振摇培养工程菌,至OD600=0.4~0.6时加入IPTG诱导表达4h,重组蛋白进行SDS-PAGE电泳1h,产物经4℃、100V、200mA恒流转印1h至PVDF膜上,5%脱脂乳4℃封闭8h,经PBST洗涤3次后,分别以抗GST标签鼠单克隆抗体和ALV-J gp85单抗1E3株为一抗,室温下孵育1h,PBST洗涤6次。以HRP标记的羊抗鼠IgG为二抗,室温下孵育30min,PBST洗涤6次。最后滴加适量发光液,曝光1~10min,标记并保存胶片。
1.6 基因片段A的分段亚克隆、表达及鉴定 根据其片段A的基因序列,设计两对特异性引物,分别用于C片段(1~204bp)和D片段(115~336bp)的扩增和克隆。扩增产物经1%DNA琼脂糖凝胶电泳分析。

PCR产物经回收、连接后构建重组表达质粒pGEX-6p-1-J gp85-C、pGEX-6p-1-J gp85-D。鉴定后,按照前述方法进行诱导表达和Western-blot鉴定(转印40min、曝光1~3min)。
2 结果
2.1 实验室保存的ALV-J S1株gp85基因核苷酸长度为921bp,编码307个氨基酸。经测序比对,与已发表的NX0101株的gp85基因核苷酸序列同源性为96%,发生了22个氨基酸点突变,在118处缺失一个组氨酸(H)。
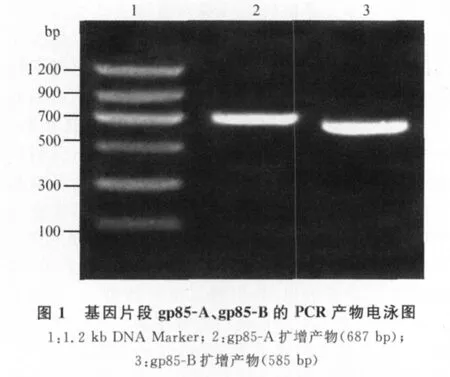
2.2 ALV-J gp85-A、ALV-J gp85-B重组质粒的构建 通过PCR技术亚克隆了gp85-A和gp85-B基因片段,经琼脂糖凝胶电泳检测扩增产物,与预期大小相符(图1)。
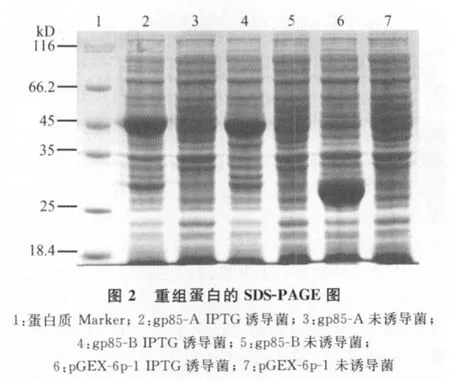
2.3 重组蛋白gp85-A、gp85-B的SDS-PAGE分析 预期重组蛋白gp85-A大小为51kD,gp85-B为48kD。经SDS-PAGE结果表明,重组菌诱导后在45kD处出现一条较粗的蛋白条带,大小与目的蛋白的理论值相符,初步确定为重组蛋白。空载体诱导后在约25kD处出现一条较粗的蛋白条带,初步确定为GST标签蛋白。而空载体、重组菌的不诱导对照组的相应位置处均无相应条带(图2)。
2.4 重组蛋白gp85-A、gp85-B的Western-blot分析 重组蛋白与抗GST标签鼠单克隆抗体反应的Western-blot结果可见,重组蛋白在蛋白质Marker的50kD处出现特异带,空载体标签蛋白在大约26 kD处出现条带(图3)。
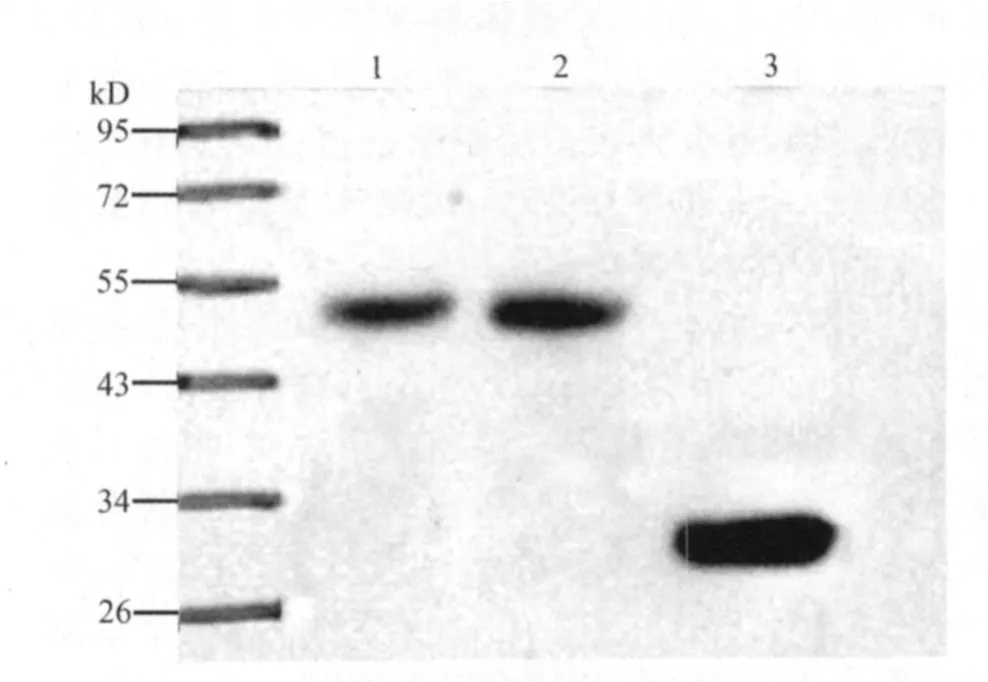
图3 重组蛋白的Western-blot分析
重组蛋白与ALV-J S1gp85特异性单抗1E3株反应的Western-blot结果可见,gp85-A蛋白出现特异带,而gp85-B、空载体标签蛋白没有出现任何条带(图4)。证明仅有gp85-A蛋白可以被ALV-J S1gp85特异性单抗1E3株所识别。
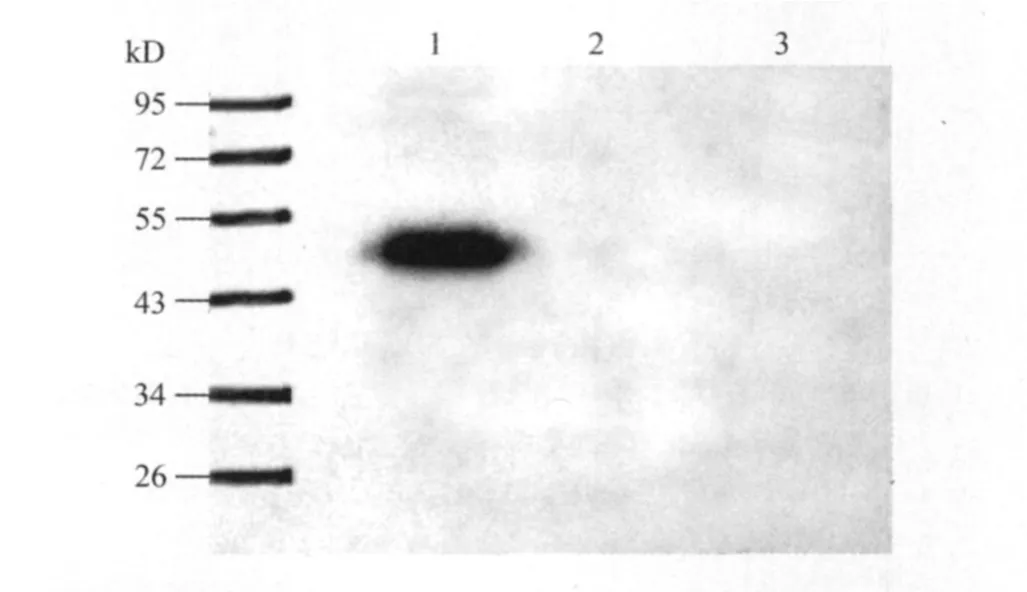
图4 重组蛋白与gp85单抗1E3株的Western-blot分析
2.5 ALV-J gp85-C、ALV-J gp85-D重组质粒的构建 通过PCR技术亚克隆了gp85-C和gp85-D基因片段,经琼脂糖凝胶电泳检测扩增产物,与预期大小相符(图5)。

图5 基因片段gp85-C、gp85-D的PCR产物电泳图
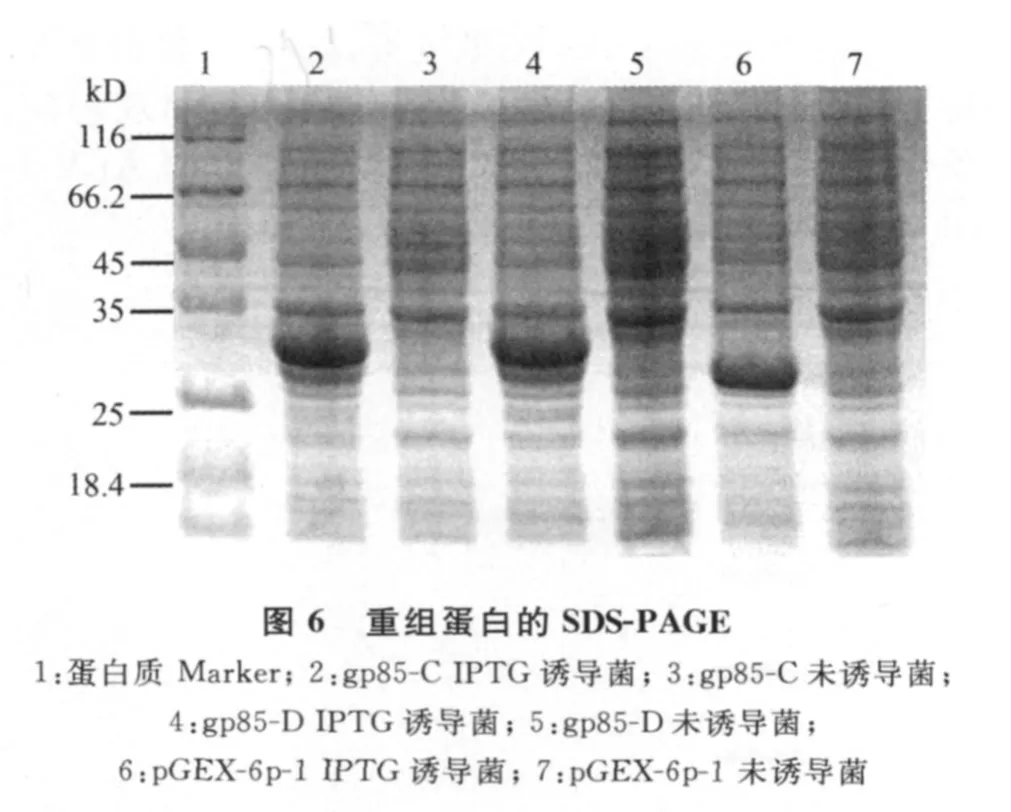
2.6 重组蛋白gp85-C、gp85-D的SDS-PAGE分析 预期重组蛋白gp85-C大小为33kD,gp85-D为34kD。经SDS-PAGE结果表明,重组菌诱导后在25~35kD之间有一条较粗的蛋白条带,大小与目的蛋白的理论值相符,初步确定为重组蛋白。空载体诱导后在约25kD处出现一条较粗的蛋白条带,初步确定为GST标签蛋白。而空载体、重组菌的对照组(不诱导)的相应位置处均无相应条带(图6)。
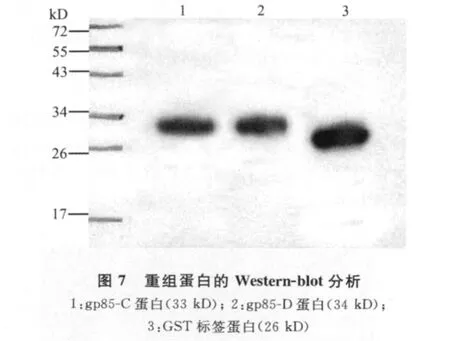
2.7 重组蛋白gp85-C、gp85-D的 Western-blot分析 重组蛋白与抗GST标签鼠单克隆抗体反应的Western-blot结果可见,重组蛋白在大约蛋白质Marker的35kD处出现特异带,空载体标签蛋白在大约26kD处出现条带(图7)。
重组蛋白与ALV-J S1gp85特异性单抗1E3株反应的Western-blot结果可见,gp85-D蛋白出现特异带,而gp85-C没有出现任何条带(图8)。证明仅有gp85-D蛋白可以被ALV-J S1gp85特异性单抗1E3株所识别。

图8 重组蛋白与gp85单抗1E3株的Western-blot分析
2.8 抗原表位初步分析 为了初步确定ALV-J gp85单抗1E3株所识别的抗原位点,我们用ALV-J S1gp85单克隆抗体1E3株对重组表达蛋白进行Westem-blot分析。从试验结果可以看出,初次亚克隆中,仅gp85-A蛋白被单抗识别,反应出现了特异条带,而gp85-B蛋白则没有,结合两者的氨基酸序列,gp85-A蛋白包含了第1~229个氨基酸,gp85-B蛋白包含了第112~307个氨基酸,说明该株gp85单抗的抗原表位可能在第1~112个氨基酸之间,对应的核苷酸序列为1~336bp。再次亚克隆时,针对gp85基因的1~336bp核苷酸序列进行分段,试验结果表明,gp85-C未出现任何条带,而gp85-D则被单抗识别,出现了特异条带,结合两者的氨基酸序列,gp85-C蛋白包含了第1~68个氨基酸,gp85-D蛋白包含了第38~112个氨基酸,因此,最终结果表明,ALV-J S1gp85单抗1E3株的抗原表位可能在第69到112个氨基酸(N端)之间,对应的核苷酸序列为205~336bp。
3 讨论
3.1 ALV-J表型的决定因素是位于病毒表面,与宿主细胞受体作用的囊膜蛋白gp85,本试验利用国内分离的ALV毒株,采用PCR技术成功分段扩增了ALV-J的gp85基因,利用pGEX-6p-1载体在BL21中成功表达了该基因,SDS-PAGE及 Western-blot结果表明,表达的目的蛋白大小与预期相符,具有反应原性。重组蛋白gp85-A、gp85-D经Western-blot检测表明,具有gp85单抗1E3株可识别的抗原表位。本试验初步研究了ALV-J囊膜蛋白gp85的抗原决定簇,为进一步研究中国株ALVJ gp85的抗原性变异及gp85蛋白的抗原表位所在位点奠定了基础,并为进一步研制针对 ALV-J gp85蛋白的快速检测试剂盒提供了有力的工具。
3.2 本试验是为了分析gp85蛋白单抗识别的抗原表位,这就需要重组蛋白具有较大的表达量,而非易于提纯的特点。pGEX载体表现氨苄青霉素抗性,其特点是在载体上接上了一种26kD的谷胱甘肽s-转移酶基因,这使得表达后的融合蛋白上含有1个26kD的GST标签蛋白[7],可增大重组蛋白的质量,易于在电泳时观察和分析结果。
3.3 决定抗原表位的3个主要因素即亲水性、抗原指数和表面可能性,由ALV-J S1分离株gp85蛋白的氨基酸序列的抗原表位预测结果表明,可能存在着6个极有可能构成抗原表位的区域,其位置分别在第80~90个、第90~100个、第110~120个、第140~150个、第180~200个、第300~307个氨基酸之间。本试验的结果符合以上预测。
[1]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:870-885.
[2]乔彦华.J亚群禽白血病病毒gp85基因的克隆、原核表达及初步应用[D].北京:中国农业大学硕士论文,2008.
[3]Payne L N,Brown S R,Bumstead N,et al.A novel subgroup of exogenous avain leucosis virus in Chicken[J].Journal of General Virology,1991,72:801-807.
[4]Calanek B W.禽病学[M].高福,苏敬良,译.北京:中国农业出版社,1999:529-559.
[5]秦爱建,崔治中,LEE LUCY,等.抗J亚群禽白血病病毒囊膜糖蛋白特异性单克隆抗体的研制及其特性[J].畜牧兽医学报,2001,32(6):556-562.
[6]杨玉莹,秦爱建,赵振华,等.J亚群禽白血病病毒膜表面糖蛋白基因gp85的克隆与表达[J].中国兽医科技,2003,33(7):3-6.
[7]周宇荀,魏东芝,王二力.融合蛋白表达载体pGEX及其应用[J].生命科学,1998,10(3):122-124.

