应用随机扩增多态性进行山羊致病性大肠杆菌的分子多态性分析
李 军,彭 昊,陶 立,朱娟娟,陈泽祥,韦志锋,兰美益,秦若甫,杨 威
(1.广西兽医研究所,广西 南宁 530001;2.广西大学动物科学技术学院,广西 南宁 530005)
山羊大肠杆菌病是一种严重危害广西山羊养殖的细菌性疾病,该病多发于数日龄至6周龄的羔羊,主要经消化道感染,引起羔羊腹泻、脱水和毒血症死亡;此外,大肠杆菌还可侵入肠壁进入血液循环系统发展成为败血型大肠杆菌病。大肠杆菌种类众多,在大肠杆菌流行病学调查和病原性研究中,人们引入分型方法对其进行研究。传统的大肠杆菌分型方法是以大肠杆菌抗原O、K、H的抗原性为基础,通过血清学方法进行分型[1-2]。由于大肠杆菌O、K、H抗原的氨基酸同源性较高,彼此间存在抗原交叉,应用血清学方法难以准确区分,给大肠杆菌的鉴定造成了困难[3]。随着分子生物学的发展,以基因为基础的分子分型方法凭着准确、敏感和分辨性高的优点克服了传统血清学分型的局限。随机扩增多态性方法(randomly amplified polymorphic DNA,RAPD)是在PCR基础上发展的一项基因分型技术,因其成本低、操作简捷、无需预先了解基因序列等优点,在生物物种全基因DNA的多态性检测分析中得到广泛应用[5-7]。本实验室在开展广西山羊细菌性疾病流行病学调查过程中发现传统血清学分型方法无法准确对临床分离的大肠杆菌进行分型,因此,本试验旨在应用RAPD技术对广西山羊大肠杆菌进行分子分型,为其流行病学研究提供技术支撑。
1 材料与方法
1.1 主要试剂与仪器 细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司。PCR Taq Mix、DNA Marker 3,购自广东东盛生物科技有限公司;麦康凯琼脂培养基,购自北京陆桥技术责任有限公司。PCR仪,购自日本TaKaRa公司;凝胶成像系统,购自美国Alpha Inotech公司。
1.2 菌株来源 10株大肠杆菌分离自山羊组织和粪便,由本实验室分离、鉴定和保存(表1)。
1.3 引物 根据文献[7-9]报道的相关序列设计8条随机引物,引物P1序列为:5′-ACTTGACGGG-3′,P2:5′-GAGCCCTCCA-3′,P3:5′-TGCCCGTCGT-3′,P4:5′-CAGCTCACGA-3′,P5:5′-AGC GTC CTC C-3′,P6:5′-GGCTCATGTC-3′,P7:5′-GTGCAATGAG-3′,P8:5′-AAGAGCCCGT-3′。引物由上海英骏生物技术有限公司合成。菌株Sn11和Nx31、菌株Nx32和Nx34的遗传关系最密切;菌株Ms03的遗传关系与其余9株菌株最远。

表1 本试验所用大肠杆菌菌株
1.4 模板DNA的提取 挑取单个菌落于麦康凯琼脂培养基37℃培养18h,生理盐水洗脱细菌,用细菌基因组DNA提取试剂盒抽提细菌DNA,提取方法按说明书进行。
1.5 RAPD扩增 PCR反应体系为25μL,其中PCR Taq Mix 12μL、引物(25pmol/μL)1μL、DNA模板2.5μL、ddH2O 9.5μL。反应条件为:95℃ 预变性5min;随后进行30个循环,每个循环包括95℃1min,36℃1min,72℃2min,最后72℃延伸10min。PCR反应结束后,取10μL PCR产物在1%琼脂糖凝胶电泳,凝胶成像系统拍照观察。
1.6 聚类分析 对每株细菌的RAPD多态性电泳图谱进行分析,有条带记为“1”,无条带记为“0”,在SPSS软件中,采用组间均联法进行聚类分析,作出聚类分析树状图。
2 结果
在选用的8条引物,引物P3、P4、P5和P8表现出较好的多态性扩增(图1),共扩增出18条DNA片段,10株菌株无共有条带。
对每株细菌的RAPD多态性电泳图谱进行扩增条带的统计,有条带记为“1”,无条带记为“0”,在SPSS软件中,采用组间均联法进行聚类分析,作出聚类分析树状图(图2)。在聚类图中,菌株Sn11和Nx31、菌株Nx32和Nx34的遗传关系最密切;菌株Ms03的遗传关系与其余9株菌株最远。
3 讨论
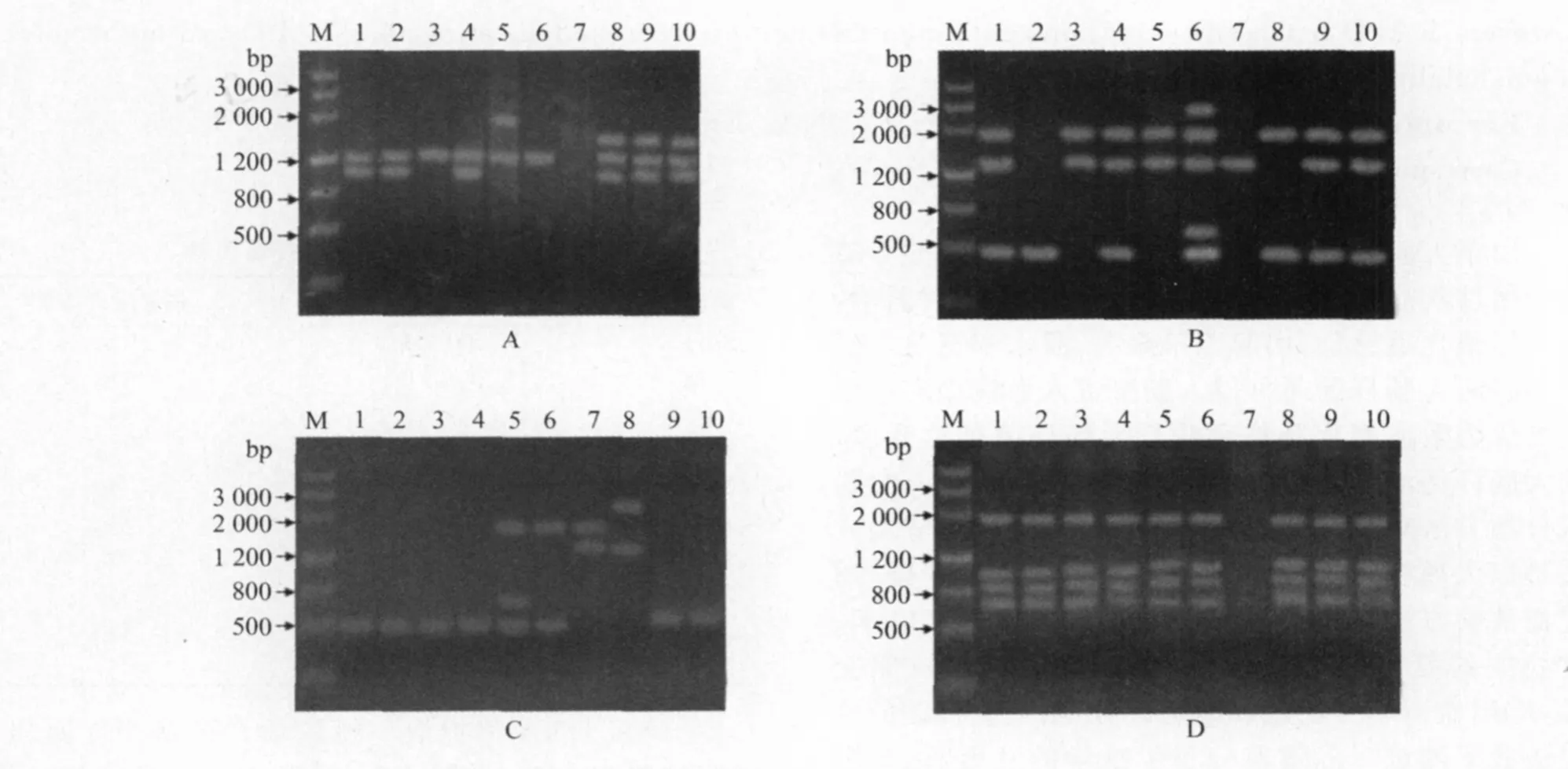
图1 引物P3(A)、P4(B)、P5(C)、P8(D)对10株大肠杆菌的随机扩增图谱
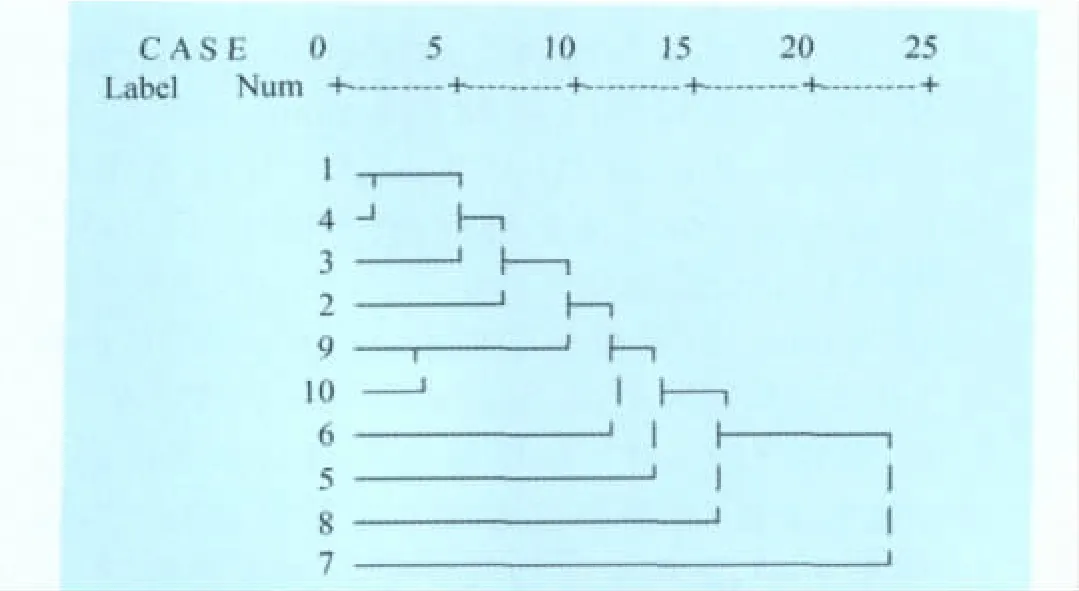
图2 根据RAPD结果绘制的聚类图
传统的大肠杆菌分型方法属血清学分型。在许多情况下,这些传统的分型方法局限性大[3],存在难以区分变异株及稀有血清型等问题。而RAPD可以对未知序列基因组进行多态性分析,比传统分型方法更能反映病原菌菌株间的亲缘关系,能从分子水平上揭示了不同菌株之间的遗传距离[4]。样品DNA经随机引物PCR扩增后得到的相同带谱的数目与样品间的遗传关系呈正相关[5],已经广泛应用于生物物种的分型鉴定。本试验应用RAPD技术对在山羊致病性大肠杆菌病流行病学调查所分离的10株大肠杆菌进行了基因分型,可为分子流行病学调查提供有效的手段。
本试验采用8条引物对10株分离自山羊的致病性大肠杆菌进行RAPD分析,有4条引物获得了良好的扩增,共扩增出18条不同的DNA片段。RAPD图谱表明,分析的山羊致病性大肠杆菌存在基因多态性,菌株Sn11与Nx31、菌株Nx32与Nx34的RAPD图谱相同,且聚类分析归为一类,表明菌株Sn11与Nx31,菌株Nx32与Nx34的遗传关系密切,这与菌株的血清凝集反应结果是吻合的。菌株Nx32与Nx34都是从同一样本中分离得到,因此这两株菌有可能是同一菌株的两次分离。菌株Nx31、Nx32与Nx34都是从同一样本中分离得到,且菌株Nx31与Nx32的血清凝集反应结果相同,曾被认为是同一菌株的两次分离,但是在RAPD分析中,两株细菌的带谱还是存在明显差别,说明菌株Nx31与Nx32只是遗传关系较为密切的两株细菌,这一结果也说明RAPD比血清学分型具有更高的分辨性,可以作为动物疫病流行病学调查和细菌鉴定的一种实用技术。
[1]杨威,谢永平,陈泽祥,等.广西地区猪水肿病流行病学调查与病原分析 [J].黑龙江畜牧兽医,2007,10:66-68.
[2]李文杨,黄瑜,施少华,等.我国部分地区致病性鸭大肠杆菌的分离及血清型鉴定 [J].中国兽医杂志,2009,45(12):43-44.
[3]Stuart F A,Corbel M J.Identification of a serological crossreaction between Brucella abortus and Escherichia coli O157[J].Vet Rec,1982,110(9):202-203.
[4]姜自锋,林乃铨,徐梅.RAPD技术及其应用中的一些问题[J].福建农林大学学报:自然科学版,2002,31(3):356-360.
[5]Medraoui L,Ater M,Benlhabib O,et al.Evaluation of genetic variability of sorghum (Sorghum bicolorL.Moench)in northwestern Morocco by ISSR and RAPD markers[J].C R Biol,2007,330(11):789-797.
[6]易鸿,廖育煌,刘俊华,等.用RAPD技术分析出血性大肠杆菌 O157∶H7[J].热带医学杂志,2002,2(2):124-126.
[7]汪铭书,程安春,李淑梅,等.鸭疫里氏杆菌鸭源致病性大肠埃希氏菌和鸭沙门菌的RAPD研究 [J].中国兽医科技,2004,34(10):3-8.
[8]朱向玲,严亚贤,陆承平,等.运用随机扩增多态性和质粒指纹图谱法进行大肠杆菌O157的分子多态性分析[J].上海交通大学学报:农业科学版,2008,26(4):259-263.

