不同地区鸡源大肠杆菌质粒介导的喹诺酮类药物耐药基因调查
董剑辉,熊惠军,宋 立,陈 瑞
(1.华南农业大学兽医学院,广东 广州 510642;2.中国兽医药品监察所,北京 海淀 100081)
喹诺酮类药物是兽医临床治疗动物细菌性疾病一类常用抗菌药物,此类药物的广泛应用,使动物源大肠杆菌对其耐药性也随之逐渐上升[1]。细菌对喹诺酮类药物的耐药机制主要是染色体介导的靶位改变、膜通透性改变和主动外排。近年来,质粒介导的喹诺酮类药物耐药(plasmid mediated quinolone resistance,PMQR)基因 qnrA[2],qnrB[3]、qnrS[4]相继出现,aac(6′)-Ib-cr和qep A这两种质粒介导的耐药基因也被证实[5-6]。本试验通过微量肉汤稀释法,检测2009年鸡源大肠杆菌的耐药情况,选择耐喹诺酮类药物的菌株,采用PCR方法检测PMQR基因,以了解不同地区鸡源大肠杆菌中PMQR基因的流行情况。
1 材料与方法
1.1 菌株来源 2009年从福建、广西、天津等地的蛋鸡场,采泄殖腔拭子,用麦康凯培养基分离、API 20E试条鉴定,分别分离到大肠杆菌 76、44、62株,共计182株。
1.2 主要试剂 麦康凯培养基、营养琼脂、营养肉汤、MH肉汤由中国兽医药品监察所基础保障室提供;抗菌药药敏板购自天津金章科技发展有限公司;API 20E试条购自BioMerieux公司;DNA Marker DL-2000购自 TaKa Ra公司;BtsCI购自NEB公司;Go Taq G reen Master Mix购自Promega公司;大肠杆菌质控菌株ATCC25922由中国兽医药品监察所提供。
1.3 耐药性测定 用药敏板进行检测,试验方法和判断标准参考临床与试验标准协会(CLSI)所推荐的微量肉汤稀释法。
1.4 引物的设计与合成 根据Gen Bank已知的序列,用Premier 5.0分别设计出5个基因的特异性引物(见表1),由Invitrogen公司合成。

表1 PC R引物序列
1.5 PCR扩增 用煮沸法提取DNA模板。根据不同的反应条件 PCR扩增 qnrA、qnrB、qnrS、aac(6′)-Ib和qep A 基因,对于aac(6′)-Ib的阳性株,胶回收后用BtsCI酶切,aac(6′)-Ib能被酶切,而 aac(6′)-Ib-cr不能被酶切。扩增阳性产物均送 Invitrogen公司测序,验证质粒序列。
2 结果与分析
2.1 药敏试验结果 182株鸡源大肠杆菌对13种抗菌药物的耐药率排序如下:四环素(96.15%)、磺胺异噁唑(92.86%)、复方新诺明(86.26%)、氨苄西林(80.77%)、氟苯尼考(78.02%)、阿莫西林/克拉维酸(73.08%)、恩诺沙星(74.73%)、氧氟沙星(65.93%)、庆大霉素(45.60%)、头孢噻呋(33.52%)、头孢唑林(28.02%)、阿米卡星(15.93%)、多粘菌素E(9.89%)。
2.2 PMQR基因检测结果 挑取耐恩诺沙星或氧氟沙星的菌株共166株,除qnrB外,PCR对其余四种质粒均有检出(见表2)。部分阳性株电泳结果见图1。
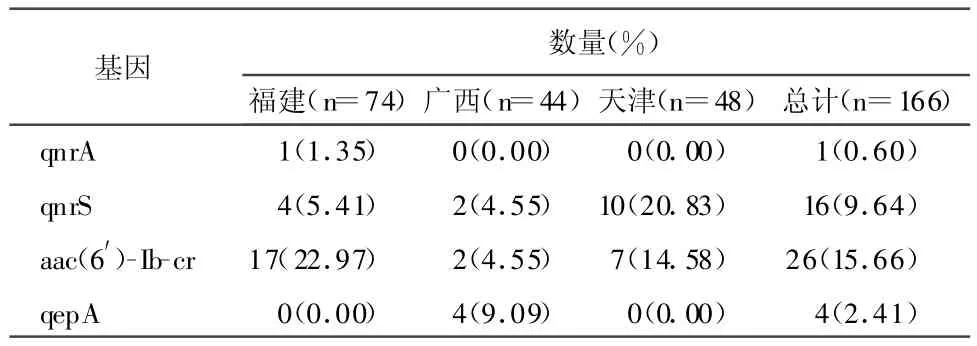
表2 不同地区大肠杆菌PMQR基因阳性率

图1 阳性PCR产物电泳图
3 讨论
喹诺酮类药物在兽医临床上的大量使用,导致了大肠杆菌对喹诺酮类药物的耐药率的上升。从试验结果可以看出,2009年部分地区的鸡源大肠杆菌,对兽医临床常用抗菌药存在耐药现象,对四环素、磺胺异噁唑、复方新诺明、氨苄西林、氟苯尼考、阿莫西林/克拉维酸、恩诺沙星、氧氟沙星等的耐药率均大于65%,这可能与这类药物的广泛使用有关;而对阿米卡星、多粘菌素的耐药率均小于20%,不同药物的耐药率差别较大,这可能与使用的药物不同有关。
目前,PMQR基因的广泛存在已经在世界范围内得到证实[7],各种基因的阳性率从1%~36%不等[4,8-9]。本研究对166株耐喹诺酮药物的鸡源大肠杆菌进行PMQR基因的检测,共检测到1株qnrA阳性菌株,16株qnrS阳性菌株,26株aac(6′)-Ib-cr阳性菌株和4株qepA阳性菌株,其阳性率分别为0.60%、9.64%、15.66%、2.41%,以 qnrS 和 aac(6′)-Ib-cr这两种基因为主。从不同地区PMQ R基因的检测结果来看,qnrA和qepA分别只在福建和广西的分离株中检出;对于qnrS基因,在天津的48株大肠杆菌中,阳性率为 20.83%,远高于福建(5.41%)和广西(4.55%)两个地区 ;而 aac(6′)-Ibcr基因在福建(22.97%)和天津(14.58%)的分离株中,阳性率也较高。由此可见,PMQR基因阳性的检出率可能与分离株的地域性有一定的关系。另外,由于菌株采集的数量以及不同养殖场用药情况的不同,也可能造成PMQR基因检出率的差异。
由于PMQR基因可在不同微生物间进行水平传播,将会加快喹诺酮类药物耐药性在细菌间的传播,从而导致大肠杆菌对喹诺酮类药物的耐药性进一步增强。因此,有必要在国内进行全面的喹诺酮类药物耐药性机理研究和PMQR基因的检测,建立相关数据库,以指导合理使用喹诺酮类药物,从而减少喹诺酮类药物耐药菌的产生和耐药质粒的传播。
[1]Yang H C,Ch en S,White D G,et a l.Characterization of m ultiple-antimicrobial-resistant E scherich ia coli isolates from diseased chickens and sw ine in China[J].Jou rn al of clinical m icrobiology,2004,42(8):3483-3489.
[2]Martinez-Martinez L,Pascual A,Jacoby G A.Quinolone resistan ce from a transferable plasmid[J].Lancet,1998,351(9105):797-799.
[3]Jacoby G A,Walsh K E,Mills D M,et a l.QnrB,another plasmid-mediated gene for quinolone resistance[J].An timicrob Agents Chemother,2006,50(4):1178-1182.
[4]Hata M,Suzuki M,Matsu moto M,eta l.C loning of a novel gene for qunoloine resistance from a transferab le plasmid in S higella flexneri 2b[J].An timicrob Agents Chemother,2005,49(2):801-803.
[5]Park C H,Robicsek A,Jacoby G A,eta l.Prevalence in the United States of aac(6′)-Ib-cr encoding a ciprofloxacin-modifying enzyme[J].Antimicrob Agents Chem oth er,2006,50(11):3953-3955.
[6]Yam ane K,Wachino J,Suzuki S,et al.New plasmid-mediated fluoroquin olone efflux pu mp,QepA,found in an Escherichia coli clinical isolates[J].Antimicrob Agents Chem other,2007,51(9):3354-3360.
[7]Ode T,S aito R,Kumita W,etal.An aly sis of plasmid-mediated multid ru g resistan ce in Escherich ia co li and K leb siella oxytoca isolates from clinicalspecim ens in Japan[J].In ternational Journal of Antimicrobial Agents,2009,34(4):347-350.
[8]Yue L,Jiang H X,Liao X P,etal.Prevalence of plasmid-mediated quinolone resistance qnr genes in poultry and sw ine clinical isolates of Escherichia co li[J].Veterinary Microbiology,2008,132(3-4):414-420.
[9]Baud ry P J,Nichol K,DeCorby M,et al.Mechanism s of resistan ce and mobility among multid ru g-resistant C TX-M-producing Escherichia coli from Canadian in tensive care u nits:the 1 st report of QepA in North America[J].Diagnostic Microbiology and Infectiou s Disease,2009,63(3):319-326.

