巨型艾美耳球虫gam82基因核酸疫苗的构建与免疫原性分析
彭 昊,许金俊,刘丹丹,李建梅,陶建平
(扬州大学兽医学院,江苏 扬州 225009)
鸡球虫病(coccidiosis of chickens)是一种严重危害养鸡业发展的寄生虫病,目前该病的防治主要依赖药物,但由于球虫耐药性的不断增强,以及药物残留肉蛋危害人体健康,迫使人们将目光从药物防治转向免疫预防。商品化的新型亚单位疫苗Cox-Abic是由巨型艾美耳球虫(E.maxima)的配子体抗原研制而成的,国外大量实际生产应用表明,免疫后球虫卵囊产量下降50%~80%,可用于球虫病的控制[1]。但存在生产工艺复杂,费用高等缺陷。核酸疫苗是把编码与免疫原相关的外源基因克隆到真核表达载体上,然后将重组的质粒DNA直接注射到动物体内,使外源基因在动物体内表达,产生的抗原激活机体的免疫系统,引发免疫反应[2],从而达到预防和治疗疾病的目的。本试验选择巨型艾美耳球虫NT株配子体gam82基因为疫苗候选抗原基因,以pcDNA3.1为真核表达载体构建成核酸疫苗,用淋巴细胞增殖试验和ELISA方法来评价核酸疫苗免疫后鸡体的细胞免疫与体液免疫水平。
1 材料与方法
1.1 质粒、菌株与虫株 宿主菌大肠杆菌DH5与表达载体pcDNA3.1均由本室保存;含gam82基因的重组质粒p GEM-T-gam82由本室构建。巨型艾美耳球虫NT株,由本室建种并保存。
1.2 试验动物 黄羽肉鸡,购自中国农业科学院家禽研究所育种中心,出壳后即运回实验室,饲养在经5%氨水和火焰消毒的环境与笼具中。
1.3 主要试剂 T 4 DNA连接酶为Promega公司产品;1 kb DNA Marker、高保真Taq DNA聚合酶、各种限制性内切酶为宝生物工程(大连)有限公司产品;QIAquick琼脂糖回收试剂盒为QIAGEN公司产品;辣根过氧化物酶(H RP)标记的羊抗鸡IgG为北京博奥森生物技术有限公司产品;DAB显色试剂盒为武汉博士德生物有限公司产品。
1.4 引物设计及合成 根据本室克隆的巨型艾美耳球虫N T株配子体gam82基因的完整编码区序列和pcDNA3.1酶切位点序列设计1对引物:上游引物 P1:5′-CCCAAGCTTA TGACGCGTGCGGCAGCGCT-3′,含Hin dⅢ酶切位点和3个保护性碱基 ;下游引物 P2:5′-CGGAATTCTTAG TTGTATGTT TCCCATACAG-3′,含 Eco RI酶切位点和 3个保护性碱基。P1与P 2间横跨gam82基因编码区,预计扩增片段长度为1791 bp。引物由宝生物工程(大连)有限公司合成。
1.5 PCR扩增 以重组质粒pGEM-T-gam82为模板进行PCR扩增:在PCR管中依次加入超纯水37 μL、10×PCR 缓冲液5μL、模板1μL、10 mmol/L dN TP 1μL 、引物P1和P 2(50 pmol/L)各1 μL、25 mmol/L MgCl23μL、高保真 Taq DN A聚合酶1μL,混匀后进行PCR反应。PCR循环条件:95℃预变性4 min;94℃变性40 s,58℃退火40 s,72℃延伸2 min,共30个循环;最后 72℃延伸 10 min。反应结束后取5μL产物1%琼脂糖凝胶电泳分析。
1.6 重组质粒的构建 PCR回收产物经过Eco RⅠ和Hin dⅢ双酶切和1%琼脂糖凝胶电泳后,用QIAquick琼脂糖核酸回收试剂盒回收,同时对pcDNA3.1质粒进行Eco RⅠ和 Hin dⅢ双酶切,回收线性载体片段与目的基因以摩尔比1∶5于16℃连接过夜。连接产物按常规转化大肠杆菌DH5α感受态细胞,通过Amp抗性与Eco RⅠ和Hin dⅢ双酶切筛选阳性质粒。挑取含插入片段的阳性重组质粒,接种半固体LB培养基,培养后直接寄送宝生物工程(大连)有限公司进行测序,以验证PCR产物的特异性和重组质粒的阅读框架的正确性。
1.7 核酸疫苗的免疫原性研究 将6日龄雏鸡随机分为4组,即核酸疫苗免疫组、pcDNA3.1空质粒组、卵囊免疫组、空白对照组,每组12羽。各注射质粒组每鸡胸肌注射25%高渗蔗糖溶液并按摩辅助扩散,再在相同位置纵向肌肉注射质粒溶液(含质粒100μg)。在7日龄(首免前)、14日龄(二免前)、21日龄时,分别在每组中随机取4只鸡,无菌心脏采血2 m L,其中1 mL用肝素抗凝后分离淋巴细胞,进行T淋巴细胞转化试验,另1 m L血液凝固后吸取血清,用于抗体检测。评价核酸疫苗免疫后鸡的细胞免疫与体液免疫水平。(1)M TT法检测 T淋巴细胞活性:将肝素抗凝血用不含钙、镁的 Hank′s液1∶1稀释后,沿管壁缓慢加入贮有4 m L淋巴细胞分离液的试管中,以3000 r/min离心30 min后,吸取淋巴细胞层转10 mL离心管中,再加入5倍体积不含钙、镁的Hank′s液洗涤。洗涤2次后对淋巴细胞进行计数,并用RPMI 1640培养基稀释淋巴细胞至1×107个/m L备用。在96孔培养板第1排各孔中分别加50μL培养基做对照,从第2排开始各孔加入10μL ConA溶液、100μL待测淋巴细胞悬液,混匀。每个样品做3个重复。将培养板置CO2培养箱,37℃培养66 h。随后加样孔每孔吸弃70 μL上清液,加入0.5%MT T溶液 10μL,混匀后继续培养4 h,每孔再加入100μL DMSO、振荡5 min后,用酶标仪测定各孔的OD570值。(2)间接ELISA检测血清抗体水平:具体步骤如下:按常规方法分离血清。以纯化复性的pGEX-6p-1-gam82-Y抗原[3]包被 ELISA板4℃过夜→洗板,用100μL含1%小牛血清白蛋白的封闭液封闭,37℃温育2 h→加入 100μL稀释后的待检血清 37℃温育2 h→洗板,加入HRP标记的羊抗鸡IgG(37℃温育2 h)→洗板加入新配底物缓冲液(OPD-H2 O2),37℃温育 15 min→显色后加入 50μL终止液(2 mol/L H2 SO4)→酶标仪测定OD490值。
2 结果
2.1 PCR扩增结果 以含E.maxima NT株配子体基因gam82完整ORF片段的质粒pGEM-T-gam82 DN A为模板,采用设计的 1对引物,对gam82基因编码区进行了扩增,大小与预计相符(图1)。
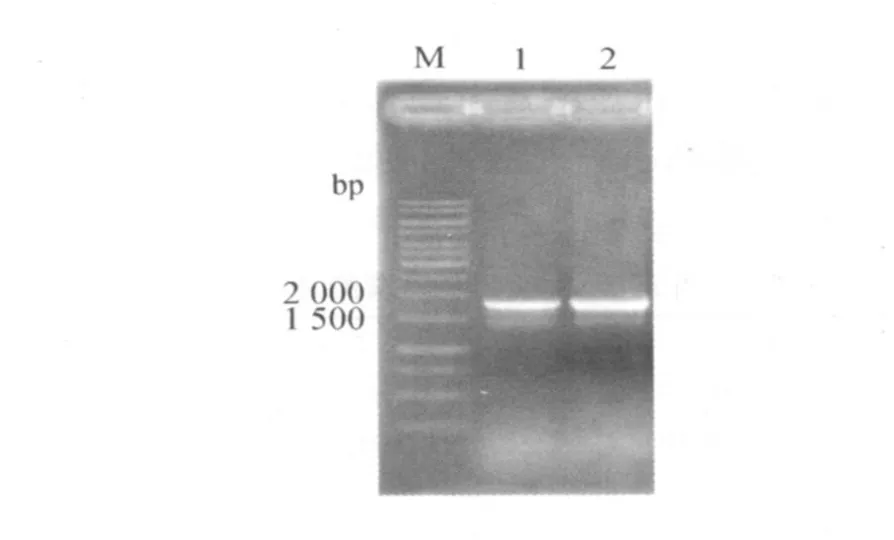
图1 PCR产物
2.2 重组表达质粒的构建结果 将PCR产物与pcDNA3.1质粒分别用Eco RⅠ和 Hin dⅢ双酶切,回收后按常规连接,转化宿主菌DH5α,通过Ampicillin抗性和双酶切筛选到阳性重组质粒,命名为pcDNA-gam82。pcDNA-gam82用Eco RⅠ和 Hin dⅢ双酶切,出现一条约5.4 kb的载体片段和一条1800 bp左右的目的片段,大小与预计相符(图2)。
2.3 T淋巴细胞活性 各试验组鸡的T淋巴细胞增殖水平及变化见表1。在试验前各组鸡的T淋巴细胞增殖水平相近。免疫后第1周,pcDNA-gam82组的T淋巴细胞增殖水平较未免疫组对照组和空质粒组的要高,相比差异显著,但增殖水平与卵囊免疫组相比要低,两者间有显著差异。2次免疫后1周的T淋巴细胞增殖水平在各组间的比较情况与第1周的相似。

图2 重组表达质粒的酶切鉴定结果
2.4 血清抗体水平 间接ELISA法测定的各试验组鸡的抗体水平见表2。在试验前各组鸡的抗体水平相近。免疫后第1周,pcDNA-gam82组的抗体水平较未免疫组对照组和空质粒组的要高,相比差异显著,与卵囊免疫组相比要低,但两者间差异不显著。在免疫后第2周,卵囊免疫组抗体水平升到最高,与pcDNA3.1-gam82组有显著差异,尽管后者的抗体水平仍然比未免疫组对照组和空质粒组的要高。这与Lillehoj[4]发现球虫刺激血清中IgG产生的抗体通常可在免疫后一周内检测到,并在第8~14天达到最高水平并能抵抗更多球虫感染的结论相一致。

表1 各试验组鸡T淋巴细胞活性(OD570)

表2 免疫对抗体水平的影响(OD490)
3 小结与讨论
巨型艾美耳球虫配子体主要抗原基因gam82进行体外克隆表达方面的研究报道很少,其原因可能是该基因序列较长,且所含大肠杆菌稀有密码子甚至是串联稀有密码子较多,用经济性最好的原核表达较困难。Belli[4]用原核表达载体进行全长基因表达,但表达量极低,甚至在SDS-PAGE电泳后不能用考马斯亮蓝染色检测到目的条带。作者也多次试图用原核表达载体对该基因进行全长表达,但未能成功[3]。本试验以已构建的重组质粒pGEM-T-gam82为模板,以pcDNA3.1为真核表达载体,成功构建了gam82基因的真核表达质粒,免疫鸡后能诱发特异性的体液免疫与细胞免疫,但免疫水平较活卵囊免疫要差。从免疫水平的变化来看,首免一周后体液免疫与细胞免疫水平就显著升高,二免后进一步升高。这与Lillehoj[5]发现球虫刺激血清中IgG产生的抗体通常可在免疫后一周内检测到,并在第8到14天达到最高水平并能抵抗更多球虫感染的结论相一致。
有关DNA疫苗构建后表达情况的检测,传统的方法是转染哺乳动物细胞,然后用多种方法检测表达情况[6]。本试验通过检测pcDNA-gam82重组质粒注射鸡体后的细胞免疫水平和体液免疫水平变化,与非免疫组及注射空质粒组对照,来直接检测所构建疫苗在靶动物中是否具有良好的免疫原性,这种方法能较好的反映疫苗在靶动物中所引起的免疫反应,有利于疫苗的进一步研究和开发。本试验显示免疫后鸡体内T淋巴细胞活性及抗体水平与非免疫组相比能有显著提高,这为后续的核酸疫苗的动物免疫保护试验提供了可靠依据。
[1]Sharman P A,Smith N C,Wallach M G,et a l.Chasing the golden egg:vaccination against poultry coccidiosis[J].Parasite Immun ol,2010,32(8):590-598.
[2]Ciernik I F,Berzofsky J A,Carbone D P.Induction of cytotoxic T lym phocytes and antitum or immu nity with DNA vaccines exp ressing single T cell epitopes[J].Immu nol,1996,156(7):2369-2375.
[3]彭昊,陶建平,许金俊,等.巨型艾美球虫配子体gam82基因的克隆表达与免疫原性分析[J].中国兽医学报,2010,30(9):1203-1207.
[4]BelliS I,Mai K,Sk ene C D,eta l.Characterisation of the antigenic and immunogenic properties of bacterially expressed,sexual stage antigen s of the coccidian parasite,Eimeria m axima[J].Vaccine,2004,22(31):4316-4325.
[5]Lillehoj H S,Ru ff M D.Comparison of disease suscep tibility and su bclass-specific antibody response in SC and FP chick ens ex perimentally in oculated w ith E.tenella,E.acervulina,or E.maxima[J].Avian dis,1987,31(1):112-119.
[6]Moreno S,Lopez-Fuertes L,Vila-Coro A,eta l.DNA immunization w ith minimalist expression con structs[J].Vaccine,2004,22:1709-1716.

