三种猕猴桃多酚粗提物的抗癌、抗辐射活性
左丽丽,王振宇,2*,樊梓鸾,田双起
(1.哈尔滨工业大学 食品科学与工程学院,化学工程与技术,哈尔滨 150090;2.东北林业大学 林学院,哈尔滨 150040)
随着人们生活节奏的加快和膳食结构的提高,受到电离辐射、紫外线、食品农药残留等外界环境的影响越来越严重,由此产生了一系列的疾病,例如心脏病、癌症、心脑血管疾病、炎症、糖尿病、组织器官老化等等,现代医学研究证明,这些疾病的发生都与过剩的活性氧自由基有关[1]。又据世界卫生组织统计,全世界现有760万人死于癌症,1500万人死于心脑血管疾病,预计到2020年,死亡人数将较现在增加50%左右。可见,人类的健康面临很大的威胁。许多研究发现,多酚类化合物能够清除60%以上的自由基。植物多酚是多羟基类化合物的总称,广泛存在于植物体内,主要存在于植物的根、茎、叶、果实、表皮中,在自然界储量非常丰富[2]。
水果、蔬菜和茶中含有各种各样的抗氧化剂,包括多酚类化合物和维生素,多酚类化合物例如花色苷、黄酮、黄烷醇以及单宁酸等等。研究较多的多酚有茶多酚、苹果多酚、葡萄多酚、芒果多酚、石榴多酚等,都表明它们有很强的抗氧化以及预防各种疾病的能力。研究显示,植物多酚具有很强的抗氧化作用,以及明显的抑菌、抗癌、抗老化和抑制胆固醇上升等功效,摄取一定量的植物多酚能够有效的预防和抑制疾病的发生。因此,植物多酚是自由基清除剂因此,在日本有人将植物多酚称之为继第六营养素膳食纤维之后的“第七类营养素”。
野生猕猴桃是中国特有的植物品种,广泛分布于中国东北大兴安岭地区,对它们的研究报道很少,以前的研究显示了中华猕猴桃的抗氧化活性,从野生猕猴桃中提取多酚等抗氧化成分,对其成分及其抗氧化功能进行分析,可以很好的评价其品质,揭示野生猕猴桃资源的要要哪个价值及抗氧化机理,为进一步开发功能性食品提供理论依据。
1 材料与方法
1.1 实验材料
狗枣猕猴桃、软枣猕猴桃采自大兴安岭地区,中华猕猴桃购于当地超市。
1.2 实验仪器
电子天平;榨汁机,超声波;离心机;旋转蒸发仪;紫外分光光度计,显微镜;酶标仪;X射线仪。所用的试剂均为分析纯。
1.3 实验方法
1.3.1 猕猴桃多酚的提取。分别称取狗枣猕猴桃(Actinidia kolomikta)、软枣猕猴桃(Actinidia arguta)、中华猕猴桃(Actinidia chinensis)各200g,用60%的乙醇按照1∶5的料液比,40℃,超声30min提取多酚[3],重复提取3次,将3次提取液合并,50℃浓缩,分别浓缩至50mL,分装后并于-20℃保存备用。
1.3.2 猕猴桃多酚含量的测定。猕猴桃多酚含量是使用Folin-Ciocalteu方法经过一些修改进行测定。用10mL蒸馏水溶解0.5g没食子酸,定容至100mL,再将其稀释50倍,得0.1mg/mL的没食子酸溶液。从中吸取此浓度没食子酸0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mL于10mL比色管中,加入蒸馏水定容到2mL,摇匀后加入1.0mL福林酚试剂,4min后加入1.0mL10%的NaCO3溶液,25℃水浴2h,测定溶液在765nm处的吸光度,并做3组平行试验[4]。
1.3.3 总还原能力的测定。采用普鲁士蓝法,在10mL试管中加入不同浓度样品1mL,0.6mL磷酸盐缓冲液(0.2mol/L,pH=6.6),和1.5mL 1%铁氰化钾,置于50度恒温水浴中反应20min。流水冷却至室温。加入3mL 10%冰乙酸,放置10min,取反应液3mL,加入5mL蒸馏水和0.2mL 1%FeCl溶液,混合均匀。5min后于波长为517nm分光光度计下测定其吸光度。吸光度越大表示还原能力越强,以蒸馏水代替铁氰化钾溶液同时做本底[5]。
1.3.4 细胞的培养。将复苏的 HT-29、HepG2细胞株置于含10%胎牛血清的1640、DMEM完全培养液中,37℃,5%CO2培养箱、饱和湿度条件下传代培养。
1.3.5 细胞增殖抑制试验。试验设为对照组、试验组。试验组、对照组分别以细胞浓度1×104/mL将两种癌细胞接种于96孔培养板,每孔100μL。待细胞贴壁后加药,使药物的终浓度分别为0、8、16、24、32、40mg/mL;对照组加入等体积的PBS溶液,每组设置6个平行。分别孵育24、48、72h后,每孔加入5mg/mL MTT溶液10μL,37℃孵育4h,弃上清,加入150μL DMSO后振荡摇匀,置酶标仪上测量波长490nm,参考波长655nm测OD值[6]。按照公式计算抑制率:
细胞抑制率(%)=(对照组OD值-试验组OD值)/对照组OD值×100
1.3.6 抗辐射能力测定。辐射模型的建立:用HepG2作为模型,模拟正常细胞进行辐射研究。选取生长状态良好的HepG2细胞,制成细胞悬浮液,按照每孔100μL的量将待检测细胞接种于96孔板,每孔细胞覆盖率约为孔面积的80%,于37℃,5%CO2条件下的培养箱中贴壁培养12h。待细胞全部贴壁,用X射线分别照射30、60、90、120min,辐照后立即放入37℃,5%CO2条件下培养箱中继续培养24h。培养结束后每孔加入10μL MTT溶液,于37℃孵育4h,终止培养。小心吸弃孔内溶液,每孔加入150μL DMSO,摇床震荡15min使结晶物充分溶解,酶标仪参考波长570nm,测定波长490nm下测定各孔吸光度值A,计算各组相对于辐射对照组的细胞损伤。结果显示照射30min后细胞的致死率达到50%左右,选取辐照30min作为辐射模型。
修复组:选取生长状态良好的HepG2,Huvel细胞,制成细胞悬浮液,按照每孔100μL的量将待检测细胞接种于96孔板,每孔细胞覆盖率约为孔面积的80%,于37℃,5%CO2条件下的培养箱中贴壁培养12h。待细胞全部贴壁,用X射线照射30min,辐照后立即放入37℃,5%CO2条件下培养箱中继续培养2h,每组6个平行孔。向每孔中加入等体积不同终浓度的猕猴桃粗提物,继续培养24h。培养结束后每孔加入10μL MTT溶液,于37℃孵育4h,终止培养。小心吸弃孔内溶液,每孔加入150μL DMSO,摇床震荡15min使结晶物充分溶解,酶标仪参考波长570nm,测定波长490nm下测定各孔吸光度值A,计算各组相对于辐射对照组的细胞损伤[7]。
防护组:是在同样条件下,待细胞体壁后加入不同浓度的猕猴桃粗提物,再用X射线照射,之后同于修复组。
2 结果与分析
2.1 猕猴桃多酚含量
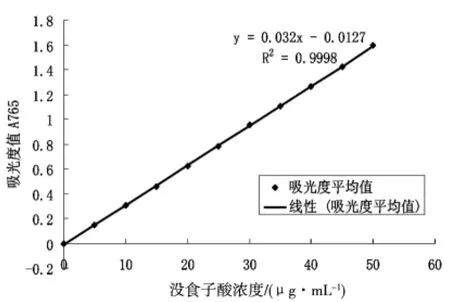
图1 没食子酸标准曲线
将狗枣、软枣、中华猕猴桃提取液稀释合适的浓度,吸取1mL于10mL比色管中,按上述标准曲线测定方法,在765nm波长下测定其吸光度。
没食子酸标准曲线见图1,猕猴桃多酚含量分别为:狗枣猕猴桃中多酚含量为430.0313mg/100g鲜果,软枣猕猴桃中多酚含量为362.1771mg/100g鲜果,中华猕猴桃中多酚含量为115.7609mg/100g鲜果。狗枣猕猴桃>软枣猕猴桃>中华猕猴桃。
2.2 总还原力的测定
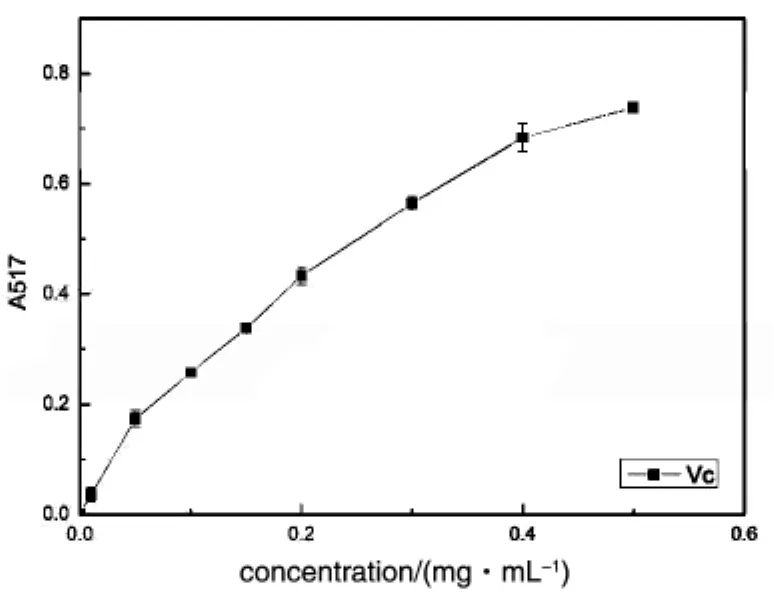
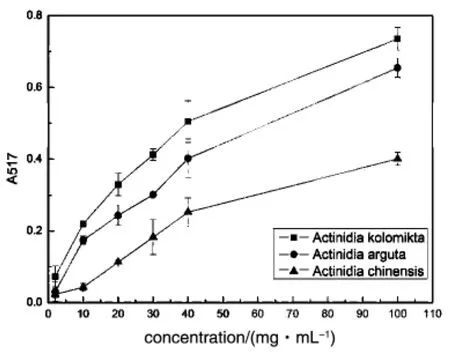
图2 三种猕猴桃和VC总还原能力的测定
通过总还原力的测定,可以检测样品是否为良好的电子供体。还原力强的物质可以提供更多的电子,其供应的电子除了可以使Fe3+还原为Fe2+外,也可以参与自由基反应,使自由基形成稳定的物质。以Vc为对照,测定了三种猕猴桃提取物的总还原能力(图2)。总还原力随猕猴桃粗提物浓度的增加而升高,且在相同的浓度下,狗枣猕猴桃的总还原力最强,其次是软枣猕猴桃,最后是中华猕猴桃。
2.3 抗癌能力测定
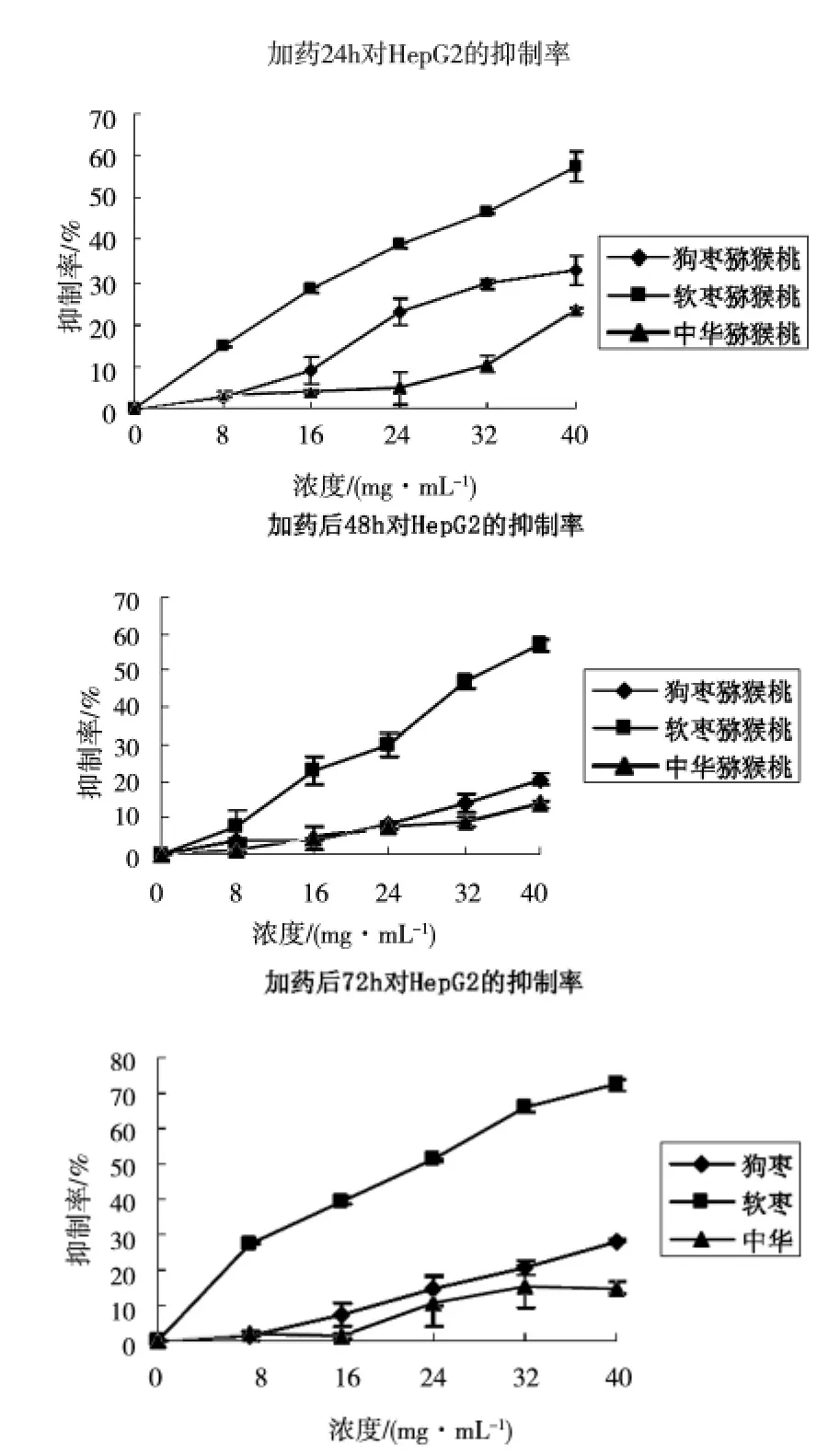
图3 加药24、48、72h对HepG2细胞的抑制率
使用MTT方法测定猕猴桃粗提物对肿瘤细胞增殖率的影响,测定结果如图3所示。由图可以看出,在不同的时间内软枣猕猴桃对HepG2具有很好的抑制作用。其次是软枣猕猴桃和中华猕猴桃。三种猕猴桃对HepG2的抑制效果呈明显的剂量依赖关系。这与猕猴桃粗提物中的多酚含量相关。同时以前的研究报道猕猴桃中富含硒类化合物,这是已知的抗癌类矿物质[8]。软枣猕猴桃具有比狗枣更高的抗癌活性,我们推测软枣猕猴桃比其他两种猕猴桃中富含更多的硒类化合物。因此,HepG2细胞更容易受到硒类化合物的攻击。
2.4 抗辐射能力的测定
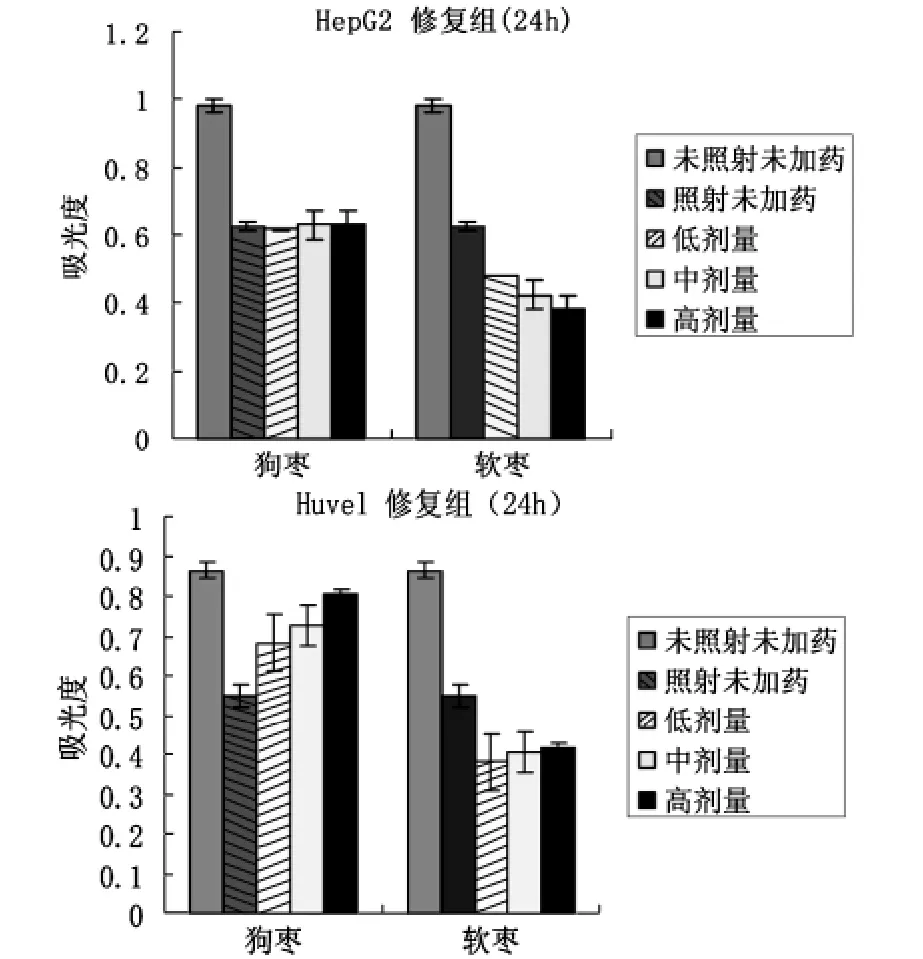
图4 狗枣、软枣对HepG2、Huvel细胞的修复作用
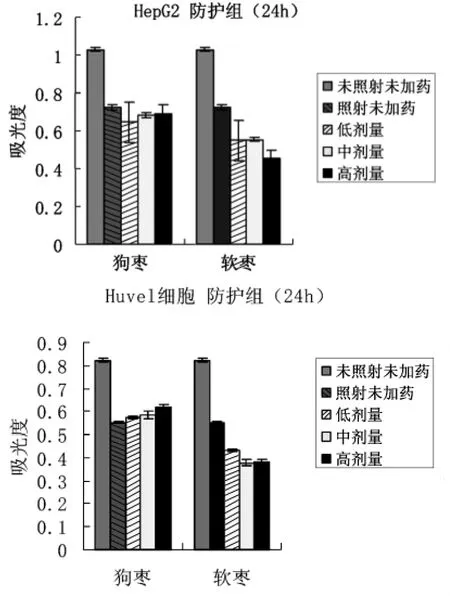
图5 狗枣、软枣对HepG2、Huvel细胞的防护作用
用HepG2模拟正常细胞,结果显示修复组和防护组中,X射线照射后,HepG2和Huvel细胞存活数明显降低,两组实验分别加药24h后狗枣猕猴桃对HepG2和Huvel细胞有很好的修复和防护作用,而软枣猕猴桃对HepG2和Huvel细胞没有起到有效的修复和防护作用。有实验报道酚类化合物具有很好的抗辐射作用。因此,狗枣猕猴桃良好的抗辐射作用与自身含有大量的多酚类化合物有关。
3 结论
众所周知,用于食品中的天然抗氧化剂比人工合成的抗氧化剂更安全、更有益于健康。我们的结果显示狗枣和软枣猕猴桃都有很好的还原能力,粗提物中,狗枣猕猴桃含有最高的多酚含量且具有最好的抗辐射能力。但是软枣猕猴桃有更好的抗癌能力,这可能是与以前报道的猕猴桃中富含硒类化合物有关,软枣猕猴桃可能含有更多的硒类化合物。它们的这些活性很多都归因于猕猴桃中存在的植物化学物质的相互作用。猕猴桃粗提物中还很有很多的活性成分,有待于进一步的研究开发,为开发功能性食品提供理论依据。
[1]Ismail,H.I.,Chan,K.W.,Mariod,A.A.,&Ismail,M..Phenolic content and antioxidant activity of cantaloupe(cucumis melo)methanolic extracts[J].Food Chemistry,2010:119,643-647.
[2]李进,李淑珍,冯文娟,等.黑果枸杞叶总黄酮的体外抗氧化活性研究[J].食品科学,2010:259-262(13).
[3]孙敏,岳田利,袁亚宏.猕猴桃果汁多酚类物质的提取工艺研究[J].农产品加工(学刊)2007:40-43.
[4]Suarez,B.,Alvarez,A.L.,Garcia,Y.D.,del Barrio,G.,Lobo,A.P.,&Parra,F..Phenolic profiles,antioxidant activity and in vitro antiviral properties of apple pomace[J].Food Chemistry,120(1),2010:339-342.
[5]周娟,吴宏,刘青,等.海带多糖的体外抗氧化活性研究[J].广东药学院学报,2090(4):397-400.
[6]王正,杨青松,刘露.大豆黄酮抗氧化及抗癌作用[J].生命的化学,2010(2):198-201.
[7]García-Pérez,M.-E.,Royer,M.,Duque-Fernandez,A.,Diouf,P.N.,Stevanovic,T.,&Pouliot,R..Antioxidant,toxicological and antiproliferative properties of Canadian polyphenolic extracts on normal and psoriatic keratinocytes[J].Journal of Ethnopharmacology,2010:132(1):251-258.
[8]Fan,Z.-L.,Wang,Z.-Y.,& Liu,J.-R.Cold-field fruit extracts exert different antioxidant and antiproliferative activities in vitro.Food Chemistry,In Press,Corrected Proof.

