2009年全国15省市药品检验所可见异物检查情况及结果分析Δ
丁锐,纪宏,庞青云,陈思,余立(北京市药品检验所,北京市100035)
可见异物是指存在于注射剂(注射剂可分为注射液、注射用无菌粉末、注射用浓溶液)、滴眼剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50 μm[1]。依据国家食品药品监督管理局文件(国食药监注[2005]373号,《关于印发<可见异物检查法补充规定>的通知》),于2005年10月1日起,增加了对供注射用无菌原料药中可见异物的检测。可见异物可能是外来的污染物,如金属屑、玻璃屑等,也可能是内源性物质,如产品在放置期间析出的沉淀物等。注射剂中的可见异物如进入血管,可造成微循环障碍,引起血管炎、血栓、变态反应,血液中的纤维蛋白附着在可见异物上会形成血栓,流经心脑血管时,对人体健康造成严重危害[2];滴眼剂中可见异物进入眼睛可造成眼部损伤。因此,可见异物的检查是评价注射类药品和滴眼剂安全性的重要指标。
在国家药典委员会的领导与统筹安排下(国家药典委员会国药典化发[2008]28号),我所收集了全国有代表性的15省市药品检验所2009年对辖区内药品可见异物的检查结果,对其进行了结果汇总及分析,为查找可见异物产生的原因以及完善2005年版《中国药典》附录可见异物检查项的内容提供了依据。
1 资料与方法
1.1 资料来源
本文资料来源于全国15省市药品检验所(按拼音字母排序:北京市药品检验所、福建省药品检验所、广东省药品检验所、广西壮族自治区食品药品检验所、贵州省药品检验所、河北省药品检验所、湖南省药品检验所、海南省药品检验所、江苏省食品药品检验所、辽宁省食品药品检验所、内蒙古自治区食品药品检验所、山西省药品检验所、陕西省食品药品检验所、天津市药品检验所、浙江省食品药品检验所)2009年对辖区内药品生产企业生产的药品检验过程中的可见异物检查结果。
1.2 方法
采用Excel软件对所有数据从药物类别、剂型、可见异物原因等方面进行分类汇总。
2 结果与分析
2.1 按药品类别对可见异物考察结果进行统计
按药品类别对可见异物考察结果进行统计,结果见表1。

表1 按类别统计的可见异物考察结果Tab 1 The findings of visible particles inspection by different drug categories
由表1可见,全国15个省市药品检验所共对108个品种、377批药品进行了可见异物的考察,其中合格批数为309批,不合格批数为68批,合格率为82.0%。
2.2 按药品剂型对可见异物考察结果进行统计
按药品剂型对可见异物考察结果进行统计,结果见表2。
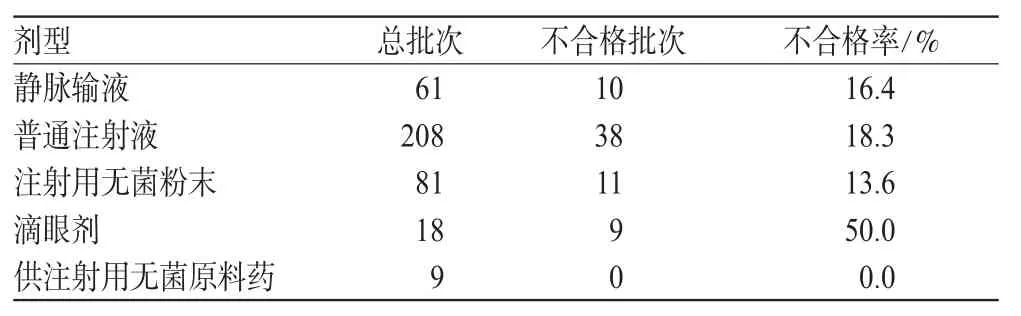
表2 按剂型统计的可见异物考察结果Tab 2 The findings of visible particles inspection by different drug dosage forms
由表2可见,此次汇总的数据中供注射用无菌原料药的合格率最高,达到100.0%。制剂的不合格率普遍偏高,平均不合格率达到24.6%(即除原料药外各制剂不合格率的平均值),其中滴眼剂的不合格率最高,达到50.0%。此次考察的滴眼剂中没有生化和中药品种,注射用无菌粉末数据中没有中药品种。另外,供注射用无菌原料药可见异物的考察结果仅由1家药品检验所提供。
2.3 可见异物不合格原因统计
对可见异物不合格原因进行统计,结果见表3。

表3 可见异物不合格原因统计Tab 3 Unqualified causes table of visible particles
由表3可见,在所有可见异物不合格药品中,纤维的存在是共性的问题,玻璃屑也是引起不合格的主要原因。静脉输液中可见异物主要是色点,普通注射液中可见异物多为玻璃屑,注射用无菌粉末及滴眼剂中主要是纤维。
3 讨论
3.1 现行标准的合理性
参考377批药品考察结果,认为2005年版《中国药典》对注射剂可见异物检查的限度规定基本可行,约80%药品已经达到目前标准要求,但滴眼剂还应加大考察力度,进一步研究限度的合理性。
3.2 关于注射用无菌原料药
供注射用无菌原料药是生产各种剂型注射类药物和滴眼剂的基础,只有优质的供注射用无菌原料药才能生产出优质的成品。此次考察的9批次供注射用无菌原料药可见异物检查结果良好,但仅有1个药检所提供的数据,因此代表性有相当的局限性。从日常检查结果来看,供注射用无菌原料药还未达到如此理想的水平,此结果也提示各实验室之间目视检查的掌控尺度可能有一定差异。
3.3 不合格现象以外源性可见异物存在为主
生产环境是否达到合格的洁净程度,厂房结构布局是否合理,建筑材料选用是否合理,是否易产生脱落物、残留物,洁净区和控制区等重点部位的管路是否密封等因素均是否会引入外源性可见异物的因素。这需要生产企业严格按照国家《药品生产质量管理规范》(GMP)要求进行管理,日常注重各项指标的检测,例如沉降物、尘埃粒子等,发现问题及时处理。另一方面,人是生产过程中活动的主体,在整个生产过程中,所有参与此过程并与此过程相关的人员如不按照GMP的相关要求进行操作,不注意避免因毛发脱落、裸露部位生物代谢物的脱落、材质不佳的服装杂质的脱落等,也会引入外源性可见异物。
生产过程中包装容器的清洁、洗涤剂的选用、配料、过滤、灌装、上塞、封口等环节的各项物理指标,均应认真对待,例如:注射用冻干灭菌粉末的料液输送系统一般为一个密闭系统,配制好的料液经过板框压滤机滤纸和微孔滤器过滤,如滤纸或微孔滤器安装不正确,滤纸和微孔滤器可出现击穿现象,将引入可见异物。对此原因,一般可以通过灌装前的料样检查发现,同时微孔滤器使用前的气泡点试验是确保微孔滤器完整性的有效手段,也是对冻干粉末杜绝可见异物和无菌保障的有效措施。上塞、封口环节机器施加力度是否合适(如力度过大可能导致瓶口破损,造成玻璃屑脱落),选用的灌装瓶各项物理指标是否均一等都是应该缜密考察的因素。
在整个生产过程中生产设备内部的清洁程度,生产系统不锈钢材质的优劣,硅胶管等部位材质的优劣,在密封接缝处有无老化锈蚀等因素也有可能影响成品中引入黑点、白点、色点或其他类型的可见异物[3]。
药品包装材料如玻璃瓶(西林瓶)、胶塞、滴眼剂的外包装,由于其清洁、灭菌、灌装等工艺不当也可引入可见异物。西林瓶经超声波洗瓶机清洗后,进入高温隧道烘箱灭菌、冷却,质量不过关的西林瓶容易破损,甚至发生冷爆,溅出玻璃屑。此外,在操作过程中应严格按照升温程序和降温程序进行规范化操作,避免骤热骤冷,这样对西林瓶及设备都是一种保护,也可最大程度地避免可见异物的引入。西林瓶的清洗与灭菌过程中,超声波的大小、水压、压缩空气压力等物理参数,也应针对西林瓶的瓶壁薄厚、大小等作相应调节,并应注意防范因水质较差或经压缩空气和送风管路引入可见异物。及时更换过滤装置中的滤芯,用尘埃粒子计数器对高效空气过滤器进行检测,发现问题及时解决,均是预防成品中引入可见异物的有效措施[4]。
3.4 内源性可见异物也产生在一些药品中
包装材料与内容物化学性质不匹配是引发内源性可见异物产生的原因之一。比如碳酸氢钠注射液对一般玻璃容器会产生腐蚀现象,放置一段时间即会有白点或小玻屑产生。目前,丁基胶塞、西林瓶、无毒橡胶或塑料等多种包装材料可供注射剂、滴眼剂选择使用,但研发单位有时研究考察不到位,对使用的包材是否能满足制剂品种的稳定性要求,在生产过程中,特别是在长达几年的效期内是否与药品发生理化反应尚不确定,而一旦发生某些理化反应则有可能引入可见异物,在长期的缓慢的理化反应下所产生的副产物对用药者健康也有可能带来危害。
此外,药品自身不稳定以及不当的溶媒与配伍是引发内源性可见异物产生的另一原因。抗生素、复方中药、多组分生化药等均有该风险存在。如氟罗沙星,加入0.9%氯化钠注射液(NS)250 mL中,会立即产生大量白色絮状沉淀[5];金银花提取液中的绿原酸能与黄连、黄柏提取液中的生物碱反应,生成不溶性化合物[6],因此,含这些成分的溶液配伍后易引入可见异物。中药注射剂的原料绝大多数是植物药材,其有效成分因产地、季节、部位、加工工艺的不同而差异较大,加之中药成分的复杂性,给不同中药之间的配伍带来了结果的多样性。在用药安全性和有效性方面,这是一个需要长期跟踪和研究的课题。对于中药制剂而言,在碱性较强时,生物碱等容易析出,在酸性较强时,部分苷类也可沉淀[7],故在配伍中药制剂时,若2种制剂溶液pH值相差较大,特别是酸性药液和碱性药液进行配伍时,应特别注意考察可见异物的出现[8,9]。输液过程中,不同化学药之间的配伍同样存在此类问题,在用药过程中也需要我们加以注意。
药用辅料的选择及理化环境不合理也能产生内源性可见异物。如在双嘧达莫注射液生产中,如果单用酒石酸来调节pH值,不但酒石酸的用量大,而且个别成品中有白点出现,使可见异物指标不合格;如果先用一部分酒石酸,再用一部分盐酸来调节pH值,则可减少酒石酸的用量,成品中可见异物的检查也合格[10]。生化药品和生物制剂特别是含有活性蛋白的药物受等电点的影响较大,因在其相应的等电点下,蛋白等物质会沉淀析出,所以适宜pH值环境的考察与选取也应当引起我们的注意。
综上所述,对于可见异物的检查,不仅要看到有多少异物存在于药品之中这样表面的结果,更应思考深层次的原因,减少药品中可见异物的存在一定要从合理配伍、选择适宜容器、提高原料药质量及改进工艺等入手。
[1] 国家药典委员会编.中华人民共和国药典(二部)[S].2005年版.北京:化学工业出版社,2005:附录6、66.
[2] 张长海.小容量注射液可见异物影响因素分析[J].首都医药,2010,17(12):72.
[3] 夏占强,方国芳.配制系统对生物制品注射液中白点可见异物的影响研究[J].亚太传统医药,2009,5(9):31.
[4] 邢 军.可见异物检查法有关问题的探讨[J].中国药事,2008,22(6):472.
[5] 钟洪兰,郭粤霞,李 卫,等.注射剂合理应用的探讨[J].中国药房,2010,21(26):2 486.
[6] 薛彦朝,常美玲.中药注射剂的可见异物影响因素探讨[J].中华实用中西医杂志,2006,19(4):466.
[7] 陈 彤,侯世祥,甘献文,等.制备血塞通注射液的适宜pH范围的研究[J].中国医院药学杂志,2010,30(1):37.
[8] 张 娜,朱文涛,王桃柱,等.中药注射剂不良反应成因研究方法分析[J].中国药房,2010,21(19):1 820.
[9] 唐春燕,曾立威,林 昊,等.广西2009年双黄连注射液不良反应/不良事件报告分析[J].中国药房,2010,21(16):1 501.
[10] 李明军.注射剂生产中辅料的合理应用[J].中国药业,2007,16(2):24.

