赤眼鳟Myf5基因的克隆、序列和表达分析
严婷婷,邵 芳,王 野,卢祥云,顾志良
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
生肌调节因子(MRFs)基因家族的表达决定着肌细胞的命运,并控制其增殖和分化.它与肌纤维的数量、大小有着密切的关系,因而对肉质和风味有非常重要的作用.生肌调节因子MRFs基因家族编码4种不同的转录因子,分别为生肌决定因子MyoD、肌细胞生成素Myogenin(MyoG)、生肌因子5(Myf5)、生肌调节因子4(MRF4),它们是各自或协同调控骨骼肌生成的关键因子[1].
生肌因子Myf5是该家族中最早表达的基因,在成肌细胞的特化与增殖过程中发挥关键作用,Myf5基因敲除实验中小鼠轴上肌肉系统发育迟缓并死于肋骨缺陷症,说明Myf5基因起始调控了轴上肌肉的形成[2].此外,缺乏MyoD和Myf5的小鼠不能形成肌肉,没有肌肉标志(Marker)出现,在胚胎时期阻碍斑马鱼Myf5基因的表达,体节形成与肌肉发育过程均表现出异常[3],说明鱼类的Myf5基因与哺乳类有着相似的功能.生肌因子Myf5的研究对揭示鱼类肌肉生长发育调节因子功能具有重要意义.如今,Myf5基因已经在多种哺乳动物中被鉴定克隆出来,如小鼠、牛、猪、绵羊、鸡等,但在鱼类中研究较少,目前只在斑马鱼、条纹鲈、花鲈、褐牙鲆中克隆出基因组序列;在红鳍东方鲀、大西洋鲑、虹鳟、鲤、鲮和大口黑鲈中得到cDNA序列[4,5].
赤眼鳟(Squaliobarbus curriculus)属鲤形目,鲤科,雅罗鱼亚科,赤眼鳟属.头呈圆锥形,吻钝,口呈弧形.外形酷似草鱼,唯眼上半部具红色斑而得名.我国除青藏高原外,各大小江河及湖泊均产,国外见于朝鲜及越南.在天然水体中分布广,是野生名优淡水鱼品种之一,肉质细嫩,营养丰富,经济价值高,受消费者欢迎.目前对赤眼鳟的养殖技术研究广泛,但其基因水平的研究甚少,还没有赤眼鳟Myf5基因组全序列的报道.本实验采用RT-PCR方法,获得赤眼鳟Myf5基因部分序列,并检测不同组织中Myf5基因的表达情况.填补了赤眼鳟Myf5基因的研究空白,有助于进一步了解赤眼鳟Myf5基因表达与调控的分子机制.为今后赤眼鳟的资源保护、开发和养殖提供相应的理论依据.
1 材料与方法
1.1 实验动物及总RNA提取
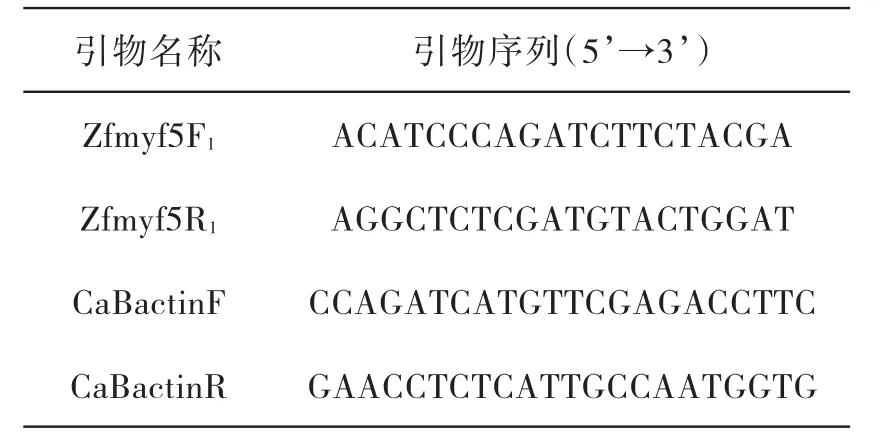
表1 本研究所用引物
赤眼鳟由苏州市长江水产繁育工程研究中心提供,活鱼宰杀后,采集其肌肉、肝脏、肠和脑等8种组织,液氮速冻后于-80℃冰箱中保存.采用Trizol(Invitrogen,USA)分别提取上述组织的总RNA,保存于-80℃冰箱备用.
1.2 引物的设计和合成
根据GenBank已公布的鲤科鱼类的Myf5序列设计引物扩增赤眼鳟的Myf5基因.引物由上海生工生物工程有限公司合成.(见表1).扩增赤眼鳟β-actin基因的引物为CaBactinF/caBactinR.
1.3 RT-PCR
反转录按TaKaRa反转录试剂盒(TaKaRa RNA PCR Kit Ver.3.0.)要求进行,反应体系为2μL MgCl2(25mmol/L),1μL 10×RT Buffer,1μL dNTP Mixture(各 10mmol/L),0.25μL RNase Inhibitor,0.5μL AMV Reverse Transcriptase,0.5μL Random 9 mers,1μg总RNA,加RNAseFree超纯水至总反应体积为10μL. 反应程序为:30℃ 10min;42℃ 30min;99℃ 5min;5℃ 5min.以合成的cDNA为模板和引物Zfmyf5F1/R1扩增赤眼鳟 Myf5基因 350bp片段,反应体系为 10×PCR buffer 2.5μL,10mmol/L dNTPs 2μL,10μmol/L引物Zfmyf5F1/R1各1μL,rTaq(5U/μL)0.2μL,1μL cDNA,ddH2O 17.3μL.PCR程序为:94℃ 5min;94℃ 30 sec,56℃ 30sec,72℃ 1min,共35个循环;72℃ 8min;4℃保温.PCR产物在1%琼脂糖凝胶中电泳,并回收克隆后测序.
1.4 不同组织mRNA表达的RT-PCR检测
RT-PCR方法检测不同组织mRNA的表达分布方法如下:反转录按TaKaRa反转录试剂盒(TaKaRa RNA PCR Kit Ver.3.0)要求进行(同上述1.3).RT-PCR时,赤眼鳟Myf5基因引物Zfmyf5F1/R1,两条引物分别位于不同的外显子上,以β-肌动蛋白基因(β-actin)为内标.PCR反应体系和条件:2.5μL 10×LA PCR Buffer(with Mg2+),2μL dNTP(2.5mmol/L each),上、下游引物各 1μL(10pmol/L),0.5μL cDNA,0.2μL LA Taq聚合酶(5U/μL)(Takara,大连),加灭菌ddH2O至25μL.PCR扩增条件:95℃变性5 min;95℃ 30s,58℃30s,72℃ 30s,25个循环(β-actin基因)或35个循环(myf5基因);72℃延伸10min;4℃保存.
1.5 统计分析及软件
将获得的序列在DNAMAN 5.0软件上进行分析,并进行物种间同源性比较.利用MEGA 4.1软件中的Kimura 2-parameter法计算净遗传距离矩阵.以距离矩阵邻接法(Neighbor-Joining,NJ)建系统发生树,通过自引导检验(bootstrap)获得系统分支的置信度(重复次数为1000).
2 结果与分析
2.1 赤眼鳟Myf5基因RT-PCR扩增鉴定
以赤眼鳟肌肉总RNA为模板,反转录后得到cDNA,用引物Zfmyf5F1/R1进行PCR扩增.通过1%的琼脂糖凝胶电泳对扩增产物进行鉴定(见图1).大约350bp处有一条带,与实验预想结果接近.
2.2 赤眼鳟Myf5基因阳性筛选
将目的基因产物从胶块中切下回收后连接到pMD-18T载体中,转化DH5αE.CoLi感受态细胞后,在 LB(Ampr)平板上过夜培养.挑取白色单菌落于LB(Ampr)液体培养基中培养后做菌液PCR检测(见图2),将阳性克隆测序后获得赤眼鳟的Myf5基因部分序列.
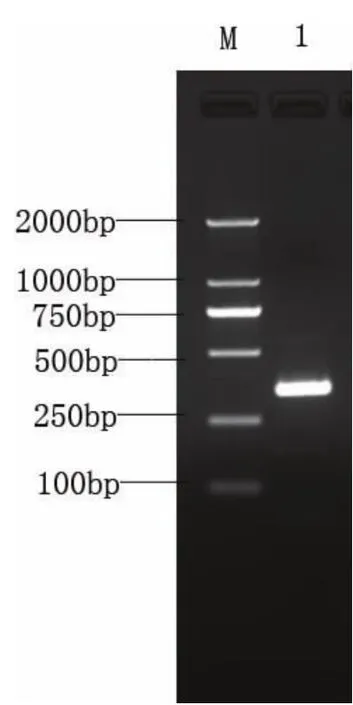
图1 赤眼鳟Myf5基因片段的RT-PCR产物的1%琼脂糖凝胶电泳图
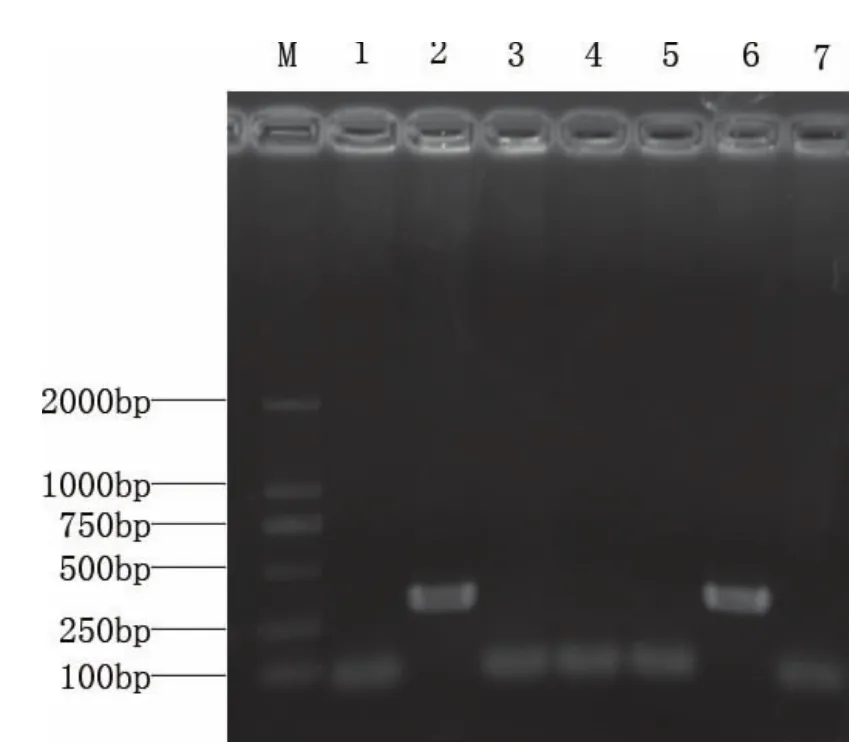
图2 赤眼鳟Myf5基因阳性克隆筛选
2.3 赤眼鳟Myf5基因cDNA和氨基酸序列分析
对所得到的赤眼鳟Myf5部分序列进行分析,共编码112个氨基酸(见图3).该段部分bHLH的碱性区及绞链区具有3个保守的氨基酸:丙氨酸Ala(A)、苏氨酸Thr(T)和赖氨酸Lys(K),它们在蛋白质间的识别及构像形成上具有重要的作用.
利用MAGE 4.0软件将赤眼鳟、斑马鱼、草鱼、大马哈鱼、地中海鳎、红点鲑、红鳍东方鲀、三文鱼和石斑鱼9个物种的Myf5部分基因序列进行比对(见表2).经过对比可发现,赤眼鳟的Myf5与红点鲑同源性最低,与草鱼同源性最高,为97.34%.
2.4 基于赤眼鳟Myf5部分cDNA序列的系统进化树的构建
利用Mega 4.0软件将赤眼鳟、斑马鱼、草鱼、大马哈鱼、地中海鳎、红点鲑、红鳍东方鲀、三文鱼和石斑鱼9个物种Myf5部分基因序列构建系统进化树(见图4).所构建的进化树分为两大支类.红点鲑为单独一支,另一支由斑马鱼、草鱼、大马哈鱼、地中海鳎、赤眼鳟、红鳍东方鲀、三文鱼和石斑鱼7种鱼类组成,其中赤眼鳟与草鱼的同源性最高.结果表明鲤科鱼类Myf5基因的高度保守型,同时也显示了鲤鲑科鱼类Myf5基因的差异性.
2.5 赤眼鳟Myf5基因的组织表达分析

图3 赤眼鳟Myf5基因部分序列及推测的氨基酸序列
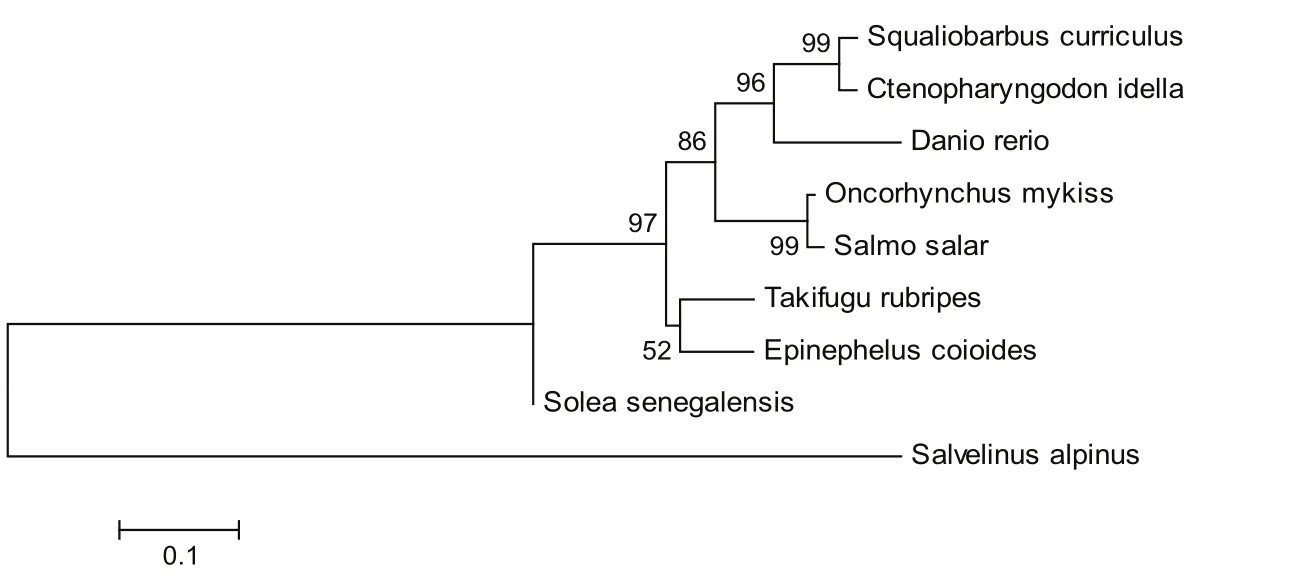
图4 邻接法构建系统进化树(数字表示bootstrap值)
采用半定量RT-PCR方法,检测了Myf5基因mRNA在赤眼鳟肝、脾、肌、肾、心、鳃、脑、肠8种组织中的表达情况,同时以β-肌动蛋白基因的表达作为内参照.通过PCR条件优化,分别选择β-actin基因和Myf5基因在扩增进入平台期前的循环数为25次和35次.电泳结果显示(见图5),分别在 450bp、350bp获得 Myf5和β-actin基因的部分特异性片段,与预期设计的试验结果相符,发现在除脾脏外各种组织中都检测到Myf5基因的表达,在心肾中表达量较高,肌肉和鳃中表达量次之,肝、脑和肠中表达量较弱.
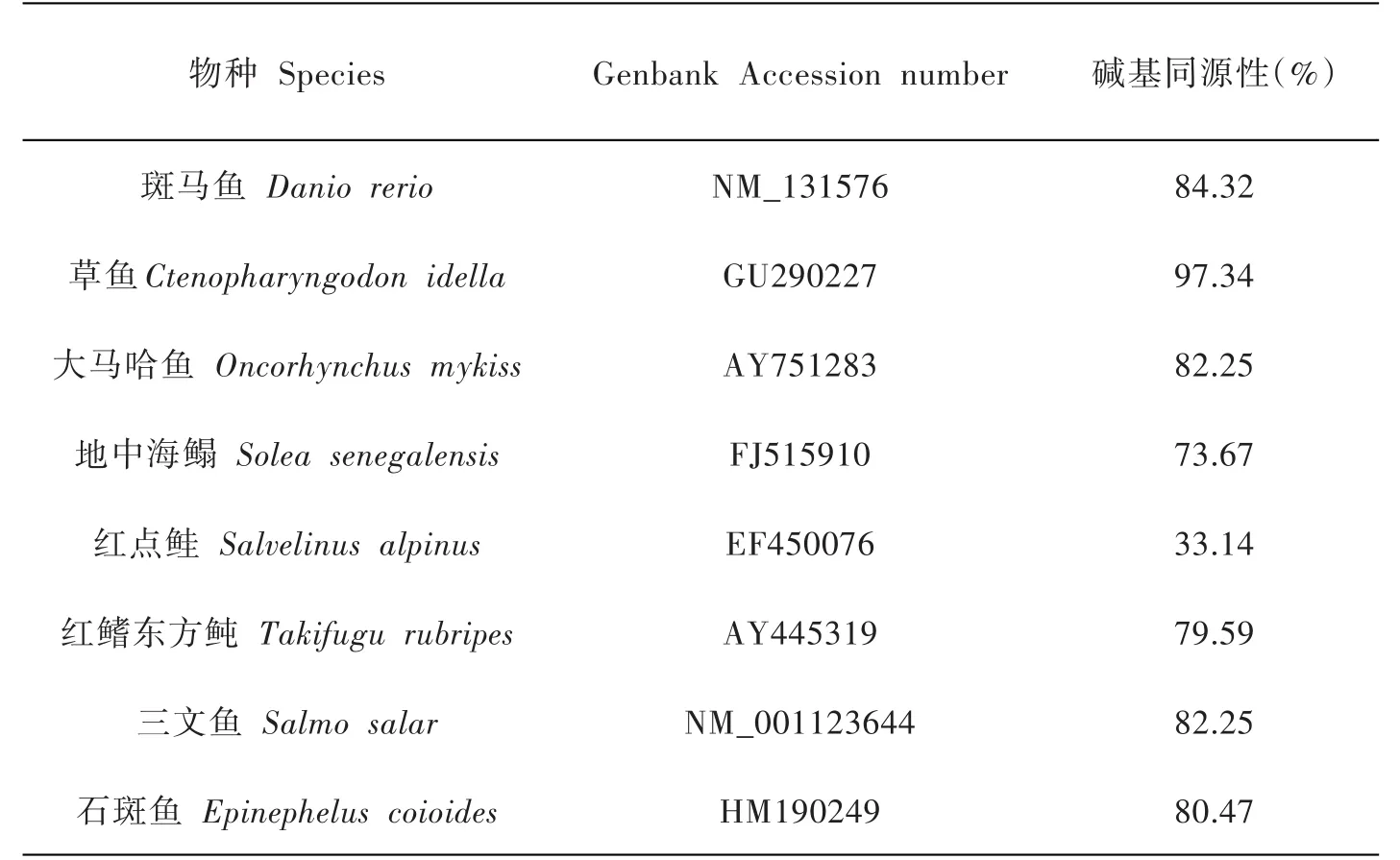
表2 赤眼鳟与其他鱼类Myf5部分基因编码区的核苷酸同源性比较
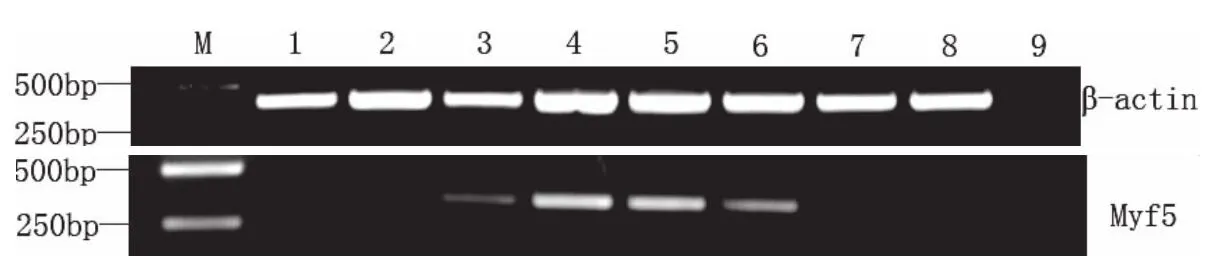
图5 赤眼鳟Myf5基因表达的半定量RT-PCR检测
3 讨 论
本研究首次克隆并测出赤眼鳟Myf5基因cDNA部分序列,共338bp,编码112个氨基酸.将该序列与其他鱼类的Myf5基因进行同源性比较.结果发现赤眼鳟与鲤科鱼的同源性较高,其中与草鱼的同源性最高,达到97.34%,与红点鲑的同源性最低,只有33.14%,与其他鱼类同源性在73.67%-84.32%.
Myf5是MRF基因家族的一员,该家族的共同结构特点是具有1个保守的中央蛋白基序(motif),其蛋白质二级结构都含有80个氨基酸左右,称为碱性螺旋一环一螺旋(bHLH),bHLH高度保守,其中Basic结构是HLH螺旋结构的延伸,通过该结构域它们能够与E蛋白形成二聚体,再与肌肉特异性基因如肌球蛋白轻链和肌酸激酶等基因的上游调控序列E-box结合,从而激活这些基因的表达[6,7].HLH螺旋结构则是与其他因子相互作用的位点,即调控的重要区域.在MRF分子结构中,bHLH本身可形成仅α-螺旋二聚体和四聚体,但只有二聚体可与DNA结合,且二聚体的4个螺旋必须以平行方向排列,每个区域单独存在均不能有效地激发生肌作用[8].
本实验对赤眼鳟Myf5基因mRNA进行组织表达的检测.发现在除脾脏外各种组织中都检测到Myf5基因的表达,在心脏和肾脏中表达量较高,肌肉和鳃中表达量次之,肝脏、脑和肠中表达量较弱.有报道,在海鲈(Lateolabrax japonicus)中Myf5主要在肌肉中表达,在脑、眼、脾、鳃、肝、肾、肠和心脏中也有表达.因此,Myf5基因的组织表达模式在不同的物种中不尽相同[9].
[1]Naoko Yoshida,Shosei Yoshida,Kyoko Koishi,et al.Cell heterogeneity upon myogenic differentiation:down-regulation of MyoD and Myf-5 generates reserve cells[J].Journal of Cell Science,1998,111(181):769-779.
[2]Braun T,Rudnicki M A,Arnold H H,et a1.Targeted inactivation of the mouse regulatory gene Myf5 results in abnormal distal rib development and early postnatal death in homozygous mouse mutants[J].Cell,1992,71(3):369-382.
[3]Chen Y H,Tsai H J.Treatment with Myf5-morpholino results in somite patterning and brain formation defects in zebrafish[J].Diferentiation,2002,70(8):447-456.
[4]郭玉函,白俊杰,劳海华,等.大口黑鲈Myf5基因cDNA和基因组序列的克隆与分析[J].中国水产科学,2008,15(4):568-575.
[5]钟茂春,郑光明,赵建,等.鲮Myf5基因克隆及其SNPs分析[J].中国水产科学,2010,17(4):681-687.
[6]孙文浩,朱庆.生肌决定因子Myf5基因的研究进展[J].黑龙江畜牧兽医,2008(7):28-31.
[7]苏艳红,王瑞元,周越.运动与生肌调节因子研究进展[J].中国运动医学杂志,2007,26(6):770-773.
[8]姜运良,李宁.肌肉生成的分子生物学研究进展[J].农业生物技术学报,1999,7(2):201-204.
[9]Ye H Q,Chen S L,Xu J Y.Molecular cloning and characterization of the Myf5 gene in sea perch(Lateolabrax japonicus)[J].Comp Biochem Physiol Part B,2007,147:452-459.

