抗青光眼药Tafluprost
青光眼是一种常见眼疾,目前尚无法治愈,但可通过早期的诊断和治疗,防止其进一步恶化甚至致盲。高眼压被认为是青光眼发病的主要风险因素之一,也是可经临床干预而缓解的少数症状之一,因此对青光眼的治疗通常都是从降低眼压着手,以防视神经损伤并维持视力。研究发现,局部使用前列腺素(PG)及其类似物可促进房水经葡萄膜巩膜外流,降低眼压。其中,乌诺前列酮异丙酯、拉坦前列素、比马前列素和曲伏前列素均已作为抗青光眼药物上市,且拉坦前列素被用作一线治疗药,但这些药物均会导致局部副作用,如结膜充血、眼部刺激和头痛,而由日本Santen制药公司合成的新型PG衍生物tafluprost(AFP-168)的主要降眼压作用机制也是促进房水经葡萄膜巩膜途径(即经虹膜根部)排出。临床研究显示,本品具强效降眼压作用,且局部副作用较轻微。
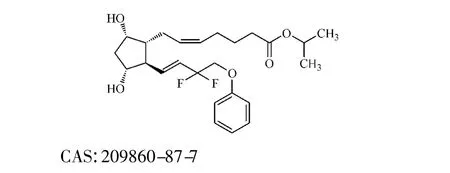
本品化学结构式:
药理作用 研究显示,羧酸型tafluprost(AFP-172)对 PGF 受体的亲和力(Ki=0.4 nmol·L-1)是羧酸型拉坦前列素的10倍,对大鼠离体虹膜括约肌收缩的 EC50为 0.5 nmol·L-1,且0.001% ~0.01%tafluprost滴眼液可较拉坦前列素更有效地诱导麻醉大鼠缩瞳。体内实验显示,与0.005%拉坦前列素滴眼液相比,0.0025%本品滴眼液用于眼压正常和高眼压猴子时所致眼压降低的峰值更大(3.1和11.8 vs 2.1 和9.5 mmHg,1 mmHg=133.322 Pa),且降眼压作用持续时间更长,达峰值时间相当(约8 h);而在眼压正常猴中,0.0005%本品虽与0.005%拉坦前列素滴眼液的降眼压效果相似,但作用持续时间更长。
药动学与代谢 研究者分别给食蟹猴使用单剂量[3H]-tafluprost滴眼液(剂量为每只眼1或10 μg),以考察本品的眼组织分布及其代谢特性。结果显示,本品可迅速被眼组织吸收,继而进入血液循环;给药后5 min,球结膜和睑结膜处的放射性浓度达最大值,血浆中放射性浓度达峰值,随后稳步下降;15 min时,角膜处的放射性浓度达峰值;房水和其他眼组织中的主要代谢物是 AFP-172、1,2-dinor-AFP-172 和1,2,3,4-tetranor-AFP-172,其中 AFP-172是眼组织中含量最高且唯一具药理活性的代谢物;睫状体、角膜和虹膜中可测到少量本品原型。
临床研究 在两项Ⅰ期临床试验中,49名非日本籍和27名日本籍健康志愿者分别随机使用0.0025%和0.005%本品滴眼液、0.005%拉坦前列素滴眼液或安慰剂,每日1次,每只眼1滴,持续7 d。结果,在非日籍男性受试者中,0.005%本品滴眼液组的眼压较0.005%拉坦前列素滴眼液和安慰剂组更低;在日籍男性受试者中,0.005%本品滴眼液能显著降低眼压,而0.0025%本品和0.005%拉坦前列素却未能达到此疗效;本品耐受性良好,无严重不良反应报告,也无受试者因不良反应而退出试验。
按照2009年4月与Santen公司达成的合作协议,默克公司获得tafluprost在美洲、非洲、中东、印度、澳大利亚和西欧的商业开发权,而Santen公司则保留了本品在东欧、北欧和亚太大多数地区和国家的上市权。默克公司最近公布的一项Ⅲ期临床试验结果表明,643名开角型青光眼或高眼压患者在随机接受本品(qd)和噻吗洛尔(bid)滴眼液治疗12周后,本品组和噻吗洛尔组受试者眼压分别降至17.4~18.6和17.9~18.5 mmHg;降眼压作用均起效于第2周,并一直持续至12周末;两组受试者在9个时间点(第2、6和12周的当天各3个时间点)的眼压平均降低值差异均小于预期的非劣效性限值(1.5 mmHg),其中本品组在4个时间点的眼压平均降低值大于噻吗洛尔组(95%可信区间上限小于零);本品组和噻吗洛尔组白天眼压降低25%或以上的受试者比例在第2周时分别为56.7%和50.5%,6周时为58.7%和52.6%,12周时为59.7%和55.4%;且本品耐受性良好。
默克公司推出的tafluprost滴眼液为不含防腐剂产品,目前已在美国、西班牙和意大利等欧洲国家以商品名 Safluta获准上市,且美国FDA也已于2011年3月接受了默克公司递交的本品新药申请(NDA),并正按标准程序审评。

