左乙拉西坦缓释片的制备及稳定性研究
何凤娟, 肖衍宇, 操 锋, 孙敏捷, 平其能
(中国药科大学药剂学教研室,江苏 南京 210009)
左乙拉西坦(levetiracetam,LEV)为一种新型抗癫痫药物,具有较强的抗癫痫活性,且对部分性和全身性发作均有效;本品极易溶于水,口服后可被迅速吸收,生物利用度接近100%,血浆蛋白结合率小于10%,平均半衰期约为7 h[1]。目前,国内市售LEV制剂仅1种,即每次500~1500 mg,每日需给药2次的口服片剂,该片剂口服后,因药物释放迅速,血药浓度较高,可引发神经系统不良反应,如嗜睡、疲劳、协调困难和行为失常等。为了在确保LEV疗效的前提下降低其不良反应发生率,比利时优时比(UCB)制药公司研制了每日只需给药1次的LEV缓释片剂(商品名:Keppra XRTM),该制剂已于2009年获美国FDA批准上市,但目前并未在国内上市。笔者所在课题组参考相关文献,以羟丙甲基纤维素(HPMC)为骨架材料制备了与 Keppra XRTM具有相似释药行为的LEV缓释片,其制备工艺简单、质量可控,符合大规模生产要求。
1 仪器与试药
LC-10AT型高效液相色谱仪(日本岛津公司);RS-8型智能溶出试验仪(天津大学无线电厂);TDP型单冲压片机(江苏省泰州市金泰制药机械有限公司);YPD-300D型片剂硬度仪(上海黄海药检仪器厂);BY300A型小型包衣锅(上海黄海药检仪器厂)。
左乙拉西坦原料药(批号:091001,纯度:99.3%,北京世纪迈劲生物科技有限公司);左乙拉西坦缓释片(商品名:Keppra XRTM,批号:57577,规格:500 mg,比利时UCB制药公司);HPMC(型号:Methocel K4M、Methocel K15M 和 Methocel K100M,上海卡乐康包衣技术有限公司);聚乙烯吡咯烷酮(PVP K30,美国国际特品公司),欧巴代(Opadry,型号:OY-C-7000A,上海卡乐康包衣技术有限公司);甲醇(色谱纯,江苏汉邦科技有限公司);双蒸水为实验室自制。
2 方法
2.1 分析方法的建立和考察
2.1.1 色谱条件 固定相为Diamonsil C18色谱柱(250 mm ×4.6 mm,5 μm);流动相为甲醇-水(0.3 mol·L-1KH2PO4,以 H3PO4调节 pH 值至3.0)(25∶75),流速为1 mL·min-1;柱温为40 ℃;检测波长为 210 nm;进样量为 20 μL[2-3]。
2.1.2 标准曲线的绘制 取LEV原料药适量,精密称定,溶解于pH 6.0的磷酸盐缓冲液中配制成质量体积浓度为100 mg·L-1的贮备液,再以 pH 6.0的磷酸盐缓冲液稀释制得质量体积浓度分别为8、10、15、20、30、40 和 60 mg·L-1的系列标准溶液,进样,以色谱峰面积(Y)对质量体积浓度(X)进行线性回归,得回归方程:Y=2943.7X+1417.5(r=0.9999)。可见,LEV 在8 ~60 mg·L-1范围内线性关系良好。
2.1.3 分析方法专属性 取LEV原料药适量,精密称定,溶解于流动相中配制成浓度为50 mg·L-1的供试溶液。按优化后的处方比例称取HPMC K15M、PVP K30和硬脂酸镁,过80目筛混匀,取混匀后的辅料25 mg,精密称定,置于50 mL量瓶中,加流动相适量,超声波处理30 min,使HPMC充分溶解,然后以流动相定容,最后以孔径为0.45 μm的滤膜滤过,取续滤液0.5 mL置10 mL量瓶中,以流动相定容,即得。取上述制备的LEV供试液和辅料供试液进样,考察在“2.1.1”项下的色谱条件下辅料对LEV测定的干扰情况。结果显示,辅料对LEV测定无干扰(见图1),表明该方法专属性良好。
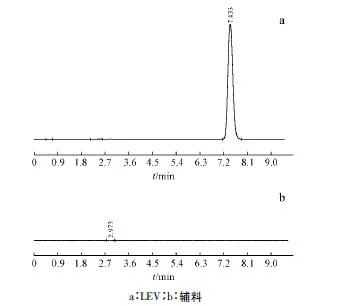
图1 左乙拉西坦原料药和辅料的HPLC图谱Figure 1 The HPLC chromatogram of LEV and excipients
2.1.4 精密度 取LEV原料药10 mg,精密称定,置于100 mL量瓶中,加入pH 6.0磷酸盐缓冲液适量,超声波处理3 min,以pH 6.0磷酸盐缓冲液定容,所得溶液过0.45 μm滤膜后,分别移取1、3和6 mL续滤液至10 mL量瓶中,以pH 6.0磷酸盐缓冲液定容,配制成3种浓度的LEV供试液,分别在1天内连续进样5次,考察日内精密度;每天进样1次,连续5天,考察日间精密度。结果显示,日内精密度RSD分别为0.48%、0.60%和0.46%,日间精密度RSD分别为2.52%、3.12%和2.96%,均小于5%,表明该方法精密度良好。
2.1.5 加样回收率 按优化后的处方比例称取HPMC K15M、PVP K30和硬脂酸镁,过80目筛(筛孔径0.18 mm)混匀,取混匀后的辅料25 mg,精密称定,置于100 mL量瓶中,平行9份,然后按处方量的80%、100%和120%加入LEV原料药,每个药物量平行3份,再加入pH 6.0磷酸盐缓冲液至刻度,待HPMC充分溶解后过孔径为0.45 μm的滤膜,取续滤液1 mL稀释至10 mL,配制成3种浓度的供试液,进样,按“2.1.1”项下色谱条件测定。结果显示,上述低、中、高浓度供试液回收率分别为(99.61±0.01)%、(98.61±0.01)%和(99.02±0.01)%,RSD分别为0.98%、0.42%和0.97%,表明该分析方法准确度较高,符合方法学要求。
2.2 体外释放度的测定
参考市售制剂选择的释放条件[4],采用《中华人民共和国药典》2010年版二部附录ⅩC中的转篮法[5],溶出介质为pH 6.0磷酸盐缓冲液900 mL,温度为(37 ±0.5)℃,转篮转速为 100 r·min-1,分别于0.5、1、2、4、6、8、10 和 12 h 时取样 5 mL,同时向溶出杯中补充同温等量溶出介质。每次所取样品经滤膜(孔径0.45 μm)过滤,取续滤液1 mL置于10 mL量瓶中,定容后进样,按“2.1.1”项下色谱条件进行测定,计算LEV的累积释放百分率。
2.3 左乙拉西坦缓释片制备工艺的优化
将LEV原料药和HPMC过80目筛混匀,加入5%PVP K30乙醇溶液制成软材,过20目筛(筛孔径0.83 mm)制粒,60℃下干燥后再以18目筛(筛孔径0.88 mm)整粒,然后加入适量硬脂酸镁混合均匀,使用11#(19 mm×7.5 mm)深凹椭圆形冲模进行压制,即得规格为500 mg的素片。称取一定量的欧巴代,加入85%的乙醇溶液,使欧巴代质量体积浓度为70 g·L-1,室温搅拌40 min后采用小型包衣锅进行包衣,包衣温度40℃,包衣增重为片芯质量的3%,包衣结束后在包衣锅内40℃下固化30 min。按“2.2”项下方法对在不同 HPMC型号、LEV与HPMC质量比、制备方法和片剂硬度条件下所制片剂的LEV累积释放百分率进行测定。采用相似因子法对自制缓释片与市售缓释制剂的体外释药行为进行比较。相似因子(f2)计算公式如下:
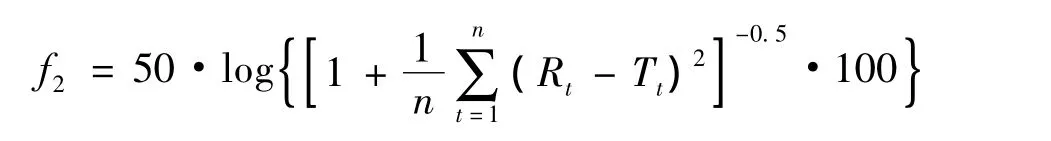
其中,Rt为参比样品在t时间的释放度,Tt为供试品在t时间的释放度,n为取样点数。
2.4 左乙拉西坦缓释片在不同pH释放介质中释放行为的考察
对优化后工艺所得的LEV缓释片在pH 1.2盐酸溶液、pH 4.5醋酸-醋酸钠缓冲液、pH 6.0磷酸盐缓冲液与双蒸水中的释药行为进行考察。
2.5 左乙拉西坦缓释片稳定性的初步考察
按照《中华人民共和国药典》2010年版二部附录ⅪⅩC中的原料药与药物制剂稳定性试验指导原则[6],对按优化后处方自制的一批LEV缓释片进行稳定性考察:将自制LEV缓释片置于洁净的表面皿中,分别于(90±5)%、(75±5)%湿度,60℃高温,以及(4500±500)Lx强光照射条件下放置10 d,于第5和10 d取样,考察片剂的外观性状、增重情况、药物含量及不同时间点的累积释放百分率。
3 结果
3.1 左乙拉西坦缓释片制备工艺的单因素考察结果
3.1.1 市售左乙拉西坦缓释片释放曲线的绘制体外释放度测定结果显示,市售LEV缓释片Keppra XRTM中LEV在0.5、2和8 h时的累积释放百分率分别为(19.56±0.07)%、(47.52±0.28)%和(94.34±1.65)%,其释放曲线如图2所示。
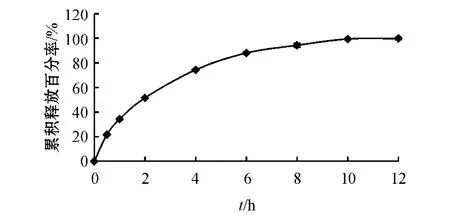
图2 Keppra XRTM中LEV在pH 6.0磷酸盐缓冲液中的释放曲线Figure 2 The LEV release curve of Keppra XRTMin pH 6.0 phosphate buffer solution
3.1.2 羟丙甲基纤维素型号的选择 固定LEV与HPMC的质量比为3∶1,分别选用HPMC K 4M、K 15M和K 100M这3种不同黏度的HPMC为骨架材料,按“2.3”项下方法压片,制得片剂 A、B、C,并对片剂中LEV在pH 6.0磷酸盐缓冲液中的累积释放百分率进行测定。结果显示,选用K 4M和K 15M为骨架材料所制备的缓释片释药速率较快,而用黏度较高的K 100M制备的缓释片释药速率最慢(见图3)。片剂A、B、C 与市售制剂的 f2分别为 68.64、81.08和49.75,表明用K 15M制备的缓释片释药行为与市售制剂最为接近,故在后续研究中选择K 15M作为缓释骨架材料。
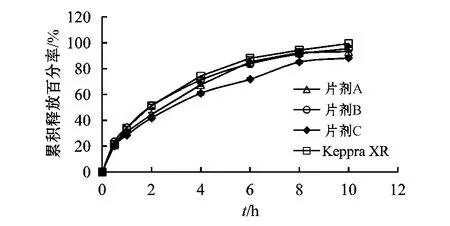
图3 用不同型号HPMC所制缓释片的药物释放曲线Figure 3 The release curves of LEV sustained-release tablets prepared with different types of HPMC
3.1.3 左乙拉西坦与羟丙甲基纤维素比例的确定 选择K15M作为骨架材料,对在不同LEVK15M 质量比(2∶1、3∶1和 4∶1)条件下制备的缓释片A、B、C中LEV体外释放度及f2进行考察。结果显示,随着K15M比例的增加,LEV释药速率逐渐降低(见图4)。缓释片 A、B、C与 Keppra XRTM的 f2分别为 66.33、81.07、63.93,其中缓释片 B的释药行为与Keppra XRTM最为接近,故确定LEVK15M质量比为3∶1。
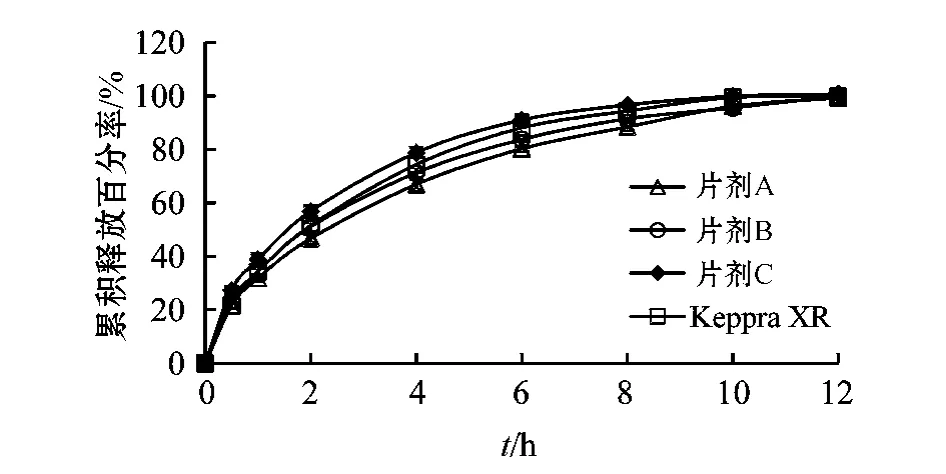
图4 不同LEV-HPMC质量比下制备的LEV缓释片的药物释放曲线Figure 4 The release curves of LEV sustained-release tablets prepared under different LEV-HPMC ratios
3.1.4 制备方法的选择 确定LEV与K15M质量比为3∶1,分别以“2.3”项下湿法制粒压片工艺(工艺1)和粉末直接压片工艺(工艺2,即称取与湿法制粒工艺中相同质量的HPMC K 15M、PVPK30和硬质酸镁,过80目筛,以等量递增法混匀,压片)进行压片,硬度均为17 kg,并对片剂中LEV在pH 6.0磷酸盐缓冲液中的累积释放百分率进行测定。结果显示,上述2种制备工艺所得缓释片的药物释放曲线无显著性差异(见图5)。工艺1和工艺2所制得的缓释片与 Keppra XRTM的 f2分别为70.68和82.44,考虑到国内厂家多以湿法制粒为主,最终选择湿法制粒工艺。
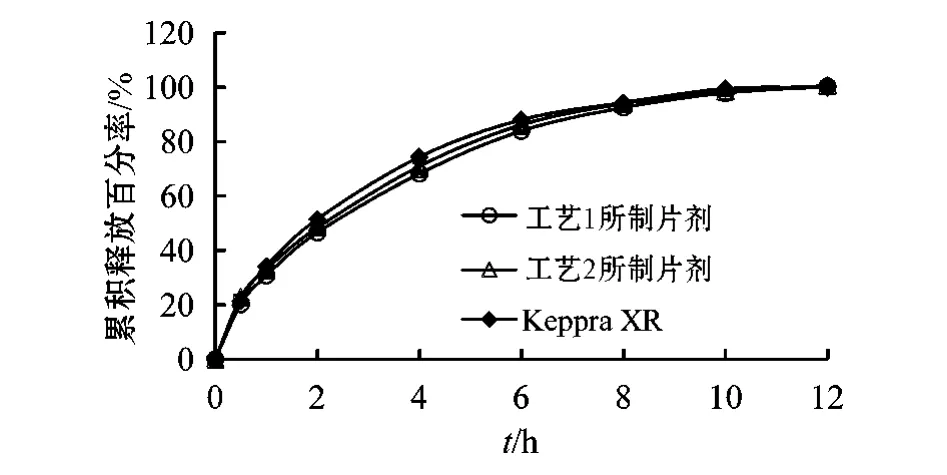
图5 不同方法制备的LEV缓释片的药物释放曲线Figure 5 The release curves of LEV sustained-release tablets prepared by different methods
3.1.5 片剂硬度的选择 将LEV与K15M按质量比为3∶1,以湿法制粒法制得的同一批颗粒制成硬度分别为13~15、16~17和18~19 kg的缓释片 A、B、C,并测定LEV在pH 6.0磷酸盐缓冲液中的累积释放百分率。结果显示,片剂硬度范围为13~19 kg时,硬度对片剂LEV释放行为无显著影响(见图6)。
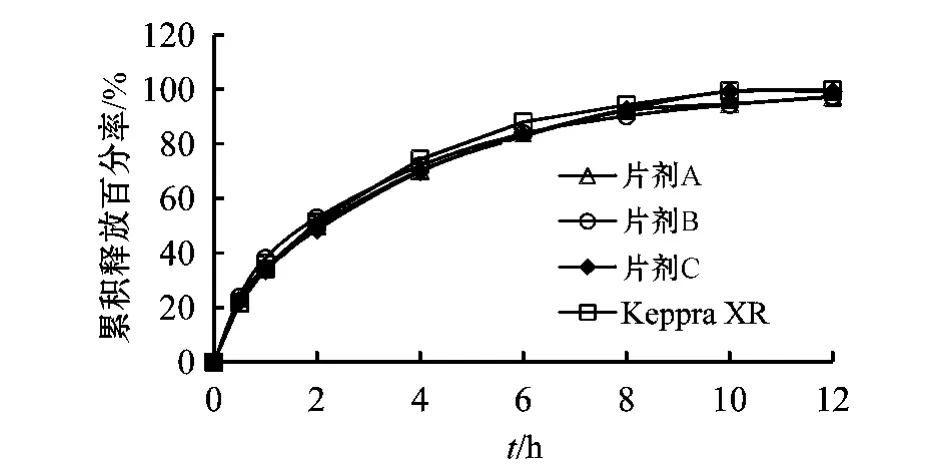
图6 不同硬度的LEV缓释片的药物释放曲线Figure 6 The release curves of LEV sustained-release tablets with different hardness
上述3种硬度的LEV缓释片与Keppra XRTM的f2分别为77.29、76.28和76.67。为防止包衣过程中片剂硬度过小而导致的掉粉和硬度过大造成的压片机磨损,本研究确定LEV缓释片硬度为16~17 kg。
3.2 左乙拉西坦缓释片在不同pH释放介质中的释放行为
实验显示,释放介质pH值对LEV的释放行为无显著影响(见图7)。此外,不同pH下的LEV释放曲线与Keppra XRTM的f2均在70以上。为方便起见,在后续稳定性研究中选用双蒸水作为释放介质。
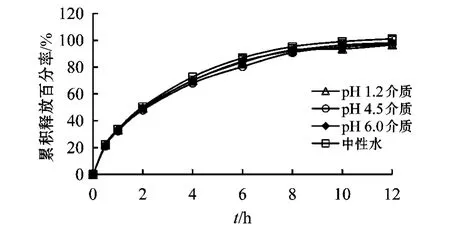
图7 LEV缓释片在不同pH释放介质中的释放曲线Figure 7 The release curves of LEV sustained-release tablets in dissolution medium of different pH values
3.3 左乙拉西坦缓释片稳定性考察结果
LEV缓释片稳定性研究结果如表1所示。经不同条件处理的缓释片LEV含量及释放度等各项指标均无明显改变;需注意的是缓释片在(90±5)%的高湿度条件下易吸潮,表面包衣层起皱,提示该制剂在贮藏过程中需注意防潮。
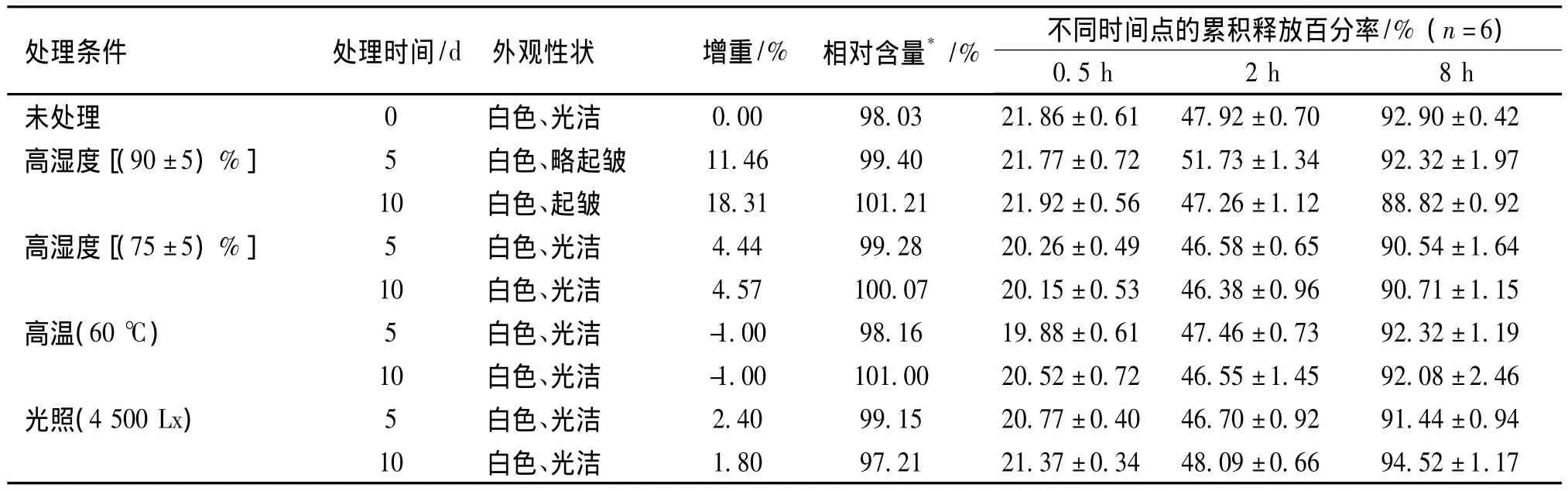
表1 LEV缓释片稳定性研究结果Table 1 The results of stability study on LEV sustained-release tablets
4 讨论
1)LEV具有一定的刺激性气味且味微苦,故研究中对缓释片进行包衣,以掩盖药物的不良气味,提高患者服药的依从性。
2)由于LEV给药剂量较大,为确保患者用药的依从性,片重应尽可能小;而若要达到理想的缓释效果,缓释材料又不能太少,因此综合考虑片重和药物释放效果,在HPMC型号的筛选试验中,暂定LEV与HPMC的质量比为3∶1。
3)相似因子法可直接对释药数据进行统计,不需对各种释药曲线进行拟合,现已被FDA推荐应用,故本研究采用该法比较自制缓释片与市售缓释片的体外释药行为。一般来说,f2越接近于100,表明2种制剂的体外释药行为越相近;f2值在50~100间时,可认为2种制剂体外释药行为无显著差异[7]。
4)水溶性药物主要通过扩散作用从HPMC骨架片中释放,此外也会随着HPMC水凝胶的溶蚀而释放[8-9]。对于该自制LEV缓释片剂,由于LEV属于高水溶性药物,释药迅速,因此片剂中药物释放速度主要取决于所用HPMC的自身性质。基于此,笔者着重对HPMC的型号和用量进行了考察。研究发现,选用高黏度的K100M为骨架材料时,LEV释放速率明显低于另外2种型号的HPMC,原因是HPMC黏度越大,形成的凝胶层强度越大,骨架溶蚀速率越慢;LEV释放速率随着HPMC用量的增加而减缓,这是因为HPMC用量增加时,其形成的水化凝胶层的厚度也会增大,从而影响药物的释放[10-11];本实验中片剂硬度的增加并不会减缓LEV的释放速率,笔者认为,该自制缓释片主要通过HPMC水化凝胶层释放药物,影响其释放速率的关键因素应为水化后的凝胶骨架片的曲率和孔隙率[9,12],而硬度只能影响 HPMC 骨架片本身的密度和骨架未水化时的曲率和孔隙率,因此实验中不同硬度的缓释片其药物释放行为无明显差异。
5)经工艺优化,本研究最终确定了LEV缓释片的最佳制备工艺:以K15M为缓释骨架材料,LEV与K15M质量比为3∶1,通过湿法制粒工艺压片,片剂硬度为16~17 kg。该制备工艺简单易行,稳定性好,易于控制,符合大规模生产要求。
[1]施安国,费艳秋,王平全.抗癫痫新药左乙拉西坦[J].中国新药杂志,2000,9(11):742-744.
[2]肖拥军,罗湘翼.高效液相色谱法测定左乙拉西坦片的含量[J].广东药学院学报,2005,21(6):687-688.
[3]Raju N A,Rao J V,Prakash K V,et al.Estimation of levetiracetam in tablet dosage form by RP-HPLC [J].E J Chem,2008,5(S2):1098-1102.
[4]FDA.Center for drug evaluation and research [EB/OL].(2008-08-15)[2010-12-11]http://www.accessdata.fda.gov/drugsatfda_docs/nda/2008/022285s000_ChemR.pdf.
[5]国家药典委员会.中华人民共和国药典2010年版:二部[M].北京:中国医药科技出版社,2010:附录ⅩC.
[6]国家药典委员会.中华人民共和国药典2010年版:二部[M].北京:中国医药科技出版社,2010:附录ⅪⅩC.
[7]欧阳德方,聂淑芳,孟晋,等.采用相似因子法评价不同因素对复方二甲双胍-格列吡嗪双层缓释片体外释放的影响[J].沈阳药科大学学报,2006,23(1):1-5.
[8]Li C L,Martini L G,Ford J L,et al.The use of hypromellose in oral drug delivery[J].J Pharm Pharmacol,2005,57(5):533-546.
[9]郑峰,史丽颖,王辉.羟丙基甲基纤维素凝胶骨架片体外释药的影响因素[J].宝鸡文理学院学报(自然科学版),2002,22(3):197-199.
[10]Velasco M V,Ford J L,Rowe P,et al.Influence of drug:hydroxypropylmethylcellulose ratio,drug and polymer particle size and compression force on the release of diclofenac sodium from HPMC tablets[J].J Controlled Release,1999,57(1):75-85.
[11]程紫骅,刘燕,朱家璧.盐酸雷尼替丁HPMC骨架片药物释放影响因素研究[J].中国药科大学学报,1998,29(4):275-277.
[12]马福家.双氯芬酸钾HPMC骨架片体外释药影响因素研究[J].上海医药,2005,26(6):271-272.

