HPLC梯度洗脱法同时测定复方盐酸喹那普利/氢氯噻嗪片剂含量及有关物质
吕灵云, 操 锋, 肖衍宇, 平其能
(中国药科大学药剂学教研室,江苏 南京 210009)
复方盐酸喹那普利/氢氯噻嗪片剂(商品名:Accuretic)是辉瑞公司于1999年上市的高血压和充血性心力衰竭治疗药物,主要成分是盐酸喹那普利和氢氯噻嗪。其中,盐酸喹那普利(QHCl)为无巯基、长效、口服血管紧张素转换酶抑制剂(ACEI),是第3代ACEI的优秀代表之一[1];氢氯噻嗪(HCTZ)是临床常用利尿药,常与其他降压药合用治疗高血压。HCTZ和QHCl合用,可增强ACEI的作用。
与其他ACEI类药物一样,QHCl存在稳定性问题,其降解途径为:1)分子内仲胺去质子化后进攻羰基成环,形成2,5-二酮哌嗪(DKP);2)侧链酯基水解形成喹那普利拉。据文献报道,QHCl对湿度、pH和温度敏感,其环化和水解均与环境pH有关,即在低pH条件下,主要生成DKP;在较高pH条件下,主要生成喹那普利拉[2-5]。HCTZ的有关物质4-氨基-6-氯-1,3-苯二磺酰胺(以下简称二磺酰胺)既是HCTZ合成过程的中间体,也是其降解产物[6]。
美国药典32版(USP32)推荐采用HPLC法同时测定QHCl及其两个有关物质,也有文献报道采用HPLC法测定QHCl或同时检测QHCl和喹那普利拉[7-8]。中国药典2010年版二部则规定分别采用非水滴定法及紫外分光光度法测定HCTZ原料及制剂含量,而采用比色法进行有关物质二磺酰胺限度检查,还有文献采用HPLC法测定HCTZ及其有关物质[9]。Gandhimathi等[10]报道采用 HPLC 法同时测定复方QHCl/HCTZ片剂中两个主要成分的含量,另有报道用LC-MS法同时测定人血浆中HCTZ、QHCl和喹那普利拉[11]。目前国内外尚未见有同时检测复方QHCl/HCTZ片剂中QHCl、喹那普利拉、DKP、HCTZ及二磺酰胺等5种化合物的报道,本文采用HPLC梯度洗脱法实现了这5种化合物的良好分离和测定,为该复方片剂的质量控制提供了一种有效的分析方法。
1 仪器与试药
Agilent 8453紫外扫描仪;Agilent 1100型高效液相色谱仪,包括G1312A型二元泵、G1313A型自动进样器、G1314A型紫外检测器和AT-103柱温箱;BS124S型电子天平(北京赛多利斯仪器系统有限公司);KQ-100型台式超声仪(昆山市超声仪器有限公司);PB-10型pH计(Sartorius公司)。
HCTZ对照品(纯度99.8%,中国药品生物制品检定所,批号100309-200702,用前于105℃烘箱中放置4 h);QHCl对照品(纯度98.3%,中国药品生物制品检定所,批号100568-200401);复方QHCl/HCTZ片剂样品(自制,规格:10.8/12.5 mg,批号:20110405、20110406、20110408);水为纯净水,乙腈为色谱纯,三乙胺和磷酸为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Lichrospher C18柱(250 mm×4.6 mm,5 μm);流动相A:0.05%三乙胺水溶液(用10%磷酸调pH至3.50),流动相B:乙腈,按表1中程序进行线性梯度洗脱;柱温:40℃;检测波长:215 nm;进样量:20 μL。在该色谱条件下,5种化合物的相邻各峰间分离度均大于1.5;理论塔板数按QHCl峰计算大于20000,按HCTZ峰计算大于4000。
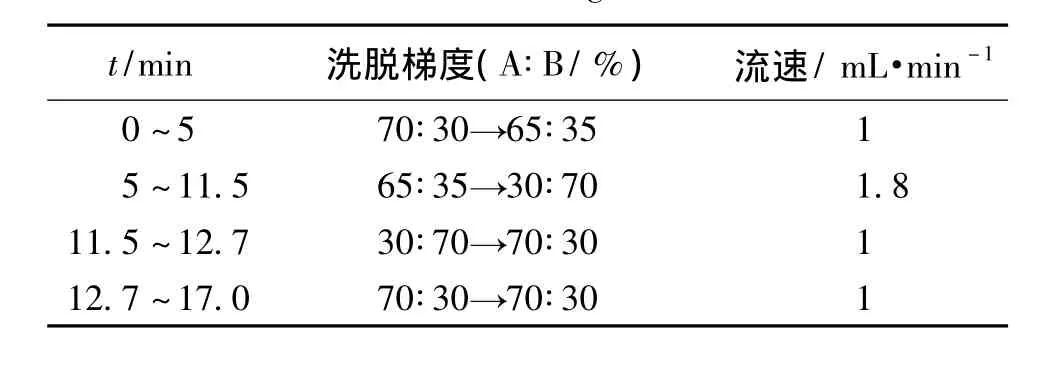
表1 梯度洗脱程序Table 1 Procedure of gradient elution
2.2 对照品溶液配制
QHCl对照品溶液:取QHCl对照品6 mg,精密称定,置250 mL容量瓶中,加水,超声波处理使溶解,定容至刻度,摇匀,即得。
HCTZ对照品溶液:取 HCTZ对照品12.5 mg,精密称定,置500 mL容量瓶中,加水,超声波处理使溶解,定容至刻度,摇匀,即得。
2.3 供试品溶液配制
取样品10片,研细,取适量(约相当于 QHCl 10.8 mg,HCTZ 12.5 mg),精密称定,置 100 mL 容量瓶中,加水适量,超声波处理20 min,放冷,定容至刻度,摇匀,滤过,取续滤液作为贮备液;精密吸取贮备液2.0 mL至10 mL容量瓶中,用水稀释至刻度,摇匀,即得。
2.4 方法专属性考察
按处方比例称取空白辅料,置100 mL容量瓶中,加水适量,超声波处理15 min,放冷,定容至刻度,摇匀,滤过,取续滤液和空白溶剂水进样,记录色谱图(见图1A)。
称取QHCl对照品适量,于60℃烘箱中放置10 d,用水配制成30 mg·L-1溶液,进样,记录色谱图(见图1B)。称取QHCl对照品适量,用水配制成50 mg·L-1溶液50 mL,共3份;取2份分别加入浓度均为0.1 mol·L-1的盐酸和氢氧化钠1 mL,室温放置24 h,再分别加入同浓度氢氧化钠及盐酸中和;另取1份于(4500±500)lx光照度下放置24 h。称取QHCl对照品适量,用3%双氧水配制成50 mg·L-1溶液,室温放置24 h。取以上分别经酸、碱、光照、氧化处理的QHCl对照品溶液,加水稀释1倍,进样,记录色谱图(见图1B~C)。
HCTZ对照品的酸、碱、光照、氧化及高温破坏实验同上操作,色谱图见图1D。

图1 方法专属性实验色谱图Figure 1 Chromatograms of specificity test
由图1可见,辅料对样品测定无干扰;QHCl与其酸、碱、光照、氧化及高温降解产物均能很好分离,其中酸、碱对QHCl的破坏作用明显,降解产物明显增多;HCTZ经破坏试验产生的降解产物仍主要为二磺酰胺,与HCTZ分离良好,未检测到其他降解产物。
2.5 线性关系考察
取QHCl对照品17.7 mg,精密称定,置250 mL容量瓶中,用水溶解并稀释至刻度,摇匀,即得QHCl贮备液(70.8 mg·L-1);另取HCTZ对照品37.9 mg,精密称定,置500 mL容量瓶中,用水溶解并稀释至刻度,摇匀,即得HCTZ贮备液(75.8 mg·L-1)。精密量取 QHCl贮备液 0.1、1、3、5、7、9 mL 各置编号为1、2、3、4、5、6 的 10 mL 容量瓶中,再精密量取HCTZ 贮备液 9、7、5、3、1、0.1 mL 依次加入上述编号为1~6的各容量瓶中,用水定容至刻度,摇匀,制得QHCl和HCTZ的系列混合标准溶液,进样,记录色谱图。以峰面积(A)对质量浓度(C)进行线性回归,分别得 QHCl回归方程:A=24.785C-6.376,r=0.9998;HCTZ回归方程:A=94.291C+28.761,r=0.9999。结果表明,QHCl和 HCTZ分别在0.708 ~63.72 mg·L-1和0.758 ~68.22 mg·L-1范围内线性关系良好。
2.6 精密度实验
分别取“2.5”项下制备的编号分别为1、3、6号的低、中、高3个质量浓度混合标准溶液,于日内每隔2 h进样测定1次,连续5次;另于每日进样测定1次(当天配制),连续5次,记录色谱图。结果显示,3个质量浓度的混合标准溶液所测 QHCl和HCTZ峰面积的日内及日间RSD均在0.7%~2.1%范围内(n=5),说明方法精密度良好。
2.7 回收率实验
精密称取HCTZ 对照品10、12.5、15 mg,分别置500 mL容量瓶中,加入水,超声波处理至充分溶解,冷却,定容,制得 19.80、25.20、30.40 mg·L-1的低、中、高质量浓度HCTZ溶液;再精密称取QHCl对照品 8.68、10.85、13.02 mg,分别置 500 mL 容量瓶中,加入水,超声波处理至充分溶解,冷却,定容,制得 17.40、21.60、25.80 mg·L-1的低、中、高质量浓度QHCl溶液。按处方比例称取辅料置100 mL容量瓶中,共9份,将以上低、中、高3个质量浓度的HCTZ和QHCl对照品溶液分别加入含辅料容量瓶中,每个质量浓度各3份,超声波处理15 min,用相应对照品溶液定容,混匀,滤过,取续滤液进样,记录色谱图。将峰面积代入回归方程,计算回收率(见表2、3)。
由表2、3可见,QHCl和HCTZ的平均回收率均在98% ~102%之间,RSD均小于2%。
2.8 稳定性实验
按“2.3”项下方法制备供试品溶液,室温放置,分别于0、2、4、6、8 h 进样,记录色谱图。结果显示,在不同时间点所测QHCl和HCTZ峰面积的RSD分别为1.66%和0.96%,表明供试品溶液在8 h内稳定。

表2 HCTZ回收率实验结果(n=3)Table 2 Results of HCTZ recovery test

表3 QHCl回收率实验结果(n=3)Table 3 Results of QHCl recovery test
2.9 样品测定
分别按“2.2”及“2.3”项下方法制备 QHCl和HCTZ对照品溶液及3批次样品的供试品溶液,进样,记录色谱图。按外标法测定样品中两主成分含量(以百分标示量计),采用主成分1%自身对照法测定有关物质(供试品溶液稀释100倍后的色谱图见图2),每批次样品测定3次,结果见表4。

图2 稀释100倍的供试品溶液色谱图Figure 2 Chromatogram of 100-fold diluted sample solution
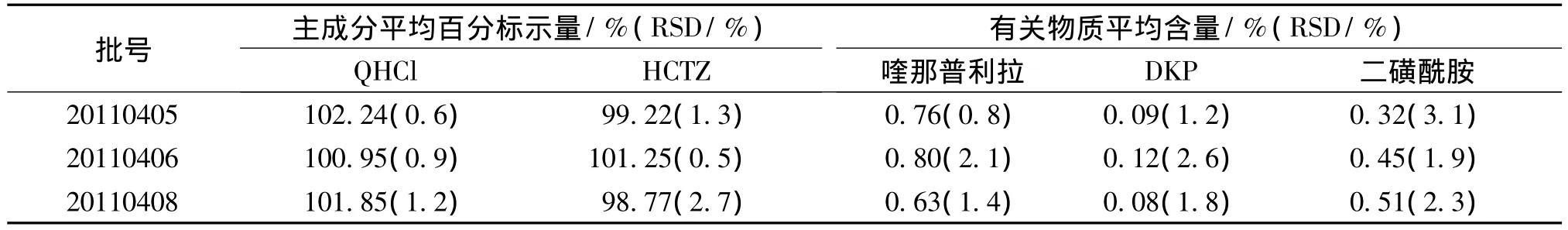
表4 样品测定结果(n=3)Table 4 Determining results of samples
3 讨论
3.1 检测波长的选择
按“2.2”项下方法分别配制QHCl和HCTZ对照品溶液,并稀释1倍,以水为空白溶剂,在200~400 nm波长范围内扫描,结果显示,HCTZ在214、271和317 nm处有吸收峰,QHCl在215 nm处有末端吸收。故选择两药均有较大吸收的波长215 nm为检测波长。
3.2 有关物质的确定
USP32中明确指出,QHCl有两个相关物质,即喹那普利拉和DKP。且QHCl的降解行为与介质pH密切相关,即在高pH条件下,QHCl主要降解为喹那普利拉,而在低pH条件下,QHCl主要降解为DKP。由这两个有关物质的结构可知,喹那普利拉的极性大于DKP。本文中QHCl破坏性实验也显示,在碱破坏实验色谱图中,5.7 min处有一个明显的有关物质峰,而在酸破坏实验色谱图中,12.5 min处则出现另一个明显的有关物质峰,且在QHCl破坏性实验色谱图中未发现其他有关物质峰。据此推定,色谱图中5.7和12.5 min处的有关物质峰应分别出自喹那普利拉和DKP,且极性较大的喹那普利拉先出峰,DKP最后出峰,这与文献[4]报道相一致。
由HCTZ破坏性实验色谱图可见,在3.8 min处均只有一个相关物质峰,无其他相关物质峰,且在酸、碱破坏实验色谱图中该峰更为明显。此外,在相同色谱条件下,对相同质量浓度的HCTZ对照品溶液进样分析,也发现在3.8 min处出峰。据此推定,色谱图中3.8 min处的有关物质峰即为二磺酰胺峰。
3.3 流动相的选择
在预实验中,曾选择不同的流动相系统对复方QHCl/HCTZ片剂进行色谱分析,结果发现,与甲醇相比,乙腈用作流动相可致色谱基线平稳,洗脱力强,主成分峰形对称性好,理论塔板数高;在反相HPLC系统中,由于HCTZ和二磺酰胺的极性较强,保留时间短,不易分开,而QHCl与DKP的极性弱,出峰较迟,因此,流动相中乙腈的比例直接影响到HCTZ与二磺酰胺的分离度,也影响到QHCl与DKP的出峰时间;而且,采用HPLC等度洗脱法,虽然可将5种化合物较好分离,但由于化合物间极性差异大,导致分析时间过长。所以,本文采用乙腈-水梯度洗脱方式对该复方片剂进行HPLC分析,即在HCTZ与二磺酰胺分离后,调整流动相中乙腈比例,提高流速,致使QHCl及其有关物质较快出峰,这样,既使5种化合物得到很好分离,又缩短了分析时间。
3.4 流动相pH的选择
在色谱分析时,QHCl及其两种有关物质的出峰时间对流动相pH敏感,尤其是喹那普利拉,即随着流动相pH值的增加,三者的出峰时间均会提前,若pH值过高,则喹那普利拉与HCTZ将无法分开,而若pH值减小,三者的出峰时间则会延迟。综合考虑5种化合物的有效分离、分析时间及一般常用C18柱的pH适用范围,最终选定流动相pH为3.50。
3.5 梯度峰分析
由图1A可见,空白辅料和溶剂进样后,均出现梯度峰。究其原因,推测可能是由于流动相中乙腈的弱极性杂质所致,即梯度洗脱开始时,流动相极性较强,此杂质不能被洗脱,并在柱头富集,而随着流动相中有机相比例提高,其极性降低,杂质被洗脱,故在分析后期出现梯度峰。
综上所述,本文所建立的HPLC梯度洗脱法简便快速、专属性强、灵敏度高、重复性好,可用于复方QHCl/HCTZ片剂的含量测定和杂质检查。
[1]黄震华,徐济民.新型血管紧张素转换酶抑制剂喹那普利[J].新药与临床,1993,12(4):220-222.
[2]Stanisz B.The influence of pharmaceutical excipients on quinapril hydrochloride stability[J].Acta Pol Pharm,2005,62(3):189-193.
[3]Roskar R,Simoncic Z,Gartner A,et al.Stability of new potential ACE inhibitor in the aqueous solutions of different pH[J].J Pharm Biomed Anal,2009,49(2):295-303.
[4]Freed A L,Silbering S B,Kolodsick K J,et al.The development and stability assessment of extemporaneous pediatric formulations of Accupril[J].Int J Pharm,2005,304(1/2):135-144.
[5]Hailu S A,Bogner R H.Effect of the pH grade of silicates on chemical stability of coground amorphous quinapril hydrochloride and its stabilization using pH-modifiers[J].J Pharmsci,2009,98(9):3358-3372.
[6]盛炳义,金瓯.HPLC法测定复方氢氯噻嗪片中的杂质[J].广东药学院学报,1999,15(1):48-50.
[7]葛庆华,张晓红,钱麟兴.盐酸喹那普利片的HPLC测定[J].中国医药工业杂志,1998,29(9):414-416.
[8]Abbara Ch,Aymard G,Hinh S,et al.Simultaneous determination of quinapril and its active metabolite quinaprilat in human plasma using high-performance liquid chromatography with ultraviolet detection[J].J Chromatogr B Analyt Technol Biomed Life Sci,2002,766(2):199-207.
[9]孙国庆,平其能,繆玉山,等.RP-HPLC法测定氢氯噻嗪片中氢氯噻嗪及其有关物质的含量[J].中国药科大学学报,1996,27(5):296-299.
[10]G andhimathi M,Ravi T K.Ion pair-HPLC method for the simultaneous estimation of quinapril and hydrochlorothiazide in tablets[J].Indian J Pharmsci,2009,71(3):311-313.
[11]Parekh S A,Pudage A,Joshi S S,et al.Simultaneous determination of hydrochlorothiazide,quinapril and quinaprilat in human plasma by liquidchromatography-tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,873(1):59-69.

