Gas6经PI3K/Akt通路对缺氧复氧诱导H9c2细胞凋亡的影响
符江琳, 刘承云, 徐 晓, 刘存飞, 陈星霖
(华中科技大学同济医学院附属协和医院老年科,湖北 武汉 430022)
随着心脏介入治疗技术的成熟,缺血心肌经血运重建后引起的心肌细胞凋亡早已引起人们的关注。大量研究表明通过抑制心肌细胞凋亡可以减少缺血再灌注后的心肌细胞损伤[1]。磷脂酰肌醇3-激酶/蛋白激酶 B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)通路控制着哺乳动物细胞内的许多调节反应,如抑制细胞凋亡,调节细胞增殖、新陈代谢及细胞肥大[2]。生长停滞特异性蛋白6(growth arrest-specific protein 6,Gas6)是近些年发现的具有抗凋亡作用的细胞因子,属于受体酪氨酸激酶亚家族成员的配体之一。早期不少研究均证实Gas6能通过激活PI3K/Akt存活通路,减少血清剥夺或低糖诱导的神经元、内皮细胞及平滑肌细胞凋亡[3-5]。最近又有报道在肝脏细胞缺血再灌注损伤中,Gas6能通过活化PI3K/Akt通路对肝细胞起保护作用[6]。本研究旨在利用H9c2细胞急性缺氧复氧模型,模拟心肌缺血再灌注损伤,观察Gas6对H9c2细胞急性缺氧复氧诱导的细胞凋亡的影响,并初步探讨其与PI3K/Akt通路的关系。
材料和方法
1 材料
H9c2细胞系(武汉博士德公司)、DMEM高糖和低糖型培养基(Gibco)、胎牛血清(杭州四季青)、重组人Gas6(R&D),Annexin p-Akt V/PI凋亡试剂盒(AntiGene)、兔抗大鼠磷酸化 Akt抗体(p-Akt Ser473)(Cell Signaling Technology)、辣根过氧化物酶标记抗兔IgG(武汉谷歌公司)、caspase-3活性检测试剂盒(南京建成有限公司)。其它试剂均为国产分析纯。
2 方法
2.1 H9c2细胞系培养 以2×107cells/L密度接种于50 mL培养瓶中,用含10%胎牛血清的高糖DMEM培养基,37℃、5%CO2培养箱(95%空气)中培养,2-3 d后用0.25%胰酶消化传代1次,分别以1×107cells/L或1×108cells/L密度接种于96孔或6孔培养板中,取对数生长期细胞进行实验。
2.2 细胞缺氧/复氧(anoxia/reoxygenation,A/R)模型的构建 按照先前文献中方法[7]改进后,用氮气充分预先饱和无血清低糖DMEM培养基30 min(流量为2 L/min),使溶解氧分压从20 kPa降至4 kPa。将上述细胞培养基快速置换细胞培养板中的含血清的高糖培养基,并将细胞培养板置入充满氮气的密闭装置内,37℃细胞培养3 h后换为正常培养基,37℃、5%CO2培养箱(95%空气)复氧3 h。
2.3 实验分组 分别取6孔板中正常培养的H9c2细胞随机分4组:正常组(control组):37℃ 、5%CO2培养箱(95%空气)正常培养;缺氧/复氧组(A/R组):按照上述构建模型;缺氧/复氧+Gas6组(A/R+Gas6组):于缺氧前15 min在无血清低糖培养基中加入终浓度为100 μg/L的重组人 Gas6,构建模型;缺氧/复氧 +Gas6+PI3K/Akt特异性阻断剂LY294002组(A/R+Gas6+LY294002组):缺氧前30 min在无血清低糖培养基中避光加入10 μmol/L LY294002,余后处理同A/R+Gas6组。
2.4 MTT法测定H9c2细胞活力 将细胞密度分别调至1×107cells/L,取 200 μL/well接种于 96孔培养板中,2-3 d后随机分组对应处理后,每孔加入20 μL MTT(5 g/L),继续正常培养 4 h 后,1000 r/min离心5 min后弃上层培养液,每孔加入DMSO 0.15 mL,振荡10 min后,酶标仪检测各孔吸光度(A)值(检测波长为570 nm)。细胞活力=(对照组A值-实验组A值)/对照组A值×100%。
2.5 Caspase-3活性检测 取处理过的各组6孔培养板,先将细胞培养液收集于离心管中,用0.25%的胰酶消化贴壁细胞,收集于对应离心管中,4℃、1000 r/min离心5 min,用冰预冷的PBS洗涤1次,沉淀细胞中加入50 μL预冷裂解液,混匀冰浴裂解15 min,4 ℃、30000 r/min 离心5 min,取各组上清备用。在96孔板中各组每孔加入检测缓冲液80 μL,再加入上述各组待测样品上清10 μL,随后加入Ac-DEVD -pNA 10 μL,37 ℃孵育过夜,用酶标仪测定各组的A405值,样品的A405扣除空白对照组A405,即为caspase-3催化产生pNA的A值。按照caspase-3活性检测试剂盒说明书,测定并制作标准曲线,算出对应酶活力单位。
2.6 Annexin V-FITC/PI双标法及流式细胞仪检测细胞凋亡 取处理过的各组6孔培养板,先将可能含有漂浮凋亡细胞的各组培养液分别收集于流式管中,用0.25%的胰酶消化贴壁细胞,并收集于对应的流式管中,4℃、1000 r/min离心5 min,用冰预冷的PBS洗涤2次,然后用200 μL结合缓冲液重悬细胞。加入5 μL Annexin V-FITC,避光室温反应15 min,再加入10 μL PI避光室温反应5 min或者4℃反应30 min,加入250 μL PBS,立即上机检测。经流式细胞仪分析结果判断:左下象限Q3显示活细胞(FITC-/PI-);左上象限Q1显示死亡细胞,即坏死细胞(FITC-/PI+);右上象限Q2显示晚期凋亡细胞(FITC+/PI+);右下象限 Q4显示早期凋亡细胞(FITC+/PI-)。凋亡率为 Q2+Q4。
2.7 Western blotting检测p-Akt蛋白表达水平取6孔培养板中密度达1×107cells/L的H9c2细胞,以预冷的PBS洗涤后加入200 μL含Cocktail的裂解液(按1 mL 裂解液加 20 μL Cocktail,使用前 5 min配制),Bradford法测定蛋白浓度,各孔上样量为75 μg,10%SDS PAGE 胶电泳、转膜、封闭、加兔抗鼠p-Akt蛋白Ⅰ抗(1∶1000稀释)、4℃孵育过夜、辣根过氧化物酶山羊抗兔IgG孵育1 h,DAB化学显色照相。用LabWork 3.0 UVP软件分析照片中蛋白条带积分吸光度值(integrated absorbance,IA=平均吸光度值×面积),以靶蛋白IA值/β-actin IA值的比值反映靶蛋白相对水平。
3 统计学处理
结 果
1 H9c2细胞活力的比较
Gas6预处理的A/R+Gas6组,H9c2细胞活力明显高于A/R组(P<0.05);给予PI3K/Akt特异性阻断剂LY294002后,与A/R+Gas6组和control组比较,细胞活力明显下降(P<0.05),但其与A/R比较无显著差异,见表1。
表1 各组H9c2细胞活力和caspase-3活性变化Table 1.Changes of cell viability and caspase-3 activity of H9c2 cells among the four groups(.n=6)

表1 各组H9c2细胞活力和caspase-3活性变化Table 1.Changes of cell viability and caspase-3 activity of H9c2 cells among the four groups(.n=6)
*P <0.05 vs control;△P<0.05 vs A/R;#P <0.05 vs A/R+Gas6.
Control 91.0 ±4.0 3.02 ±0.44 A/R 43.2 ±3.5* 8.86 ±0.70*A/R+Gas6 82.1 ±4.3△ 4.63 ±0.50△A/R+Gas6+LY29400250.5 ±1.2# 7.92 ±0.18#
2 Caspase-3活性检测
A/R组与control组比较,caspase-3活性增加(P<0.05);A/R+Gas6组较A/R组caspase-3活性明显降低(P<0.05);A/R+Gas6+LY294002组与A/R+Gas6组比较,caspase-3活性显著增加(P<0.05),见表1。
3 各组细胞凋亡率的比较
图1显示,A/R+Gas6组和control组细胞凋亡率明显低于A/R组(P<0.05);经LY294002预处理后,细胞凋亡率显著增加(P<0.05),但与A/R组比较无显著差异(P>0.05)。
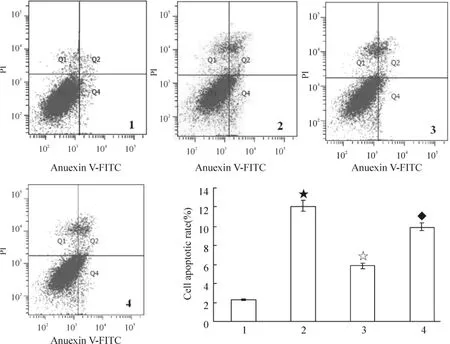
Figure 1.Flow cytometry showed the changes of cell apoptotic rate(%)among the four H9c2 cell groups.1:control group;2:A/R group;3:A/R+Gas6 group;4:A/R+Gas6+LY294002 group..n=6.★P<0.05 vs 1;☆P<0.05 vs 2;◆P<0.05 vs 3.图1 流式细胞仪检测4组H9c2细胞凋亡率的变化
4 Western blotting检测p-Akt蛋白表达水平
经A/R及Gas6预处理的细胞组,p-Akt蛋白水平明显高于其它各组(P<0.05);而加入LY294002组的p-Akt蛋白水平明显低于 A/R+Gas6组和 A/R组(P<0.01,P<0.05);A/R组与control组比较,p-Akt蛋白水平差异显著(P<0.05),见图2。

Figure 2.Changes of expression of p-Akt protein among the four H9c2 cell groups.1:control group;2:A/R group;3:A/R+Gas6 group;4:A/R+Gas6+LY294002 group..n=6.▲P<0.05 vs 1;△P<0.05 vs 2;**P<0.01 vs 3.图2 4组H9c2细胞p-Akt蛋白表达水平变化
讨 论
PI3K是一个包括许多脂质激酶的家族,它可被受体酪氨酸激酶的配体激活。当细胞受到生长因子、胰岛素等刺激后,对应的受体被激活,进一步磷酸化Akt的C末端Ser473残基,从而Akt被完全激活,作用于多种底物,包括双水杨酸双酚 A酯、caspase-9、糖原合酶激酶3α/β、哺乳类雷帕霉素靶蛋白等来调节细胞的生存、增殖和代谢[2]。深低温环境、他汀类药物、胰岛素等均可通过PI3K/Akt相关通路抑制缺血再灌注诱导的心肌细胞凋亡[8-10]。因此PI3K/Akt存活通路在心肌缺血再灌注损伤中起着重要的保护作用,是受体酪氨酸激酶介导的胞内重要信号转导通路之一,
受体酪氨酸激酶亚家族成员Mer、Sky及Axl的共同配体-Gas6最早是在缺乏血浆培养的NIH3T3细胞中发现的一种维生素K依赖性蛋白,其分子结构包括氨基末端及羧基末端,前者能与磷脂和膜蛋白结合,后者则是与受体酪氨酸激酶亚家族成员(Mer、Sky及Axl)结合的区域。受体酪氨酸激酶亚家族成员之一的Axl在心脑血管组织中表达较高,参与组织或细胞内多种病理生理的信号转导[11,12],近些年来其配体Gas6在心脑血管系统的作用也日益凸显。
在小鼠大脑中,神经元细胞上Axl与Gas6结合,导致其自身磷酸化,招募信号分子如:Grb2(growth factor receptor-bound protein 2)和PI3K的亚家族p85,并激活下游的生存途径[13]。另外在少突胶质细胞中,Gas6信号可以激活Axl和PI3K/Akt(磷脂酰肌醇3激酶/蛋白激酶B)存活途径来抑制由生长因子缺乏和肿瘤坏死因子诱导的细胞凋亡[14],在成纤维细胞、血管平滑肌、血管内皮细胞凋亡过程中也有此作用机制发生,活化的Akt通过磷酸化作用进一步激活或抑制下游靶蛋白,通过抑制caspase-3活性,进而发挥调节细胞存活、增殖和分化等作用[4,15],予以 P13K 抑制剂 LY294002 或渥曼青霉素预处理后,Gas6对上述细胞凋亡的抑制作用明显减弱,显示Gas6可以通过P13K/Akt通路实现抗细胞凋亡的作用,但给予MAPK/ERK通路特异性阻断剂PD980590并不能减弱Gas6的抗细胞凋亡作用[14]。最近报道在糖剥夺培养的血管平滑肌细胞和缺血再灌注肝脏细胞中,Gas6能通过P13K/Akt存活通路减少细胞凋亡。同时在高糖诱导的血管平滑肌凋亡过程中,Gas6则主要是通过激活MAPK/ERK信号通路起着抗细胞凋亡的作用[5]。这似乎说明在缺氧缺糖环境下P13K/Akt存活通路是Gas6发挥抗细胞凋亡的主要通路。所以我们推测在心肌缺氧复氧这一病理生理过程中,Gas6是否也能通过激活PI3K/Akt存活通路抑制心肌细胞凋亡。
因此,我们采用H9c2心肌细胞系,而不是原代乳鼠心肌细胞,排除了心肌成纤维细胞对实验的干扰。同时利用 PI3K/Akt通路特异性阻断剂LY294002,观察Gas6对缺氧复氧心肌细胞凋亡的影响。实验结果表明,与正常组比较,H9c2细胞缺氧复氧后,磷酸化 Akt蛋白水平明显增高,验证了PI3K/Akt信号通路是心肌缺血再灌注损伤中经典保护通路之一。而 Gas6预处理后,细胞凋亡率及caspase-3活性均较A/R组明显降低,磷酸化Akt蛋白水平明显增高,提示Gas6可以减少心肌细胞凋亡,并可能是通过活化磷酸化Akt蛋白以激活PI3K/Akt通路实现的。但预先加入PI3K/Akt通路特异性阻断剂LY294002后,Gas6的细胞保护作用被抑制。这一实验结果又证实了我们的预测。
所以通过本研究我们得出结论:Gas6能提高磷酸化Akt蛋白表达水平,可能以此激活PI3K/Akt存活通路,减少心肌缺血再灌注损伤后心肌细胞凋亡,同时提示PI3K/Akt存活通路在Gas6保护缺氧复氧诱导的心肌细胞凋亡信号转导通路中起着至关重要的作用。但在心肌细胞中Gas6具体如何激活PI3K/Akt存活通路,及是否存在MAPK/ERK信号通路的交互作用有待一进步研究。
[1]Lee Y,Gustafsson AB.Role of apoptosis in cardiovascular disease[J].Apoptosis,2009,14(4):536 -548.
[2]Oudit GY,Penninger JM.Cardiac regulation by phosphoinositide 3 - kinases and PTEN[J].Cardiovasc Res,2009,82(2):250-260.
[3]Lee WP,Wen Y,Varnum B,et al.Akt is required for Axl-Gas6 signaling to protect cells from E1A-mediated apoptosis[J].Oncogene,2002,21(3):329 -336.
[4]Hasanbasic I,Cuerquis J,Varnum B,et al.Intracellular signaling pathways involved in Gas6-Ax1-mediated survival of endothelial cells[J].Am J Physiol Heart Circ physiol,2004,287(3):H1207 - H1213.
[5]Cavet ME,Smolock EM,Ozturk OH,et al.Gas6-Axl receptor signaling is regulated by glucose in vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2008,28(5):886-891.
[6]Llacuna L,Barcena C,Bellido- Martin L,et al.Growth arrest-specific protein 6 is hepatoprotective against murine ischemia/reperfusion injury[J].Hepatology,2010,52(4):1371-1379.
[7]张秀娥,成 蓓,彭 雯,等.p38MAPK信号通路在钙调磷酸酶促心肌凋亡中的作用[J].中国病理生理杂志,2008,24(2):266-269.
[8]谷 翔,史春志,冯义柏,等.胰岛素对新生大鼠缺氧/复氧诱导心肌细胞凋亡的影响[J].中华急诊医学杂志,2006,15(4):331-334.
[9]Wang Z,Cui M,Sun L,et al.Angiopoietin-1 protects H9c2 cells from H2O2-induced apoptosis through AKT signaling[J].Biochem Biophys Res Commun,2007,359(3):685-690.
[10]Shuja F,Tabbara M,Li Y,et al.Profound hypothermia decreases cardiac apoptosis through Akt survival pathway[J].J Am Coll Surg,2009,209(1):89 -99.
[11]Hafizi S,Dam B.Signalling and functional diversity within the Axl subfamily of receptor tyrosine kinases[J].Cytokine Growth Factor Rev,2006,17(4):295-304.
[12]Fleming JV,Fontanier N,Harries DN,et al.The growth arrest genes gas5,gas6,and CHOP-10(gadd153)are expressed in the mouse preimplantation embryo[J].Mol Reprod Dev,1997,48(3):310-316.
[13]Weinger JG,Gohari P,Yan Y,et al.In brain,Axl recruits Grb2 and the p85 regulatory subunit of PI3 kinase;in vitro mutagenesis defines the requisite binding sites for downstream Akt activation[J].J Neurochem,2008,106(1):134-146.
[14]Shankar SL,O'Guin K,Kim M,et al.Gas6/Axl signaling activates the phosphatidylinositol 3-kinase/Akt1 survival pathway to protect oligodendrocytes from tumor necrosis factor alpha - induced apoptosis[J].J Neurosci,2006,26(21):5638-5648.
[15]Smolock EM,Korshunov VA.Pharmacological inhibition of Axl affects smooth muscle cell functions under oxidative stress[J].Vasc Pharmacol,2010,53(3 -4):185 -192.

