异基因骨髓细胞在致敏模型体内归巢示踪与植入分析*
许吕宏, 方建培, 翁文骏, 徐宏贵
(中山大学孙逸仙纪念医院儿科,广东 广州 510120)
某些血液系统疾病如重型β-地中海贫血、再生障碍性贫血等均长期依赖输血,造血干细胞移植是目前临床上根治此类疾病的主要途径[1]。临床研究发现,在实体器官移植或造血干细胞移植前不少患者由于多次接受同种异基因输血而致敏,高敏患者发生移植排斥的风险明显增加[2]。然而造血干细胞移植与实体器官移植亦有所不同,输注的造血干细胞循环于血液系统中,与致敏受者体内的免疫细胞及抗体接触的机会更多而更易被损伤。研究发现输血致敏的主要因素之一是血液含异基因白细胞,本课题组既往通过异基因脾细胞输注方法建立了致敏动物模型[3]。本实验拟探讨异基因骨髓细胞在致敏和非致敏受者的归巢与植入情况,为开展促进异基因造血干/祖细胞在致敏受者植入的策略研究提供实验基础。
材料和方法
1 动物及主要试剂
无特定病原体(SPF级)的C57BL/6(H-2Db)及BALB/c(H-2Dd)小鼠,均为雄性,6-8周,体重18-20 g,由中山大学实验动物中心提供并饲养。羧基荧光素二醋酸盐琥珀酰亚胺酯(5,6-carboxyfluorescein diacetate succinimidyl ester,CFSE)购自 Invitrogen,RPMI-1640培养基购自Invitrogen,FITC 标记的大鼠抗小鼠H-2Db购自PharMingen。
2 致敏模型与骨髓移植
参照文献[3]建立致敏动物模型,以C57BL/6小鼠脾细胞作为刺激源,BALB/c小鼠作为致敏受者。分离C57BL/6小鼠股骨及胫骨的骨髓,洗涤后用RPMI-1640培养基将细胞浓度调为5×1010/L,台盼蓝染色检测细胞活力(>99%)。部分骨髓细胞予荧光染料CFSE体外标记进行归巢实验。供者骨髓细胞于照射后4 h经尾静脉注射0.2 mL(1×107)到致敏BALB/c小鼠;取正常BABL/c小鼠作为非致敏模型。移植的致敏及非致敏受者各25只,同时取单纯照射未移植的BABL/c小鼠10只作为空白对照组。
3 供者细胞标记及在受者体内归巢示踪
3.1 CFSE标记供者细胞 CFSE是一类透膜荧光染料,可用于标记细胞浆内的蛋白质[4]。分离供者C57BL/6或BALB/c小鼠骨髓细胞后,以红细胞裂解液溶解红细胞,应用PBS缓冲液将其浓度调整为(1-5)×1010/L,加入终浓度10 μmol/L 的 CFSE,置于37℃孵育10 min后,再与5倍体积含10%小牛血清的冷RPMI-1640完全培养液于-20℃孵育5 min以结束染色。应用PBS缓冲液洗涤细胞3次,RPMI-1640完全培养液调整细胞浓度,然后将细胞移植到受鼠体内进行示踪检查。染色后即时取少量细胞悬液,应用流式细胞仪检测绿色荧光,激发光波长为488 nm。同时取部分染色后的细胞于37℃、体积分数5%CO2及饱和湿度的培养箱中培养48 h,应用流式细胞仪及荧光显微镜观察细胞荧光强度的变化。
3.2 供者细胞在移植受者各组织体内归巢示踪于移植后第2 h、12 h及48 h处死移植受者,制备致敏模型的脾脏、股骨细胞悬液及眼静脉血,以Tris-NH4Cl溶液溶解红细胞,流式细胞仪检测绿色荧光的频率(激发光波长为488 nm)。
4 供者细胞在受者体内植入分析
4.1 生存分析 移植后每日观察致敏模型的生存状况,记录死亡时间,绘制生存曲线。
4.2 外周血象及骨髓细胞恢复 移植后每周从致敏模型尾静脉采血20 μL,并用KX-21血细胞计数仪(Sysmex)检测外周血白细胞、血红蛋白及血小板等。同时每周分离致敏及非致敏受者的股骨,计数每根股骨中骨髓细胞的数量。
4.3 嵌合分析 移植后每周将受者骨髓细胞重悬于100 μL PBS缓冲液,加入1 μL FITC 标记的大鼠抗小鼠H-2Db抗体,混匀后置于4℃冰箱内避光孵育20 min。加入2 mL PBS缓冲液洗涤,1200 r/min离心5 min,弃上清后将细胞重悬于400 μL PBS缓冲液中,应用流式细胞仪检测,同时分别取BALB/c及C57BL/6小鼠骨髓细胞作阴性对照及阳性对照。
5 统计学处理
采用SPSS 16.0统计软件,计量资料以均数±标准差()表示,应用t检验或单因素方差分析;绘制Kaplan-Meier生存曲线并进行log-rank检验,检验水准设α=0.05。
结 果
1 荧光染料CFSE标记供者骨髓细胞
本实验应用CFSE标记C57BL/6小鼠骨髓细胞,流式细胞仪检测结果示标记率为(99.25±0.33)%,将细胞于体外培养48 h后再次检测其标记率为(99.05±0.27)%,两者差异无显著(P>0.05)。图1显示CFSE荧光染料标记骨髓细胞48 h后在倒置显微镜下和绿色荧光显微镜下的情况,细胞仍保持很高的绿色荧光强度,说明CFSE适用于体内动态示踪研究。
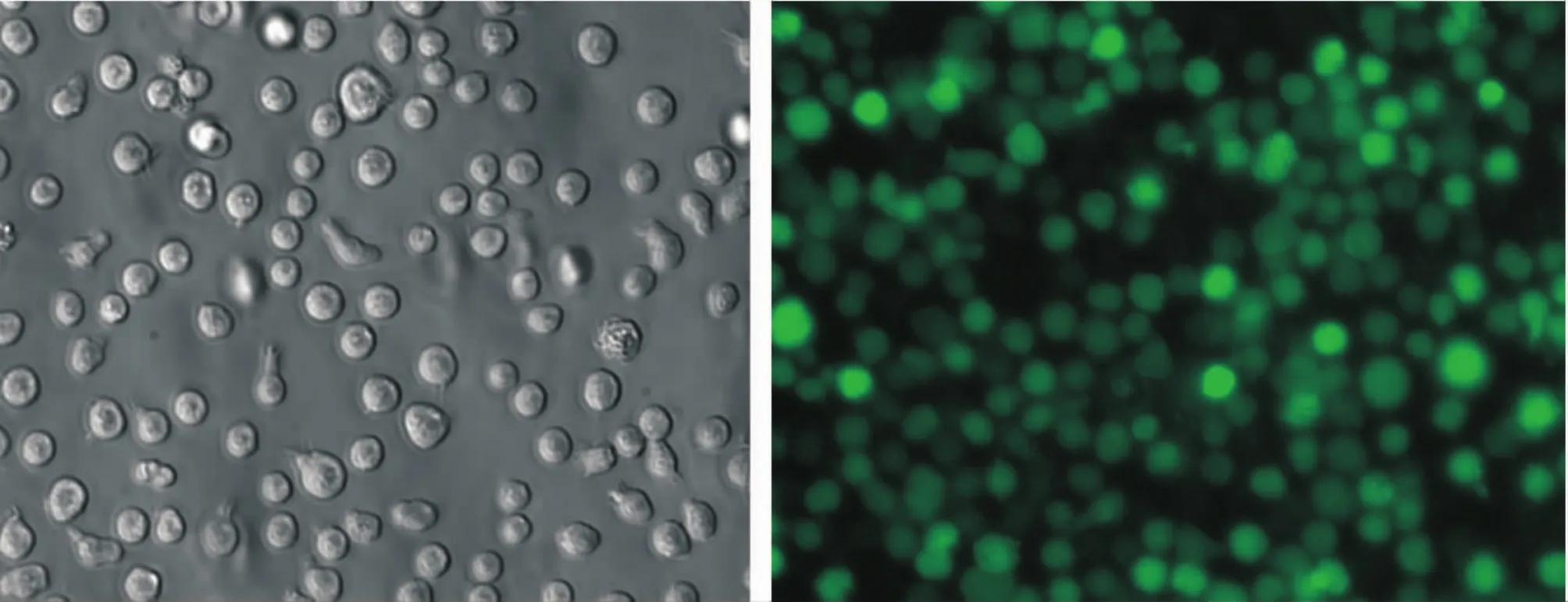
Figure 1.The photos of bone marrow cells labeled with CFSE at 48 h(×100).A:cells under inverted microscope;B:cells under fluorescence microscope.图1 CFSE标记骨髓细胞48 h在倒置显微镜和荧光显微镜下的情况
2 供者骨髓细胞在致敏模型的归巢示踪
移植后2 h、12 h、48 h取移植受者外周血、骨髓及脾脏制备单个细胞悬液,应用流式细胞仪检测供者骨髓细胞(即CFSE+细胞)在各组织中的分布情况。结果如图2所示,移植后第2 h,供者细胞在致敏受者体内股骨及脾脏的分布与非致敏受者相比,差异无显著(P>0.05),但供者细胞在非致敏受者外周血的分布是非致敏组的3倍,差异显著(P<0.01);移植后第12 h,供者细胞在非致敏受者外周血、股骨及脾脏的分布是致敏组的7.20倍(P<0.01)、1.05倍(P<0.05)和2.97倍(P<0.01),差异均显著;移植后第48 h,供者细胞在非致敏受者外周血、股骨及脾脏的分布是致敏组的33.00倍、3.04倍和27.32倍,差异显著(均P<0.01)。
3 致敏模型接受移植后的生存分析
如图3显示各组动物生存曲线,经8 Gy[60Co]照射后的BALB/c小鼠,若单纯照射而不予骨髓移植均在照射后10-16 d全部死亡,生存中位数为14 d。而照射后非致敏BALB/c小鼠经尾静脉移植1×107C57BL/6骨髓细胞后能全部存活。然而同样经8 Gy[60Co]照射预处理及尾静脉移植1×107C57BL/6骨髓细胞,致敏组受者均于移植后2周左右全部死亡,生存中位数为13 d。Log-rank检验发现致敏组与单纯照射移植组的差异无显著(P>0.05);但致敏组与非致敏组差异显著(P<0.01)。
4 移植后受者外周血和骨髓细胞恢复情况与嵌合分析

Figure 2.Homing trace of CFSE+donor bone marrow cells in different tissues of recipients at different time points after transplantation.A:2 h after transplantation;B:12h after transplantation;C:48 h after transplantation.*P <0.05,**P <0.01 vs non - sensitized recipients.图2 移植后不同时点CFSE+供者骨髓细胞在受者体内不同组织的归巢示踪
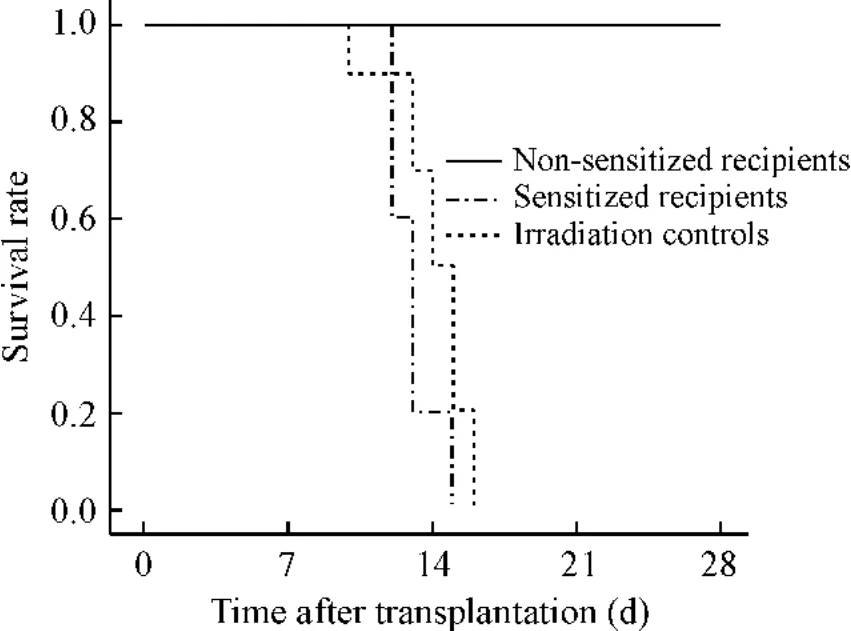
Figure 3.Survival curves of recipients under irradiation with/without transplantation.图3 单纯照射及照射移植后受者的生存曲线
非致敏组受者予C57BL/6供者的骨髓细胞后其外周血象及股骨骨髓细胞计数随时间推移而逐渐升高,而致敏组受者同样予移植后其外周血象及股骨骨髓细胞计数随时间推移均呈进行性下降,并出现明显的贫血、出血等征象。如表1所示,移植后第7 d及第14 d,致敏组外周血白细胞及股骨骨髓细胞计数均明显低于非致敏组(P<0.05)。
本实验应用正常BALB/c及C57BL/6小鼠股骨骨髓细胞作为阴性对照及阳性对照,检测其H-2Db+细胞水平分别为(0.09±0.06)%和(99.78±0.20)%。骨髓移植后第7 d,取非致敏组与致敏组的骨髓细胞检测H-2Db+细胞水平,结果分别为(48.07±4.70)%和(0.77±0.11)%,两者差异显著(P<0.01)。移植后第14 d,H-2Db+细胞在非致敏组骨髓中百分比为(90.26±4.20)% ,说明供者细胞在非致敏受者体内呈稳定植入状态;而致敏组由于骨髓细胞过少,未能进行H-2Db检测。
表1 移植后受者白细胞、骨髓细胞恢复情况及嵌合分析Table 1.White blood cell(WBC)and bone marrow cells(BMCs)recovery and chimera analysis in recipients after transplantation(.n=5)
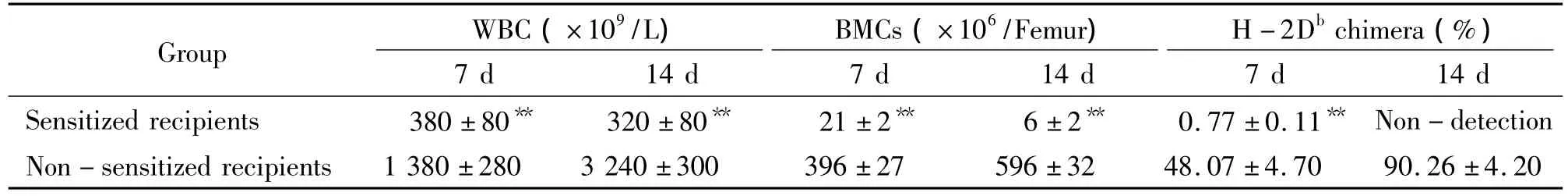
表1 移植后受者白细胞、骨髓细胞恢复情况及嵌合分析Table 1.White blood cell(WBC)and bone marrow cells(BMCs)recovery and chimera analysis in recipients after transplantation(.n=5)
**P <0.01 vs non - sensitized recipients at the same time point.
BMCs(×106/Femur)Group WBC(×109/L)H-2Dbchimera(%)7 d 14 d 7 d 14 d 7 d 14 d Sensitized recipients 380 ±80** 320 ±80** 21 ±2** 6 ±2** 0.77 ±0.11**Non-detection Non-sensitized recipients 1380±280 3240±300 396±27 596±32 48.07±4.70 90.26±4.20
讨 论
本实验应用荧光染料CFSE标记异基因供者骨髓细胞,结果显示体外培养至48 h,细胞形态、荧光强度无明显改变;同时应用流式细胞仪检测,结果示标记阳性率达99%。进行体内示踪的移植受者无异常表现,说明CFSE有较好的标记率和安全性。归巢示踪结果发现移植后第2 h,供者细胞在致敏受者外周血的分布有所减少;移植后第12 h及48 h,供者细胞在致敏受者外周血、股骨及脾脏的分布均较非致敏组明显减少,说明供者细胞在这些组织中被破坏。我们实验还发现,供者骨髓细胞在非致敏受者股骨中的分布于移植后第48 h的分布比第12 h分布增加了1倍,说明供者骨髓细胞在受者体内进行增殖分化。而在致敏组中,供者骨髓细胞于移植后第48 h在受者股骨的分布反而比第12 h的分布还少,说明致敏受者骨髓微环境可能还影响异基因骨髓细胞的增殖与分化。植入分析结果发现在非致敏组中,移植后受者能长期存活。移植后每周取外周血及骨髓细胞分析,结果发现其外周血象及骨髓细胞的数量均随时间推移而进行性增加,嵌合体分析也进一步证实异基因骨髓在非致敏受者体内完全植入。而在致敏组中,致敏受者经致死量照射后移植,2周左右全部死亡。血象及骨髓象均显示随时间推移而呈进行性下降。嵌合体分析结果也说明致敏受者排斥异基因供者骨髓细胞。
有关异基因骨髓细胞在致敏模型中被排斥的机制尚未明确,一般认为与受者体内记忆性免疫细胞及预存的抗体有关,其中抗体介导的移植排斥占主要地位。抗体可能通过多种机制损伤造血干细胞,如抗体能与异基因骨髓细胞MHC分子结合,通过补体依赖或抗体依赖细胞介导的细胞毒性作用等途径杀伤异基因骨髓细胞[5]。有研究表明此抗体的作用具有供者特异性,对无关供者或全相合骨髓细胞无杀伤作用[6]。另一方面,有研究认为致敏受者血清可影响造血祖细胞的增殖与分化。临床实验中,国外有学者将再障患者血清与骨髓细胞体外孵育培养,结果发现能明显抑制造血细胞集落的形成[7]。最近我们课题组检测15份重型β地中海贫血患儿血清,发现患儿血清中群体反应性抗体阳性标本有6例,阳性检出率为40%,抗体强度在14% -75%;分离脐血CD34+细胞作为造血干/祖细胞,通过体外集落培养也发现血清群体反应性抗体能明显抑制各种细胞集落形成[8,9]。
如何促进异基因骨髓细胞在致敏受者体内植入是目前研究的热点。临床治疗高敏患者的措施有应用免疫抑制剂、单克隆抗体、免疫吸附、血浆置换等[10]。最近Xu等[11]在致敏动物模型的移植实验中发现,增加预处理方案的强度能有效清除致敏免疫细胞,但不能防止致敏受者体内抗体介导的移植排斥。他们研究还发现,应用免疫球蛋白、抗CD19及抗B220单抗等均不能提高异基因骨髓细胞在致敏模型的植入。最近我们应用抗CD20单抗进行干预,发现能杀伤受者B细胞,降低致敏程度,但不能有效促进异基因造血干细胞在致敏受者的植入[12]。本实验表明,异基因供者骨髓细胞在致敏受者体内脾脏及股骨等部位被清除,产生移植排斥。进一步探讨致敏移植新策略将是未来的研究方向。
[1]Gaziev J,Lucarelli G.Hematopoietic stem cell transplantation for thalassemia [J].Curr Stem Cell Res Ther,2011,6(2):162-169.
[2]Ciurea SO,de Lima M,Cano P,et al.High risk of graft failure in patients with anti-HLA antibodies undergoing haploidentical stem -cell transplantation[J].Transplantation,2009,88(8):1019-1024.
[3]许吕宏,方建培,徐宏贵,等.致敏动物模型的建立及其对造血干细胞植入的影响[J].中国实验血液学杂志,2008,16(6):1339-1343.
[4]Quah BJ,Warren HS,Parish CR.Monitoring lymphocyteproliferation in vitro and in vivo with the intracellularfluorescent dye carboxyfluorescein diacetate succinimidyl ester[J].Nat Protoc,2007,2(9):2049 -2056.
[5]Taylor PA,Ehrhardt MJ,Roforth MM,et al.Preformed antibody,not primed T cells,is the initial and major barrier to bone marrow engraftment in allosensitized recipients[J].Blood,2007,109(3):1307 -1315.
[6]Colson YL,Schuchert MJ,Ildstad ST.The abrogation of allosensitization following the induction of mixed allogeneic chimerism[J].J Immunol,2000,165(2):637 -644.
[7]Barrett AJ,Faille A,Saal F,et al.Marrow graft rejection and inhibition of growth in culture by serum in aplastic anaemia[J].J Clin Pathol,1978,31(12):1244 -1248.
[8]翁文骏,方建培,吴燕峰,等.地中海贫血患儿血清特异性PRA影响脐血造血干细胞增殖、分化能力的观察[J].中国病理生理杂志,2007,23(11):2200 -2204.
[9]Fang JP,Xu LH,Yang XG,et al.Panel reactive antibody in thalassemic serum inhibits proliferation and differentiation of cord blood CD34+cells in vitro[J].Pediatr Hematol Oncol,2009,26(5):338 - 344.
[10]Vo AA,Peng A,Toyoda M,et al.Use of intravenous immune globulin and rituximab for desensitization of highly HLA-sensitized patients awaiting kidney transplantation[J].Transplantation,2010,89(9):1095-1102.
[11]Xu H,Chilton PM,Tanner MK,et al.Humoral immunity is the dominant barrier for allogeneic bone marrow engraftment in sensitized recipients[J].Blood,2006,108(10):3611-3619.
[12]许吕宏,方建培,Le Yi,等.抗CD20单抗在致敏受者造血干细胞移植中应用的实验研究[J].中国病理生理杂志,2009,25(10):2040-2043.

