热休克蛋白参与PI3K/Akt介导H2O2预处理的抗凋亡作用*
张 梅, 李 卫, 郭瑞鲜, 罗健东, 冯鉴强△
(1 广州医学院药理教研室,广东 广州510082;2 暨南大学附属第一医院神经外科,广东 广州510632;3中山大学中山医学院生理教研室,广东 广州510080)
适应性细胞保护是指某些“亚伤害性”应激预处理可以减轻后续更严重的损害。作为机体维持稳态的天然机制,适应性细胞保护是在不改变攻击因子性质的情况下,通过外源性的适宜刺激(预处理)调动机体自身的防护机制,加强细胞对损伤的抵抗能力。适应性细胞保护作用的存在为主动防治某些疾病提供了可能。本课题组利用肾上腺嗜铬细胞瘤(PC12)细胞建立了H2O2预处理诱导的适应性细胞保护模型,以期为防御氧化应激对多巴胺能神经元的损伤提供依据。前期研究表明,H2O2预处理诱导的适应性保护反应通过多种分子机制发挥抗细胞凋亡作用,涉及到几条信号通路的激活。其中细胞内一氧化氮合酶和环氧合酶2,以及JAK-STAT 和NF-κB 信号通路的激活均参与了这种适应性保护反应[1-3]。虽然H2O2预处理通过激活相关的分子和信号转导途径发挥其细胞保护作用,但是何种效应蛋白作为这种适应性保护功能的执行者却尚未清楚。热休克蛋白(heat-shock proteins,HSP)是机体面对多种应激原如热、活性氧、DNA 损伤、缺血、缺氧、炎症刺激时,产生的一组能够结合细胞内具有重要功能蛋白的蛋白质,它的生理功能之一是对应激状态下的细胞提供保护[4,5]。
磷脂酰肌醇3-激酶/Akt (phosphatidylinositol 3-kinase/Akt,PI3K/Akt)信号通路参与多种细胞功能的调节,是神经元存活的主要途径之一。我们最近的研究显示,在PC12 细胞,H2O2预处理可引起Akt 活化,并且PI3K/Akt 通路的激活发挥了抗细胞凋亡的作用,参与H2O2预处理诱导的适应性保护反应[6]。HSP 作为在众多应激情况下发挥保护作用的效应蛋白,是否参与PI3K/Akt 信号通路介导的H2O2预处理诱导的抗细胞凋亡作用,本文拟对此进行探讨。
材 料 和 方 法
1 材料
RPMI-1640 培养基购自Gibco-BRL,小牛血清购自HyClone。30% H2O2为Alfa Aesar 产品。Hoechst33258、胰蛋白酶、BSA、HEPES、EDTA、DMSO、碘化丙啶(propidium iodide,PI)、槲皮素(quercetin)、17-烯丙氨基-17-脱甲氧基格尔德霉素(17-allylamino-17-demethoxygeldanamycin,17-AAG)和LY294002 均购自Sigma。HSP70、HSP90 抗体和化学发光试剂盒(Amersham ECL Kit)购自Cell Signaling Technology (CST);β-actin 及HRP 标记的Ⅱ抗为Santa Cruz 产品。BCA 蛋白定量试剂盒购自Pierce。Caspase-3 活性测定试剂盒为德国默克产品。
2 方法
2.1 细胞培养和预处理方法 PC12 细胞由中山大学实验动物中心提供。于37 ℃、5%CO2的条件下,用含10%马血清和5%胎牛血清的RPMI-1640 培养基进行培养,选取对数生长期的细胞进行实验。H2O2预处理的实施方法如下:100 μmol/L H2O2作用PC12 细胞90 min 后,撤去H2O2,继续常规培养24 h,再给予300 μmol/L H2O2作用12 h。PI3K 抑制剂LY294002(25 μmol/L)、HSP70 抑制剂quercetin(50μmol/L)和HSP90 抑制剂17-AAG(100 nmol/L)分别在预处理前30 min 加入培养液。
2.2 细胞凋亡的检测
①Hoechst33258 染色观察细胞凋亡形态变化 细胞接种于培养板内,按实验要求给以不同的处理因素,处理终止后弃去培养液,细胞用PBS 洗2 次,加入新鲜配制的4%多聚甲醛,4 ℃固定细胞10 min,PBS 冲洗1 次,加5 mg/L Hoechst 33258 避光染色10 min,PBS 冲洗2 次,荧光显微镜下观察、摄片。
②PI 染色流式细胞仪(FCM)检测细胞凋亡率 细胞按实验要求给予不同因素处理后,离心收集细胞,PBS 洗2 次,加入预冷的70%乙醇4 ℃固定过夜。测定前离心弃去乙醇,细胞重悬于含有100 mg/L 碘化丙啶(PI)和2 ×104U/L RNase A 的染色液中,室温避光染色30 min。流式细胞仪检测凋亡率(激发波长:488 nm;发射波长:610 nm)。每样本计数12 000 个细胞,采用荧光强度值并以Multicycle 软件处理结果,计算凋亡率。
③Caspase-3 活性测定 Caspase-3 的活性测定根据试剂盒的说明进行,按实验分组给以不同的处理因素后,离心收集细胞,使用冰冷的PBS 洗涤细胞2次。裂解缓冲液(Tris-HCl 50 mmol/L,pH 7.4,1 mmol/L EDTA,1 mmol/L PMSF,1%Triton X-100)重悬细胞,冰上孵育20min,间以振荡。细胞裂解物在4 ℃、10 000 ×g 离心5 min,取上清。进行蛋白含量测定。上清内加入反应试剂(HEPES 20 mmol/L,DTT 2 mmol/L,10% glycerin,pH 7.5)后,与caspase-3 的底物在37 ℃孵育4 h,405 nm 处测定吸光度值。
2.3 免疫印记法(Western blotting)检测HSP70 和HSP90 的表达 经实验因素处理后消化、离心收集细胞。冰冷的PBS 洗涤细胞2 次,再加入裂解缓冲液(50 mmol/L Tris-HCl,150 mmol/L NaCl,0.2 g/L NaN3,1 g/L SDS,1.0 mmol/L PMSF,5 mg/L aprotinin,1.0 g/L NP40,5.0 g/L 脱氧胆酸钠,pH 8.0)振荡混匀,冰浴30 min。离心细胞裂解物(4 ℃12 000×g 离心5 min),取上清保存于-80 ℃。BCA 蛋白定量试剂盒用来进行蛋白定量。调整样品的蛋白量进行SDS-PAGE,电泳分离后的蛋白转移到PVDF膜上(100 V 真空电转移1 h)。PBST 溶液用来洗膜5 min。室温下用含5%脱脂奶粉的PBST 溶液封闭PVDF 膜1 h。随后加入Ⅰ抗(1∶1 000)4 ℃孵育过夜。PBST 溶液洗膜3 次,每次5 min。加入相应的Ⅱ抗(1∶1 000),孵育1 h,漂洗3 次,每次5 min。将PVDF 膜用化学发光试剂ECL 染1 min,暗室中曝光到X 光片上。凝胶成像系统扫描分析结果。
3 统计学处理
实验数据经统计软件(SPSS 14.0)分析,用均数±标准差(±s)表示,组间比较用单因素方差分析(Oneway ANOVA)检验,用最小有意义差异检验(least significant difference,LSD 和SNK)进行均数间的多重比较,检验水准α=0.05。每组实验均重复3-6 次。
结 果
1 LY294002 拮抗H2O2 预处理的抗细胞凋亡作用
1.1 凋亡细胞的形态变化 结果显示,正常生长的PC12 细胞的胞核呈现弥散均匀荧光,核无固缩,为体积较大的浅染核形态,见图1A;300 μmol/L 的H2O2作用12 h 后,细胞核的染色质凝集、边缘化,胞核染色质裂解为块状,产生凋亡小体等典型的凋亡特征,见图1B;预处理则明显减少300 μmol/L H2O2引起细胞凋亡,见图1C。而在预处理前给予LY294002 则可使凋亡细胞的数量增加,见图1D。
1.2 Caspase-3 活性的变化 300 μmol/L H2O2引起PC12 细胞的caspase-3 活性显著升高,提示H2O2诱导的凋亡依赖于caspase-3 的活化。H2O2预处理可以明显降低300 μmol/L H2O2引起的caspase-3 活性升高,而ly294002 可以阻断H2O2预处理降低caspase-3 活性的作用,见图2。
2 Quercetin 和17-AAG 拮抗H2O2 预处理的抗细胞凋亡作用
2.1 凋亡细胞的形态变化 Hoechst 33258 染色结果显示,在H2O2预处理前分别给予quercetin 和17-AAG,拮抗了H2O2预处理引起的细胞保护作用,使凋亡细胞的数量增加,见图3。
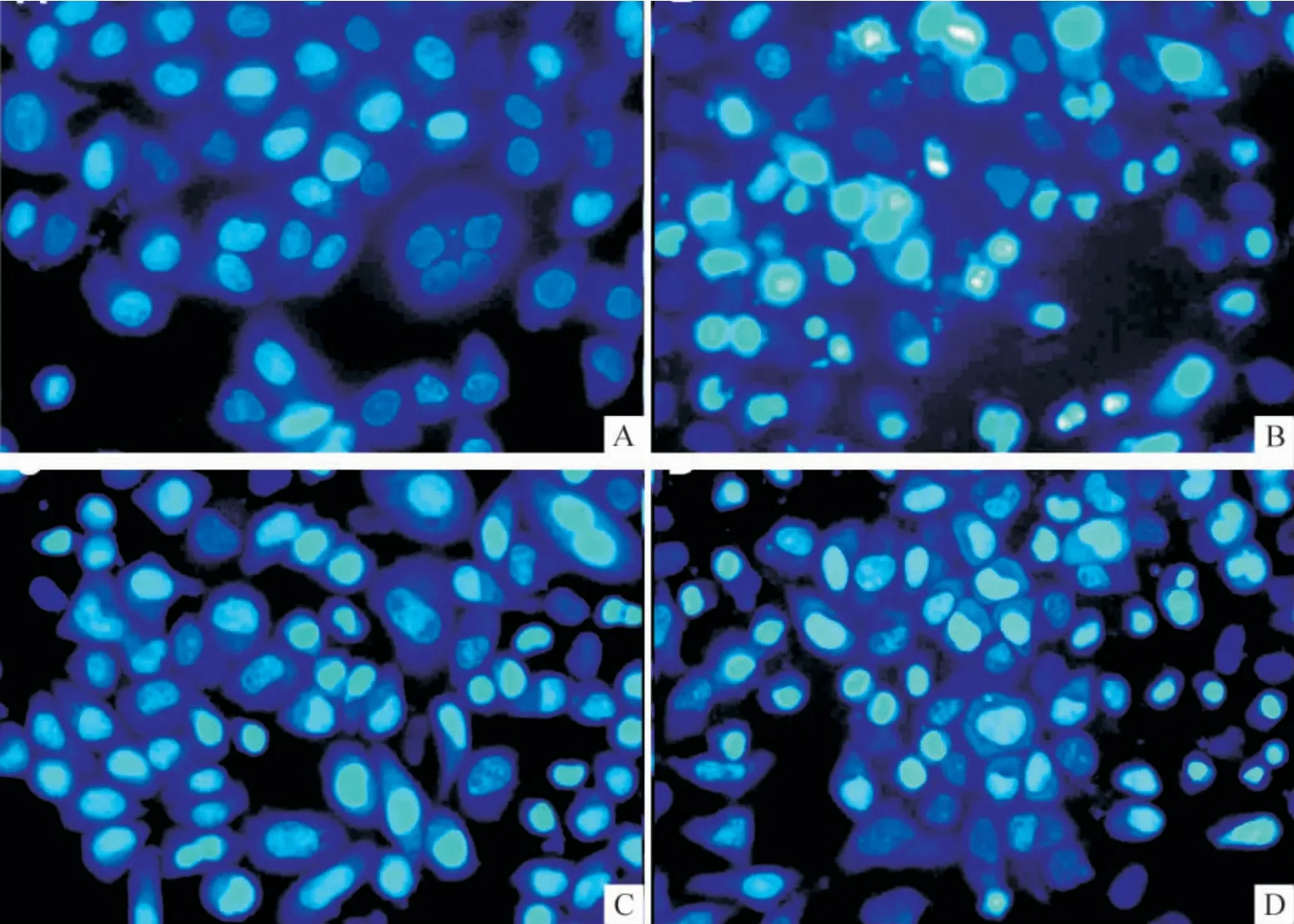
Figure 1. Effect of LY294002 on anti-apoptosis induced by H2O2 preconditioning(Hoechst 33258 staining,×200).The morphological changes of apoptotic cells were assessed by Hoechst 33258 staining. A:untreated cells (control);B:cells treated with 300 μmol/L H2O2 for 12 h;C:cells preconditioned with 100 μmol/L H2O2 for 90 min before treatment with 300 μmol/L H2O2;D:pretreatment with 25 μmol/L LY294002 30 min before H2O2 preconditioning.图1 LY294002 对H2O2 预处理抗细胞凋亡的影响

Figure 2. Effect of LY294002 on inhibition of caspase-3 activity induced by H2O2 preconditioning(PC).Caspase-3 activity was detected by colorimetry. PC12 cells were treated with the indicated treatments and divided into 6 groups as previous description. ±s.n =6. ##P <0.01 vs control;**P <0.01 vs H2O2 group;△△P <0.01 vs PC+ H2O2 group.图2 LY294002 对H2O2 预处理抑制caspase-3 活性的影响
2.2 细胞凋亡率的变化 流式细胞仪的检测结果显示:PC12 细胞经100 μmol/L H2O2预处理后,可使300 μmol/L H2O2引起的细胞凋亡率由(65.5±4.1)%下降至(37.1 ±2.3)%,P <0.01,而在H2O2预处理前分别给予quercetin 和17-AAG,细胞的凋亡率从(37.1±2.3)%上升至(53.6 ±5.2)%和(58.5 ±3.6)%,P <0.01,溶剂(quercetin 和17-AAG 的溶媒)处理没有诱导细胞凋亡的作用,见图4。
3 LY294002 对H2O2 预处理上调HSP70 和HSP90表达的影响
Western blotting 结果显示,100 μmol/L H2O2和300 μmol/L H2O2均增加细胞内HSP70 和HSP90 的表达,但在H2O2损伤前给予预处理能明显提高细胞内HSP70 和HSP90 的表达。而LY294002 抑制了H2O2预处理诱导的HSP70 及HSP90 表达上调,见图5。
讨 论
早期的研究发现,适应性细胞保护作用是由预处理因素诱导产生的蛋白质所介导,抑制蛋白质的合成则消除了这种保护作用[7]。而对预处理因素反应的保护性蛋白质的性质在很大程度上是未知的。HSP 作为细胞内最重要的分子伴侣,除参与细胞内一些重要蛋白质分子的构象及稳定性调节之外,另一重要生理功能是对应激状态下的细胞提供保护[4,5]。通常认为HSP 可以通过阻断细胞重要蛋白质的变性及聚合而达到保护细胞的作用,但近年来的研究证实HSP 蛋白家族的重要成员如HSP70、HSP90 可以直接作用于细胞的抗凋亡机制,在细胞的抗凋亡反应中起着重要作用[8-10]。

Figure 3. Effects of quercetin and 17-AAG on anti-apoptosis induced by H2O2 preconditioning(Hoechst 33258 staining,×200).A:untreated cells (control);B:cells treated with 300 μmol/L H2O2 for 12 h;C:cells preconditioned with 100 μmol/L H2O2 for 90 min before treatment with 300 μmol/L H2O2;D:pretreatment with 50 μmol/L quercetin 30 min before H2O2 preconditioning;E:pretreatment with 100 nmol/L 17-AAG 30 min before H2O2 preconditioning;F:cells treated with vehicle.图3 Quercetin 和17-AAG 对H2O2 预处理抗细胞凋亡的影响

Figure 4. Effects of quercetin and 17-AAG on anti-apoptosis induced by H2O2 preconditioning(FCM assay). A:untreated cells(control);B:cells treated with 300 μmol/L H2O2 for 12 h;C:cells preconditioned with 100 μmol/L H2O2 for 90 min before treatment with 300 μmol/L H2O2;D:pretreatment with 50 μmol/L quercetin 30 min before H2O2 preconditioning;E:pretreatment with 100 nmol/L 17-AAG 30 min before H2O2 preconditioning;F:cells treated with vehicle. ±s.n=6. **P<0.01 vs H2O2 group;##P <0.01 vs PC+ H2O2 group.图4 Quercetin 和17-AAG 对H2O2 预处理抗细胞凋亡的影响
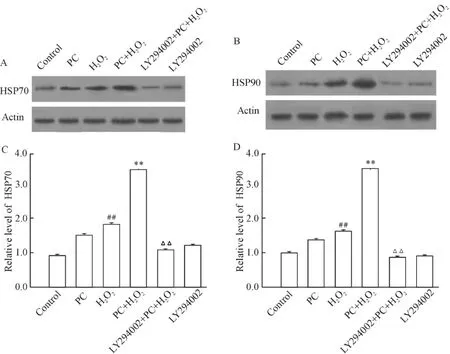
Figure 5. Effect of LY294002 on up-regulation of HSP70 and HSP90 induced by H2O2 preconditioning.The expression of HSP70 and HSP90 were detected by Western blotting. PC12 cells were treated with the indicated treatments and divided into 6 groups as previous description. ±s.n=3. ##P <0.01 vs control;**P <0.01 vs H2O2 group;△△P <0.01 vs PC+ H2O2 group.图5 LY294002 对H2O2 预处理上调HSP70 和HSP90 表达的影响
本课题组最近的研究结果表明,PI3K/Akt 通路介导了H2O2预处理诱导的适应性细胞保护作用[6]。本研究首先观察了阻断PI3K/Akt 通路对H2O2预处理抗凋亡作用的影响。细胞凋亡分析的结果显示,高浓度的H2O2诱导细胞凋亡,H2O2预处理使PC12细胞提高对高浓度H2O2的抵抗能力,减少细胞的凋亡。但是在H2O2预处理前使用PI3K/Akt 通路抑制剂LY294002,则拮抗了H2O2预处理诱导的抗细胞凋亡作用。Caspase-3 是凋亡蛋白酶级联反应的最终通路,H2O2预处理可以降低高浓度H2O2引起的caspase-3 活性升高,在预处理前使用LY294002 拮抗了这一作用,说明PI3K/Akt 通路介导的H2O2预处理的抗细胞凋亡作用是通过抑制caspase-3 的活性而实现。为了观察热休克蛋白在H2O2预处理诱导的抗细胞凋亡中的作用,分别在预处理前使用HSP70 和HSP90 的抑制剂quercetin 和17-AAG。对细胞凋亡的分析显示,quercetin 和17-AAG 拮抗了H2O2预处理诱导的细胞保护作用,使细胞凋亡增加。
既然PI3K/Akt 通路和热休克蛋白均参与了H2O2预处理诱导的细胞保护作用,为了明确HSP 是否参与PI3K/Akt 通路介导的这一抗细胞凋亡作用,在H2O2预处理前给予LY294002,观察对HSP70 和HSP90 表达的影响。结果显示,H2O2(预处理剂量和损伤剂量)均可以引起HSP70 和HSP90 的表达升高,说明在氧化应激情况下,热休克蛋白的表达增多可能作为机体的一个适应性反应。在高浓度H2O2损伤前给予预处理则明显增加HSP70 和HSP90 的表达。有意思的是,使用LY294002 能够明显抑制H2O2预处理诱导的HSP70 和HSP90 表达上调,表明PI3K/Akt 通路介导了H2O2预处理增加HSP70 和HSP90 表达的作用。
在面对氧化应激的挑战中,一些分子信号事件和基因程序可以被激活,最终发展成为对氧化损伤的抵抗能力。本研究观察到PI3K/Akt 通路和热休克蛋白均参与H2O2预处理诱导的细胞保护作用。PI3K/Akt 通路抑制剂LY294002 在拮抗H2O2预处理诱导的抗细胞凋亡作用的同时,也明显地抑制HSP70 和HSP90 的表达,提示在H2O2预处理诱导的适应性保护反应中,PI3K/Akt 通路的激活促进了HSP70 和HSP90 的表达,而HSP70 和HSP90 作为PI3K/Akt 通路激活后的效应蛋白,参与PI3K/Akt 介导的H2O2预处理的抗细胞凋亡作用。
[1] Tang XQ,Yu HM,Zhi JL,et al. Inducible nitric oxide synthase and cyclooxygenase-2 mediate protection of hydrogen peroxide preconditioning against apoptosis induced by oxidative stress in PC12 cells[J]. Life Sci,2006,79(9):870-876.
[2] Yu HM,Zhi JL,Cui Y,et al. Role of the JAK-STAT pathway in protection of hydrogen peroxide preconditioning against apoptosis induced by oxidative stress in PC12 cells[J]. Apoptosis,2006,11(6):931-941.
[3] Zhang M,Guo RX,Mo LQ,et al. Nuclear factor-κB mediates cytoprotection of hydrogen peroxide preconditioning against apoptosis induced by oxidative stress in PC12 cells[J]. Clin Exp Pharmacol Physiol,2009,36(3):304-311.
[4] Stetler RA,Gan Y,Zhang W,et al. Heat shock proteins:cellular and molecular mechanisms in the central nervous system[J]. Prog Neurobiol,2010,92(2):184-211.
[5] Padmini E. Physiological adaptations of stressed fish to polluted environments:role of heat shock proteins[J].Rev Environ Contam Toxicol,2010,206:1-27.
[6] 张 梅,李 卫,郭瑞鲜,等. PI3K/Akt 通路介导H2O2预处理减轻PC12 细胞氧化损伤[J]. 基础医学与临床(已录用)
[7] Wiese AG,Pacifici RE,Davies KJ. Transient adaptation to oxidative stress in mammalian cells[J]. Arch Biochem Biophys,1995,318(1):231-240.
[8] 王 轩,贾丽丽,孙保亮,等.脑淋巴引流阻滞后蛛网膜下腔出血兔脑脊液对PC12 细胞的损伤作用[J]. 中国病理生理杂志,2010,26(1):91-95.
[9] Fujita N,Sato S,Ishida A,et al. Involvement of Hsp90 in signaling and stability of 3-phosphoinositide-dependent kinase-1[J]. J Biol Chem,2002,277(12):10346-10353.
[10] Mayer MP,Bukau B. Hsp70 chaperones:cellular functions and molecular mechanism[J]. Cell Mol Life Sci,2005,62(6):670 –684.

