胃萎消颗粒治疗大鼠慢性萎缩性胃炎的实验研究
李 艳 ,罗兴菊 ,陈 骏 ,文家萍 ,郭莲军
1.湖北省宜昌市夷陵医院,湖北宜昌 443100;2.湖北省宜昌市夷陵区医疗保险局,湖北宜昌 443100;3.华中科技大学同济医学院,湖北武汉 430030
慢性萎缩性胃炎(CAG)是消化系统疾病治疗中的难点之一,属于癌前病变,对人类健康威胁较大[1]。现代医学除密切随访和手术治疗外,尚无其他较好的治疗方法。临床实践表明,中医中药治疗本病有较为满意的效果,显示了其广阔的发展前景[2]571-574,[3]。胃萎消颗粒由隔山消、枳实、黄连、党参、三七等11味中药组成,具有养阴益气、健脾导滞、祛瘀生新之功效。本实验采用热盐水灌胃致CAG动物模型,观察胃萎消颗粒对其治疗作用,并探讨其机制。现将结果报道如下:
1 材料与方法
1.1 仪器
SN-682型放射免疫γ计数器(上海核福光电仪器有限公司);DL-8R冷冻离心机(上海离心机械研究所);胃泌素(GAS)、胃动素(MTL)放射免疫试剂盒(北京华英生物技术研究所)。
1.2 试药
胃萎消颗粒 (湖北宜昌市夷陵医院制剂室制备,批号:20080913),处方组成为隔山消、黄连、枳实、党参、白术、茯苓、三七、白芍、法半夏、甘草、干姜,使用蒸馏水配制成适用浓度的混悬液。
1.3 动物
SD大鼠110只,体质量200~213 g,♂,由华中科技大学同济医学院实验动物中心提供,于普通级动物观察室饲养。实验动物质量合格证号:医动字第19-025号。随机将110只SD大鼠分为5组,每组各22只,即正常对照组、模型对照组和胃萎消高、中、低剂量组。
1.4 方法
1.4.1 模型制作及给药方法 除正常对照组外,其余各组均采用热盐水灌胃方法制作CAG动物模型[4-5]。即用55℃的15%氯化钠溶液灌胃,每日1次,每次2.5 ml,共12周。实验开始,先处死10只正常对照组大鼠,并留取胃大体标本作为对照。从第3周开始,各造模组每2周处死2只大鼠,取胃标本进行病理检查。第12周末,对照组鼠胃病检无明确病态表现,其他各组胃病检均符合慢性萎缩性胃炎表现,提示造模成功。从第13周开始灌服药物治疗,至第24周末结束。其中胃萎消高、中、低剂量组分别予胃萎消颗粒相当于原生药5.00、2.50、1.25 g/(kg·d)灌胃,正常对照组和模型对照组予以等量蒸馏水灌胃。
1.4.2 检测指标 实验各组大鼠停药并禁食12 h后,每只取血4 ml,平均置于2只试管中。取一管2000 r/min离心5 min,分离血清于-20℃下保存,待测GAS;在另一试管中加入预置的 10%EDTA-Na 30 μl和抑肽酶 30 μl,充分混匀,2000 r/min离心10 min,分离血浆于-20℃下保存,待测MTL。血清GAS和血浆MTL均采用放射免疫法测定。
1.4.3 病理组织学观察 将各组大鼠剖腹取全胃,沿胃大弯剖开并用生理盐水漂洗,沿大鼠胃小弯条状取材,放入10%甲醛中固定,取腺胃前壁、小弯、后壁自幽门到前胃各取材一条约 2.5 cm×0.3 cm 切片,苏木精-伊红(HE)染色,参照 1994年美国休斯顿胃炎诊断分类标准[2],光镜下观察胃黏膜糜烂、萎缩、肠上皮化生、增生等情况。按照胃黏膜损伤的程度,分为轻、中、重、超重四个等级。损伤等级评分之和除以该组的动物数,即平均胃黏膜损伤指数。
1.4.4 统计学方法 采用SAS 6.12统计软件包进行处理数据,组间计量数据采用t检验及秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 胃萎消颗粒对大鼠血清GAS和血浆MTL的影响
CAG模型大鼠血清GAS和血浆MTL明显降低(P<0.05或P<0.01),经胃萎消颗粒治疗12周后,大鼠血清GAS和血浆MTL升高。其中胃萎消高、中剂量组MTL明显高于模型对照组(P<0.05),胃萎消各剂量组GAS均显著高于模型对照组(均P<0.05)。 见表1。
表1 胃萎消颗粒对大鼠血清GAS和血浆MTL的影响(±s)
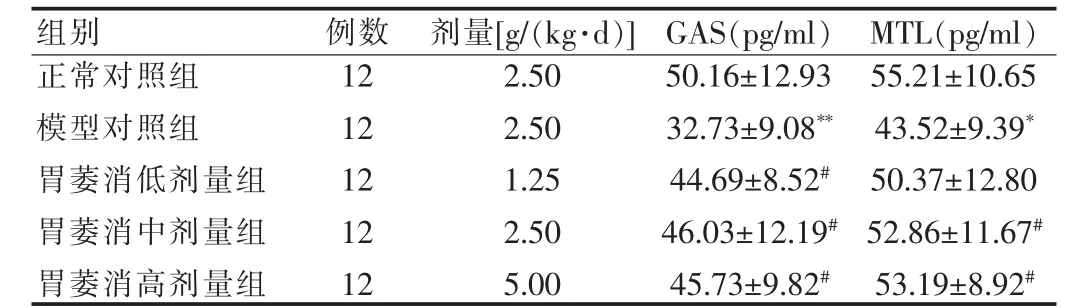
表1 胃萎消颗粒对大鼠血清GAS和血浆MTL的影响(±s)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,#P<0.05
?
2.2 胃萎消颗粒对大鼠胃黏膜损伤的影响
各组大鼠胃黏膜损伤指数比较,胃萎消高、中、低剂量组显著低于模型对照组(P<0.01或P<0.05);各组大鼠胃黏膜萎缩、肠上皮化生、异常增生的发生鼠数量作双向无序检验,胃萎消高、中、低剂量组显著低于模型对照组(P<0.01)。见表2。
表2 胃萎消颗粒对大鼠胃黏膜损伤的影响(±s)
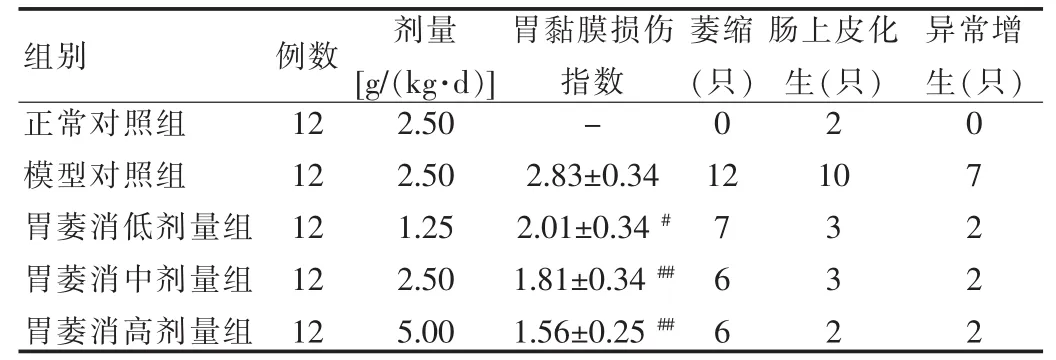
表2 胃萎消颗粒对大鼠胃黏膜损伤的影响(±s)
注:与模型对照组比较,#P<0.05,##P<0.01;-代表无损伤
2.3 造模各组大鼠胃黏膜病理组织学检查
大鼠造模后各组胃黏膜组织病理切片中腺体及纤维结缔组织增生情况,见表3。
3 讨论
本实验采用热盐水灌胃制作CAG模型。大鼠经持续的12周热盐水连续刺激后,胃黏膜受到不同程度损伤。经不同剂量,尤其是高、中剂量的胃萎消颗粒治疗后,胃黏膜萎缩、肠上皮化生、异常增生鼠数明显减少;病理结果也显示,经治疗,腺体排列较规则,无萎缩,固有层中无纤维结缔组织增生。分析其机制,可能与GAS和MTL有关[2]581-583,[6-7]。

表3 造模后各组大鼠胃黏膜病理组织学检查结果
GAS由胃窦G细胞产生,是胃黏膜的主要营养因子,可通过直接作用胃壁细胞上的胃泌素受体,或通过刺激产生Reg蛋白等生长因子促使胃黏膜细胞增殖,对胃黏膜直接或间接地发挥营养和保护作用[6,8]。MTL主要作用是刺激胃肠道和胆道运动,还能刺激胃蛋白酶和胰液的分泌,有助于胃排空和食物消化。在CAG模型大鼠中,胃黏膜腺体萎缩,黏膜变薄,血清GAS和血浆MTL明显下降[9-10]。
本研究结果显示,经过胃萎消颗粒相当于原生药2.50g/(kg·d)以上剂量治疗后,大鼠血清GAS和血浆MTL显著升高,胃黏膜损伤减轻,腺体排列较规则。提示胃萎消颗粒治疗大鼠实验性CAG的机制可能是通过促进GAS和MTL等胃肠激素的分泌,从而增加胃动力,促进胃液分泌,营养和修复损伤的胃黏膜来实现的。表明胃萎消颗粒对大鼠实验性CAG胃部相关病变有较好的治疗作用。
[1]王茜,龚其海,吴芹,等.石斛生物总碱对原代皮层神经元氧糖剥夺的保护作用[J].中国药理通讯,2006,23(4):44.
[2]张沥,张玲霞,徐俊荣,等.热盐水致大鼠萎缩性胃炎动物模型建立[J].世界华人消化杂志,2002,10(5).
[3]中华医学会消化病学分会.全国慢性胃炎研讨会共识意见[J].胃肠病学,2000,5(2):77-79.
[4]Chen XY,Lu AP,Zhou SJ.Pathomorphological studies on gastric mucosa of rat model of chronic atrophic gastritis with spleen deficiency[J].Zhongguo Zhongxiyi jiehe Zazhi,1995,15(5):119-121.
[5]Zhu XL,Duo Tian ZH,Song Tian HY,et al.Prolonged effect of ammonia water on gastric mucosa of albino rats[J].Zhonghua Xiaohua Zazhi,1990,10:198-201.
[6]Yoshikazu K,Shunji I.Gastric mucosal protection and cell proliferation[J].Gastroenterology and Hepatology,2000,15:7-10.
[7]冯德仕,韩江南,冯鑫东.自制隔山消散治疗萎缩性胃炎45例临床观察[J].世界名医论坛杂志,2002,(8):24-25.
[8]苑述刚.阴虚气滞瘀血与慢性萎缩性胃炎的关系[J].中国中西医结合消化杂志,2003,11(5):293-294.
[9]Zhao JB,Cui Q,Zhang X,et al.Weiyankang improves immune function of patients with chronic atrophic gastris[J].Disi Junyi Daxue Xuebao(J Fourth Mil Med Univ),2000,21(7):155-156.
[10]李晓斌.中药消萎灵对大鼠慢性萎缩性胃炎胃黏膜血流量和血浆动素的影响[J].第四军医大学学报,2002,23(9):772.

