降纤药治疗实验性自身免疫性脑脊髓炎小鼠的机制
杨 扬 吴卫平 田书娟 武 雷 黄德晖 (中国人民解放军总医院神经内科,北京100850)
多发性硬化(Multiple sclerosis,MS)是免疫介导的中枢神经系统(Central nervous system,CNS)炎性脱髓鞘疾病,其主要病理表现为广泛的炎性脱髓鞘过程,包括炎症细胞浸润、髓鞘脱失、轴索破坏、胶质细胞的活化与增生及纤维蛋白沉积等。目前,无论采用基因敲除还是药物干预的方法,降低纤维蛋白沉积均可改善神经系统炎性反应和临床症状[1,2]。降纤治疗在MS的治疗中尚未见报道。动物实验证明,使用基因敲除或药物干预方法去除纤维蛋白沉积可使实验性自身免疫性脑脊髓炎(EAE)动物的发病延迟、临床症状改善[3-5]。
巴曲酶是一种从蛇毒中提取和纯化的类凝血酶,具有降解纤维蛋白原的作用,其在血栓性疾病的治疗中已被广泛应用。越来越多的证据表明,纤维蛋白在炎症反应和自身防御中也起着重要作用。1996年,日本学者在细胞转染和病毒诱导的EAE动物模型中应用巴曲酶后,脊髓血管周围的纤维蛋白沉积明显减少,血浆纤维蛋白原浓度降低。同时,预防性地注射巴曲酶可明显减轻临床症状,延缓发病及降低临床评分[6,7]。然而,巴曲酶的降纤作用在髓鞘少突胶质细胞糖蛋白(MOG)诱导的EAE动物模型中是否也具有治疗作用仍不清楚。我们应用MOG诱导的EAE小鼠模型,观察巴曲酶对小鼠的临床症状、炎性细胞浸润、髓鞘脱失及胶质细胞活化等改善情况,进一步探讨纤维蛋白沉积在EAE发病机制中的作用,为临床应用巴曲酶治疗MS提供一种更有前景的新疗法和新思路。
1 材料与方法
1.1 实验动物及分组 采用清洁级10~12周龄C57BL/6雌性小鼠(由我院动物中心提供),使用随机表法随机分为空白对照组(8只)、EAE对照组(12只)、巴曲酶预防用药组(8只)和治疗组(8只),饲养于无特殊病原体的清洁饲养室。
1.2 EAE模型的建立 以300μgMOG35-55多肽(MEVGWYRSPFSRVVHLYRNGK)溶入 200μl PBS溶液,再加入福氏佐剂(CFA)200 μl,添加10 mg/ml结核杆菌冻干粉,冰浴下充分搅拌10~20分钟充分乳化,取小鼠双侧腹壁腹腔内注射,对照组则直接将200μl PBS液与200μl CFA乳化后注射。免疫后0及48小时腹腔内注射150μl百日咳毒素(2μg/ml)。正常对照组则直接将200μl PBS液与200μl CFA乳化后注射。免疫后隔天对小鼠称重,我们实验中按下列标准进行神经功能评分:0分,不发病;1分,尾部张力降低或轻度步态笨拙;2分,轻度后肢力弱;3分,后肢明显力弱;4分,后肢瘫痪;5分,后肢瘫痪合并前肢力弱或濒死状态。
1.3 组织病理学观察 10%水合氯醛0.2 ml麻醉各组小鼠,生理盐水心脏灌注,4%多聚甲醛(PFA)灌注,冰上快速取出小鼠腰膨大部分脊髓及小脑。一部分在PFA中固定,用于石蜡包埋,组织切片机取6μm厚度连续切片;另一部分置30%蔗糖中4℃过夜,用于冰冻包埋后冰冻切片机10μm连续切片。每组石蜡切片用于常规苏木素-伊红(HE)、Luxol快蓝(LFB)染色,快速银染和免疫组织化学染色,冰冻切片用于免疫荧光染色,光学显微镜及荧光显微镜下观察结果,并进行量化分析:(1)炎性浸润评分:0分,无炎性浸润;1分,少许炎症细胞软膜下浸润;2分,血管周围炎细胞浸润;3分,血管周围套袖样炎细胞浸润但未达到实质;4分,大范围白质内炎细胞浸润已达中心白质的1/4~1/2;5分,广泛炎细胞浸润达中心白质的1/2以上。(2)脱髓鞘评分:0分,无脱髓鞘;1分,少许软膜下纤维脱髓鞘;2分,软膜下部分边缘受累但未达到实质;3分,广泛脱髓鞘超出软膜达到实质;4分,大范围的白质内脱髓鞘但不超过横断面的一半面积;5分,一半或一半以上横断面的主要白质内脱髓鞘。
1.4 病理图像分析 采用Axioplan Zeiss图像分析系统对染色结果进行定量分析,每张切片随机选取5个高倍视野(×400),定量分析并评分,求其平均值。对免疫组化染色进行定量分析,每张切片随机选取5个高倍视野(×200),据阳性免疫反应的图象灰度选择合适的灰度分割阈值,测定阳性免疫染色强度及面积。免疫组化评分(IHS)方法参照文献[8]结合阳性细胞百分比及染色强弱两个方面联合评分(均按上限):A为阳性细胞数分级(0~1%=0、2%~10%=1、11%~ 50%=2、51%~ 80%=3、81%~100%=4),B为阳性细胞显色强度分级(0级:阴性;1级:弱阳性;2级:阳性;3级:强阳性),A、B两项乘积即为该组织的IHS。
1.5 纤维蛋白的免疫荧光检测及血清纤维蛋白原浓度测定 免疫后30、40、60天每组处死发病小鼠各2只,EAE对照组、预防组及治疗组小鼠各取冰冻切片进行纤维蛋白免疫荧光染色,在荧光显微镜下观察并量化分析。每组剩余小鼠于免疫后60天全部处死,冰上迅速取材并提取蛋白及RNA,同时将小鼠眼静脉取血送我院检验科检测血清纤维蛋白原浓度。
1.6 采用常规的Western blot方法测定脊髓髓鞘碱性蛋白(MBP)、主要组织相容性复合物(MHC-Ⅰ)及磷酸化蛋白激酶(p-Akt)的蛋白表达,荧光定量PCR方法(两步法)测定MBP和组织型纤溶酶原激活物(t-PA)的表达。
1.7 统计学方法 采用SPSS 13.0软件进行统计学分析,各项指标以±s,多组样本均数比较进行单因素完全随机方差分析(ANOVA),量化评分后三组评分的比较采用Mann-Whitney检验。P<0.05时认为差异有统计学意义。
2 结果
2.1 降纤治疗对EAE小鼠临床过程的改善 采用MOG诱导的C57BL/6 EAE小鼠模型,在免疫后13天左右陆续出现症状,逐渐表现为尾部张力减低,双后肢无力,行走拖拉缓慢。隔日给药并观察小鼠发病情况进行临床评分。与EAE未用药对照组相比,降纤预防组及治疗组小鼠的临床症状减轻,平均临床评分有明显减低(P<0.05,图1A)。EAE对照组、预防组及治疗组的平均发病时间分别为免疫后7、10、29 天,达峰时间分别为免疫后 29、29、40 天 。在免疫后第27天[平均临床评分:EAE对照组1.0±0.12(n=12),预防组 0.20±0.09(n=8),治疗组0.05±0.02(n=8)]和免疫后第35天[平均临床评分:EAE对照组1.40±0.10(n=9),预防组0.12±0.05(n=5),治疗组 0.68±0.13(n=8)],巴曲酶降纤预防组及治疗组小鼠临床评分平均值较EAE对照组有明显降低(P<0.05,图1B)。

图1 巴曲酶降纤治疗降低临床评分并减轻临床症状Fig.1 Batroxobin administration ameliorated clinical score and clinical symptoms
2.2 降纤治疗减轻了炎症和脱髓鞘,但轴索损伤无显著差别 HE染色显示,EAE对照组小鼠脊髓内出现轻至中度炎性细胞浸润,而预防组和治疗组炎性细胞浸润明显减轻(图2)。经量化分析得到炎症评分,巴曲酶降纤预防组(1.10±0.21)及治疗组(1.40±0.13)组较EAE对照组(3.20±0.15)小鼠的脊髓炎性细胞浸润程度明显降低(P<0.05)。预防组及治疗组小鼠小脑白质内炎性细胞浸润较EAE对照组亦有一定程度的减轻(图3)。LFB染色显示巴曲酶降纤预防及治疗组小鼠脊髓白质内脱髓鞘程度较EAE未用药对照组明显减轻,EAE未用药对照组小鼠脊髓白质内髓鞘脱失较严重,而预防组和治疗组髓鞘脱失均较轻微(图4),量化评分分析表明,预防组(1.10±0.12)及治疗组(1.70±0.25)脱髓鞘程度评分较对照组(3.10±0.21)明显降低(P<0.05)。轴索染色可见银染结构欠完整、着色不均匀,轴索广泛缺失(图5),以EAE未用药对照组轴索损害最为严重(89%),巴曲酶预防组轴索损害为80%,而治疗组脊髓轴索损害为75%,经量化分析后各组差异无统计学意义(P>0.05)。
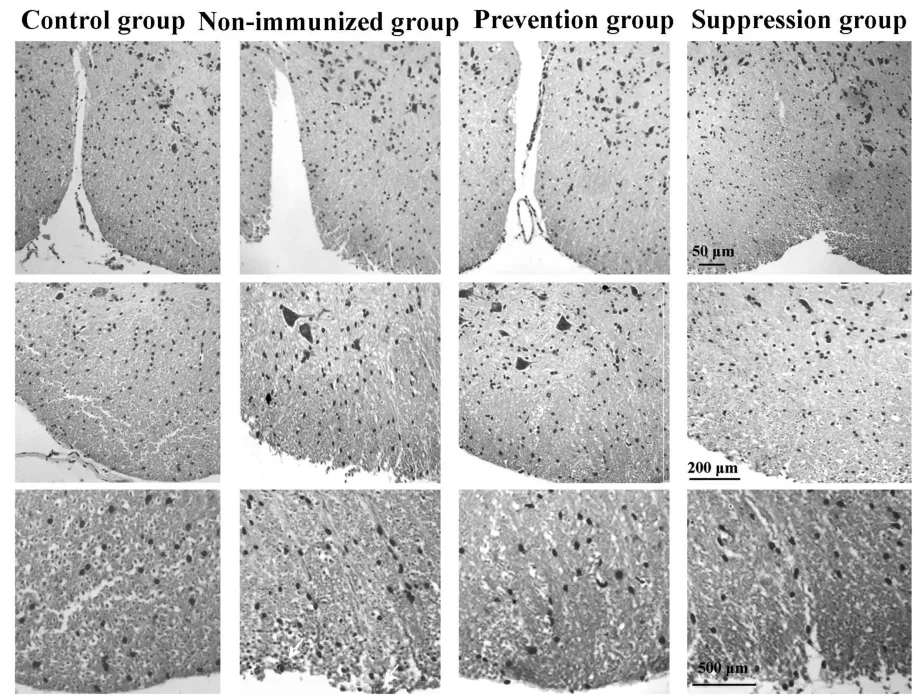
图2 EAE对照组、巴曲酶预防组及治疗组小鼠脊髓内炎性浸润情况比较(HE染色)Fig.2 Comparison of inflammatory infiltration in spinal cord in EAE control,prevention and suppression groups using HE staining
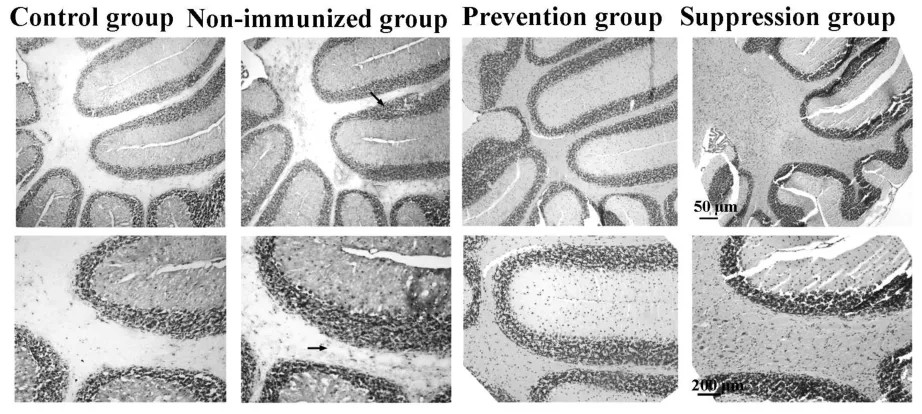
图3 各组小鼠小脑白质内炎性浸润情况(HE染色)Fig.3 Comparison of inflammatory infiltration in whitematter of cerebellum in each group using HE staining
空白对照组,EAE未给药组,预防组及治疗组的小鼠脊髓及小脑组织行HE染色。在EAE未给药小鼠脊髓、小脑白质内及软膜下炎性细胞广泛浸润,而巴曲酶预防组及治疗组中炎性细胞浸润主要集中在软膜附近。
2.3 EAE小鼠免疫组织化学特点及降纤治疗效果
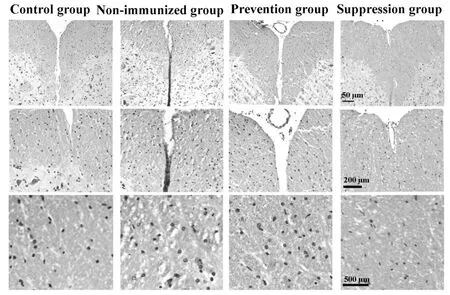
图4 各组小鼠脊髓白质内髓鞘脱失情况(LFB染色)Fig.4 Luxol fast blue(LFB)stainingdemonstrated myelin loss in the white matter of spinal cords
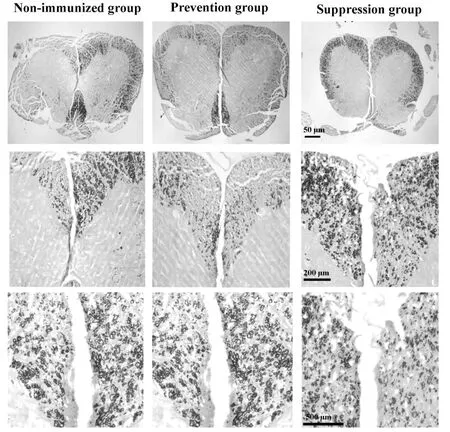
图5 各组小鼠脊髓轴索染色情况Fig.5 Comparison of silver impregnaion for axon
用MBP抗体的免疫组织化学染色标记各组小鼠小脑白质内的髓鞘蛋白。在EAE未用药组小鼠小脑白质内可见广泛的点状脱髓鞘改变,MBP阳性表达较巴曲酶预防组和治疗组少(图6)。巴曲酶预防组及治疗组的MBP的IHS较EAE对照组明显增高,差异有统计学意义(P<0.05)。在髓鞘脱失的同时,星形胶质细胞大量激活。通过抗胶质纤维酸性蛋白(GFAP)抗体的免疫组化染色标记活化的星形胶质细胞发现:与EAE未用药对照组相比,巴曲酶预防组和治疗组的GFAP阳性细胞数明显减少,主要表现为小鼠小脑白质内弥漫性GFAP阳性表达减少(图7)。经免疫组化评分显示,巴曲酶降纤预防组及治疗组GFAP的IHS较EAE对照组明显减低(P<0.05)。MBP和GFAP免疫荧光双标分析显示:与EAE对照组相比,巴曲酶预防组和治疗组小鼠小脑白质内MBP(绿色)表达增高,而GFAP(红色)表达降低(图8)。
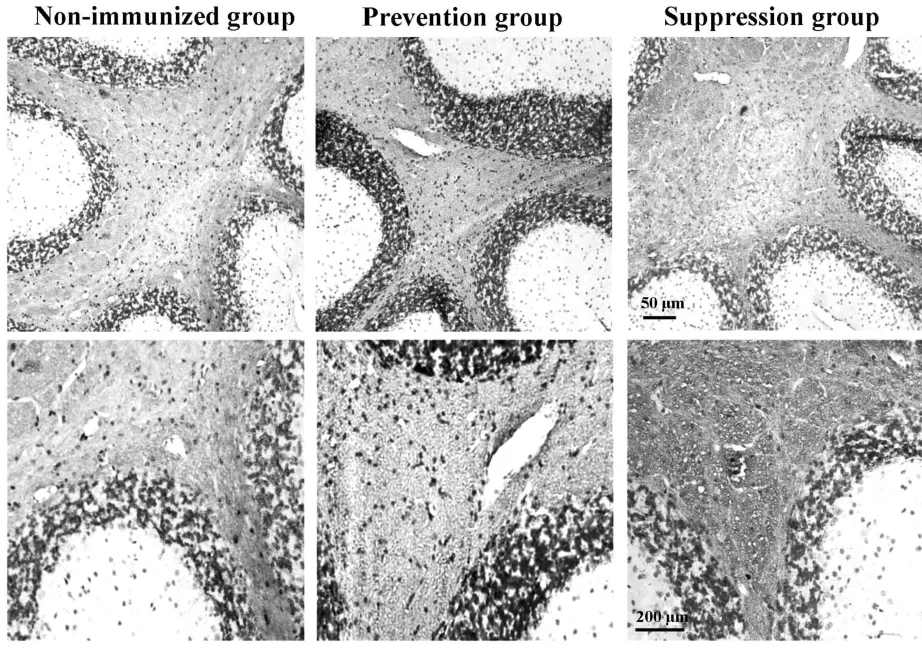
图6 EAE对照组小鼠小脑白质内广泛的点状脱髓鞘改变(MBP免疫组织化学染色)Fig.6 Multifocal widespread areas of myelin damage were observed in cerebellar white matter of EAE mice by immunochemistry analysis

图7 与EAE未用药对照组相比,巴曲酶预防组和治疗组的GFAP阳性细胞数明显减少(免疫组织化学染色)Fig.7 Immunostaining sections showed dramatic reduction in GFAP-positive cells in prevention and suppression group mice as compared with controls
2.4 降纤治疗减少了病灶周围纤维蛋白的沉积

图8 MBP和GFAP免疫荧光双标分析(免疫荧光染色)Fig.8 MBP and GFAP assay using double-labelling immunofluorescence
经纤维蛋白免疫荧光检测,在EAE对照组小鼠小脑白质内可见纤维蛋白阳性物质点片状沉积,而巴曲酶预防组和治疗组小鼠小脑切片中纤维蛋白阳性物质沉积明显减少(图9)。IHS分析显示:预防组和治疗组较EAE对照组纤维蛋白的沉积有明显减少,差异有统计学意义(P<0.05)。小鼠眼球静脉血血清中纤维蛋白原浓度(g/L)在EAE组、预防组及治疗组分别为3.15±0.33、2.78±0.13和2.98±0.82,预防组与治疗组的血清纤维蛋白原浓度平均值有下降趋势,但与EAE组相比差异无统计学意义(P>0.05)。
2.5 降纤治疗对小鼠脊髓MHCⅠ、p-Akt及MBP蛋白表达的影响 在EAE对照组、巴曲酶预防组及治疗组小鼠脊髓中MHC-Ⅰ类的蛋白表达水平无明显差异;而巴曲酶预防组及治疗组较EAE对照组小鼠脊髓中的p-Akt蛋白表达降低,MBP蛋白表达升高(图 10)。
2.6 实时荧光定量PCR检测各组小鼠脊髓中t-PA及MBP的mRNA表达 t-PA特异性扩增对应的Tm为(76.74±0.65)℃,MBP的 Tm为(73.34±0.85)℃,β-actin的Tm 为(84.48±0.51)℃,熔解曲线分析确定PCR产物的特异性(图11)。EAE对照组、巴曲酶预防组和治疗组小鼠t-PA mRNA的表达(t-PA/β-actin)分别为 0.34±0.53、5.83±1.22和9.78±0.98,巴曲酶预防组与治疗组t-PA mRNA的表达明显高于EAE对照组,差异有统计学意义(P<0.05)。各组小鼠MBPmRNA的表达(MBP/β-actin):分别为0.78±0.34(EAE对照组)、2.53±0.87(巴曲酶治疗组)和4.96±1.23(巴曲酶预防组),巴曲酶预防组与治疗组MBP mRNA的表达明显高于EAE对照组,差异有统计学意义(P<0.05)。
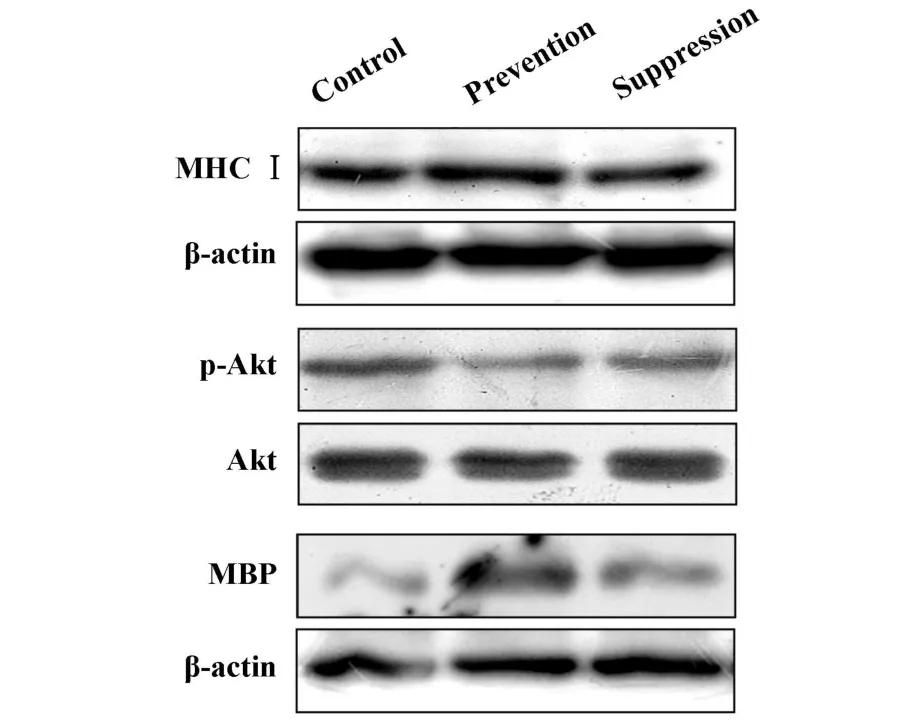
图10 Western blot方法检测MHCⅠ,p-Akt及MBP蛋白表达Fig.10 MHCⅠ,p-Akt and MBPexpression were assessed by Western blot
3 讨论
MOG诱导的EAE小鼠模型的建立,为我们探讨MS的发病机制提供了有效的研究手段。我们已利用MOG35-55片段免疫C57小鼠成功建立了慢性单时相EAE模型[9]。MS的病理改变除了脱髓鞘、轴索损伤及胶质细胞增生外,还包括血管周围大量的纤维蛋白沉积,学者们已在豚鼠、大鼠、小鼠等多种动物诱发的 EAE中发现有纤维蛋白沉积广泛存在[10]。在我们的研究中,使EAE小鼠模型降低纤维蛋白能够明显减轻小鼠的临床症状及炎性脱髓鞘改变,不仅能明显改善临床表现,降低临床评分,而且能够减轻胶质细胞的活性。
有学者研究发现,在临床症状出现之前EAE小鼠体内的凝血系统活性增高、纤溶活性降低,提示凝血-纤溶系统在 EAE发病中起非常重要的作用[11,12]。已有研究证实,纤维蛋白不仅在凝血纤溶系统中起重要作用,而且在炎症反应和损伤修复中也起重要作用[13]。纤维蛋白的结构复杂性决定了其功能多样性,它在MS发病过程中的作用可能是多方面的,不仅参与了血脑屏障通透性的增加及炎性细胞浸润引起的髓鞘脱失,而且通过细胞因子的调控发挥多种生物学功能。此外,MS早期炎性脱髓鞘病理过程中纤维蛋白除了通过被破坏的血脑屏障进入中枢神经系统大量沉积,使得激活的巨噬细胞和淋巴细胞从外周循环系统进入中枢神经系统,同时激活星形胶质细胞和小胶质细胞,引起脱髓鞘和轴索损伤[14]。炎症和凝血过程是相互联系的,很多炎症反应以凝血激活和纤维蛋白沉积为特征。在炎症发生的同时凝血酶能引起血管通透性的增加,诱导内皮细胞黏附于中性粒细胞,刺激单核细胞和中性粒细胞的趋化性,引起血脑屏障通透性增高、凝血酶活性增加、不溶性的纤维蛋白形成并沉积在中枢神经系统血管周围[15,16]。
不论是通过遗传学还是药理学手段降低纤维蛋白,均可不同程度减轻EAE动物的发病。纤维蛋白源性的γ377-395多肽注入EAE小鼠体内后可明显减低临床评分和炎症反应。药物降纤也可以减轻临床症状,改善炎症反应,降低小胶质细胞的活性[4]。最早应用的降纤药物安克洛酶可以减轻肿瘤坏死因子(TNF)转基因小鼠的炎性脱髓鞘反应,延迟疾病的发生[5]。巴曲酶具有降低纤维蛋白原和抗凝作用,诱发t-PA的释放并增强t-PA的作用,并促进纤维蛋白溶酶的生成等。进一步的研究发现,在细胞转染以及分离病毒诱导的EAE模型中,巴曲酶可以明显减轻临床症状,降低临床评分[6]。在我们的研究中首次采用MOG诱导的EAE小鼠模型,连续给予巴曲酶后可使小鼠的临床症状减轻,临床评分降低,不论是预防组还是治疗组与对照组相比,均有明显的改善效果。值得注意的是,我们给予巴曲酶预防及治疗降纤的同时,小鼠眼球静脉血中检测的纤维蛋白原浓度平均值有所降低,但各组间差别无明显统计学意义,小鼠均未出现出血等副作用。
在EAE小鼠模型中,巴曲酶能有效改善发病动物的临床症状和发病过程,主要是由于抑制了纤维蛋白原的致炎特性而不是其促凝血特性[4]。在EAE早期,随着血脑屏障的破坏,中枢神经系统血管周围纤维蛋白原沉积,作为具有多种生物活性的物质,纤维蛋白原可能通过多种途径参与EAE的发病过程,但具体机制仍不是很清楚。目前得到广泛认可的是纤维蛋白原可作为小胶质细胞的调控子参与EAE的发病过程。基质中纤维蛋白的沉积可刺激小胶质细胞活化,活化的小胶质细胞通过释放细胞因子和一氧化氮(NO),促进神经元和少突胶质细胞的凋亡[4]。在中枢神经系统中,除小胶质细胞外,还有星形胶质细胞和少突胶质细胞,少突胶质细胞形成中枢神经纤维髓鞘,而星形胶质细胞参与胶质瘢痕的形成,二者功能的变化与MS的发生有密切关系。纤维蛋白可以通过调控巨噬细胞、小胶质细胞及星形胶质细胞来参与炎症反应。我们的研究证实,巴曲酶对纤维蛋白原诱导的巨噬细胞炎症反应的改善情况,巴曲酶预防和治疗组较对照组GFAP阳性表达的星形胶质细胞激活明显减少,表明巴曲酶可以抑制星形胶质细胞活性。此外,我们得到的结果还表明,巴曲酶可导致其下游激活的磷酸化Akt信号通路下调,从而最终减轻炎症反应,与文献报道一致[4,5]。
我们研究发现,清除了纤维蛋白原的小鼠MBP阳性细胞数明显增加,而且在RNA水平也发现纤维蛋白原可抑制MBP的表达,提示在中枢神经系统中调控纤维蛋白原的沉积可能是神经损伤后修复的一个关键因素。有学者通过对MS患者的脑脊液研究发现,GFAP水平与患者临床残疾评分(EDSS)有关,GFAP越高EDSS评分也越高,故它可以作为不可逆损害的标志,但GFAP的升高没有特异性,反应性的胶质增生可见于多种疾病[17]。本组实验中EAE未用药组小鼠脊髓中有大量纤维蛋白沉积,刺激了星形胶质细胞的增生,引起临床症状的恶化,造成神经功能的不可逆损害,而使用巴曲酶后,星形胶质细胞增生减少,减缓了神经胶质瘢痕的形成,临床症状轻且预后好,不可逆的神经功能障碍几率降低,故我们推测临床使用可能会改善患者的预后。
纤维蛋白沉积的同时,纤溶系统亦出现上调[18]。组织型纤溶酶原激活剂(t-PA)调节的纤溶作用能够产生一种“保护机制”,即随着纤维蛋白沉积,纤溶系统上调增强纤维蛋白的溶解对机体来说是一种保护作用,早期的纤维蛋白增加是机体对抗炎症与损伤的保护反应;当病程进展纤维蛋白大量沉积,又会加重MS病情。因此,在MS发病过程中,纤维蛋白既发挥了神经保护作用又启动了炎性脱髓鞘的病理过程,引起相应的神经损伤。
我们目前的实验中,巴曲酶预防组和治疗组与EAE对照组相比,小鼠脊髓和小脑的炎性脱髓鞘反应明显减轻,然而,纤维蛋白介导的炎性脱髓鞘作用机制还不是十分清楚,但至少可以通过降纤改善EAE小鼠的炎症反应,提示我们将纤维蛋白作为一种治疗靶标有利于今后应用于MS患者的疾病预防和治疗。
1 Rubel C,Fernández G C,Rosa F A et al.Soluble fibrinogen modulates neutrophil functionality through the activation of an extracellular signalregulated kinase-dependent pathway[J].J Immunol,2002;168(7):3527-3535.
2 Lu H,Smith CW,Perrard J et al.LFA-1 is sufficient in mediating neutrophil emigration in Mac-1-deficient mice[J].J Clin Invest,1997;99(6):1340-1350.
3 Suehiro K,Gailit J,Plow E F.Fibrinogen is a ligand for integrin alpha5beta1 on endothelial cells[J].J Biol Chem,1997;272(2):5360-5366.
4 Adams RA,Bauer J,Flick M J et al.The fibrin-derived gamma377-395 peptideinhibitsmicroglia activation and suppresses relapsing paralysis in central nervous system autoimmune disease[J].J Exp Med,2007;204(3):571-582.
5 Akassoglou K,Adams RA,Bauer J et al.Fibrin depletion decreases inflammation and delaysthe onsetof demyelination in a tumor necrosisfactor transgenic mouse model for multiple sclerosis[J].Proc Natl Acad Sci,2004;101(17):6698-6703.
6 Inoue A,Koh CS,Shimada K et al.Suppression of cell-transferred experimental autoimmune encephalomyelitis in defibrinated Lewis rats[J].J Neuroimmunol,1996;71(1-2):131-137.
7 Inoue A,Koh CS,Yamazaki M et al.Fibrin deposition in the central nervous system correlates with the degree of Theiler's murine encephalomyelitis virus-induced demyelinating disease[J].JNeuroimmunol,1997;77(2):185-194.
8 Soslow RA,Dannenberg A J,Rush D et al.COX-2 is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000;89(12):2637-2645.
9 Tsunoda I,Tanaka T,Terry E J et al.Contrasting rolesfor axonal degeneration in an autoimmuneversus viral model of multiple sclerosis:When can axonal injury be beneficial?[J].Am JPathol,2007;170(1):214-226.
10 Sobel RA,Schneeberger EE,Colvin RB.Theimmunopathologyof acute experimental allergic encephalomyelitis.V.A light microscopic and ultrastructural immunohistochemical analysis of fibronectin and fibrinogen[J].Am JPathol,1988;131(3):547-558.
11 Inaba Y,Ichikawa M,Inoue A et al.Plasma thrombin-antithrombinⅢcomplex is associated with the severity of experimental autoimmune encephalomyelitis[J].JNeurol Sci,2001;185(2):89-93.
12 Koh CS,Kwaan H C,Paterson P Y.Neurovascular fibrinolytic activity in normal Lewis rats and ratswith cell-transferred experimental allergic encephalomyelitis[J].JNeuroimmunol,1990;28(3):189-200.
13 Adams R A,Passino M,Sachs BD et al.Fibrin mechanismsand functions in nervous system pathology[J].Mol Interv,2004;4(3):163-176.
14 Davalos D,Lee JK,Smith W B et al.Stable in vivo imaging of densely populated glia,axons and blood vessels in the mouse spinal cord using two-photon microscopy[J].JNeurosci Methods,2008;169(6):1-7.
15 Paterson PY,Koh C S,Kwaan H C.Role of the clotting system in the pathogenesis of neuroimmunologic disease[J].Fed Proc,1987;46(1):91-96.
16 Akassoglou K,Yu WM,Akpinar P et al.Fibrin inhibits peripheral nerve remyelination by regulating Schwann cell differentiation[J].Neuron,2002;33(6):861-875.
17 Petzold A,Eikelenboom M J,Gveric D et al.Markers for different glial cell responses in multiple sclerosis:clinical and pathological correlations[J].Brain,2002;125(7):1462-1473.
18 East E,Baker D,Pryce G et al.A rolefor the plasminogen activator system in inflammation and neurodegeneration in the central nervoussystem during experimental allergic encephalomyelitis[J].Am J Pathol,2005;167(2):545-554.

