针刺干预对脑缺血再灌注损伤大鼠外周血清蛋白表达的影响*
陈素辉,孙 华△,徐 虹,黄艳秋,高 扬△
(1.中国医学科学院北京协和医学院北京协和医院,北京100730;2.中国医学科学院北京协和医学院基础医学研究所,北京100005)
缺血性脑血管病属于中医“中风”范畴,由于阴阳失调、气血逆乱,导致脑脉痹阻。主要的病理生理过程为局部脑血流中断导致大脑组织的葡萄糖和氧供应缺乏,进而引起神经元的不可逆损伤,主要的损伤机制包括兴奋性神经毒性、氧化应激和炎症损伤[1]。针刺在治疗缺血性脑血管病方面取得了一些成绩,根据中医经络理论,百会穴属督脉要穴,归属于脑,起通达阴阳脉络、连贯周身经穴、调节机体阴阳平衡的作用;足三里穴是足阳明胃经的合穴,具有补中益气、通经活络等作用,两穴合用可疏经活络、扶正祛邪以调节机体阴阳平衡。研究发现针刺百会和足三里穴能够抑制脑缺血再灌注区基质金属蛋白酶-9(MMP-9)及细胞间黏附分子-1(ICAM-1)等炎症损伤相关细胞因子的表达,减少缺血再灌注后的脑组织损伤,保护脑组织[2]。此外,针刺还可改善缺血病灶区域的能量供应及代谢功能,减轻缺血再灌注后神经元细胞坏死、凋亡过程,具有良好的抗氧化应激和脑保护作用[3]。
外周血是机体宏观调节信号的有效载体,本研究拟应用表面增强激光解吸电离飞行时间质谱技术(surface enhanced laser desorption/ionization-time of flight-mass spectrometry,SELDI-TOF-MS)观察针刺对脑缺血再灌注损伤大鼠外周血清蛋白表达谱的变化,以探讨针刺治疗对脑缺血再灌注损伤调节机制的影响。
1 实验材料和方法
1.1 实验动物
健康SD大鼠,清洁级,雄性,10~12周龄,体重280~310 g,由中国药品生物制品检定所实验动物中心提供。分笼饲养,饲养条件为室温(25±3)℃,湿度75%,光照:黑暗=12∶12 h,自由摄取饲料和水。
1.2 主要试剂和器材设备
弱阳性离子交换剂(WCX)纳米磁珠试剂盒(北京赛尔迪公司);NP-20芯片校正质谱仪、Biomarker Wizard Version 3.1.0软件、WCX-2芯片(Ciphergen公司);涡旋混合器MVS-1(北京北德科学器材有限公司);长城牌KWD-808Ⅱ全能脉冲电疗仪(常州市武进长城医疗器械有限公司);2636-4A、2634-4A线栓(北京沙东生物技术公司)。
1.3 脑缺血再灌注损伤模型制备和神经功能评分
根据Longa等[4]的线栓法制备MCAO模型。插栓2 h后拔出线栓以实现脑缺血再灌注,待大鼠苏醒后对大鼠进行神经功能评分,以判断造模成功与否。
神经功能评分法参照Bederson等[5]的5级分类法:0级:无神经功能缺损;1级:不能完全伸展左前肢;2级:左前肢屈曲,向左侧推动时阻力下降;3级:爬行时向左侧划圈;4级:意识不清,包括24 h内死亡。评分为0级和4级的剔除实验。
1.4 实验的分组与处理
采用随机区组设计将实验大鼠分为模型组、假手术组和电针组3个大组。每大组再按照缺血再灌注后时间分成12 h、24 h、48 h、72 h、96 h和144 h共6个亚组,每个亚组有大鼠7只;另设正常对照组7只。正常对照组既不手术也不治疗;模型组为造模术成功后不做治疗;假手术组仅模拟手术过程,但不插入线栓,不治疗;针刺组为造模成功后,依据华氏大鼠穴位图谱,针刺百会和足三里穴,针柄连接脉冲电疗仪,疏密波,刺激强度为2 mA,频率2~100 Hz,每日1次,每次20 min。
1.5 SELDI血清样品的提取
取血清:各组大鼠按照规定时间点用4%戊巴比妥腹腔注射麻醉,切开胸腔,心脏取血,室温下静置2 h,离心20 min,分离血清,存放于 -80℃冰箱中备用。
分离蛋白:取10 μl血清,加入20 μl U9缓冲液,将样品冰浴振荡30 min;加入360 μl WCX-2 buffer液,混匀。取出WCX-2芯片,将芯片插入生物芯片处理器,每孔加200 μl WCX-2 buffer液,置于振荡器震荡5 min后甩掉缓冲液;重复上述操作1次,在甩掉缓冲液后,将100 μl处理好的样品加入芯片处理器的各个孔中,并震荡1 h;甩出样品,每孔加入200 μl WCX-2 buffer,室温振荡5 min后甩去孔中液体,再次加200 μlWCX-2 buffer入各孔中,重复操作1次。每孔加入200 μl HEPES(1Mm,PH 4.0)液,立即甩出,取出芯片,风干后,立即加0.5 μl SPA饱和溶液入每个加样孔中 ,待其全干后,再加入0.5 μl SPA液。
1.6 数据的读取与分析
芯片全干后上机测定。参数设置:激光强度205,检测敏感度8,优化分子质量范围为1 000~15 000 Da,最高分子质量为50 000 Da。
采用Biomarker Wizard Version 2.1.0软件分析处理所有数据,分析所有1 000~50 000 Da之间的蛋白峰,并计算出峰的均数、标准差(SD)。用Mann-Whitney U检验比较配对样本的蛋白峰,计算P值。
2 结果
2.1 实验各组大鼠血清蛋白差异峰数量与时间分布
实验各组大鼠不同时间点的血清SELDI-TOFMS技术分析结果显示,在1000~50 000 Da范围内,针刺组与模型组、模型组与正常组、模型组与假手术组比较,可见显著性差异信号峰表达。见图1。
模型组与正常组比较有150个显著性差异信号峰(P<0.05),包括62个正向峰(其中12 h组有5个,24 h组有18个,48 h组有17个,72 h组有11个,96 h组有10个,144 h组有1个)和88个负向峰(6个时间点分别为7、18、20、21、12、10个)。差异峰分布的时间特征呈钟形偏正态分布,峰值时间为48 h。

图1 实验各组大鼠不同时间点血清蛋白差异峰分布趋势图
模型组与假手术组比较有78个显著性差异信号峰,包括33个正向峰和45个负向峰,其中12 h组有11个,24 h组有2个,48 h组有36个,72 h组有18个,96 h组有9个,144 h组有2个。差异峰分布的时间特征符合损伤信号表达的一般规律,呈双峰型,第一峰峰值时间为12 h,第二峰峰值时间为48 h。
针刺组与模型组比较有89个差异信号峰,包括32个正向峰(其中12 h组有2个,24 h组有12个,48 h组有2个,72 h组有8个,96 h组有7个,144 h组有1个)和57个负向峰(6个时间点分别为9、10、5、16、15、2个)。差异峰分布的时间特征仍然呈双峰型,干预使第一峰峰值时间后移为24 h,第二峰峰值时间后移为72 h。
2.2 实验大鼠血清蛋白差异峰表达特征
大鼠血清蛋白差异峰表显示同一质荷比的蛋白差异峰在相同时间点的同一实验组中的峰形和峰值基本相似,实验各组间的差异多表现为峰值的大小不同,如图2A;不同质荷比的蛋白差异峰的最大表达峰值时间点不同,可出现在损伤早期12 h~24 h,损伤中期48 h~96 h或96 h以后,还可以表现为双峰形,见图2B。
2.3 针刺干预对实验大鼠血清蛋白表达谱的影响
针刺干预对实验大鼠血清蛋白各组分表达的影响不同,可表现为单纯的抑制或促进,如图3A、图3B。也可表现为抑制第一峰,使第二峰表达的高峰时间前移,如图3C,示针刺干预显著下调第一峰值,并使第二峰表达时间提前到72 h;或者如图3D,针刺干预早期以抑制为主,中后期以促进为主。
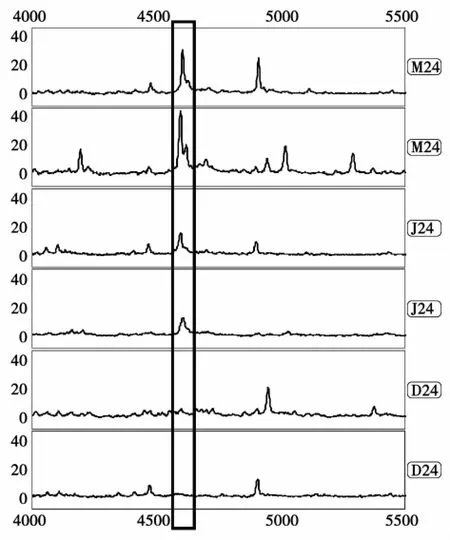
图2 A模型组(M)、针刺组(D)和假手术组(J)24 h时间点4 600 Da血清蛋白质谱图
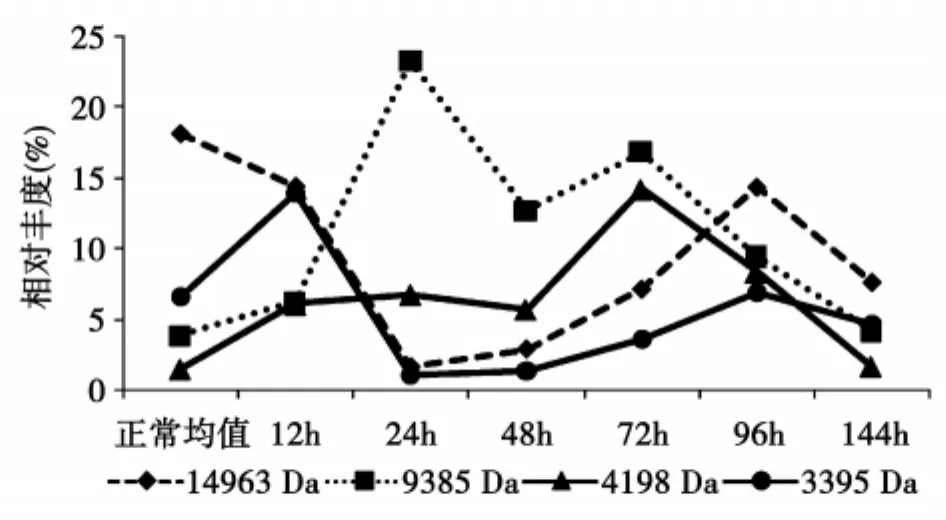
图2 B模型组血清中不同质荷比蛋白差异峰的峰值时间分布
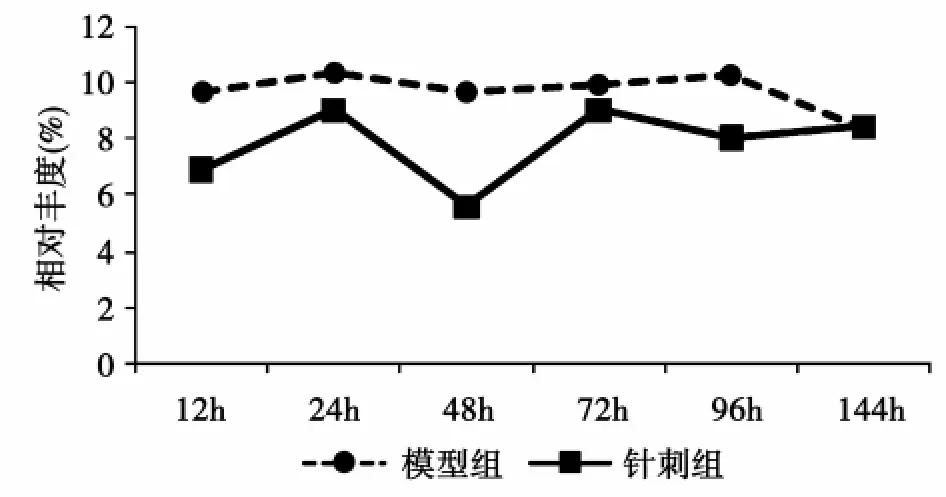
图3 A模型组和针刺组大鼠1 151 Da血清蛋白表达趋势图
3 讨论
脑缺血再灌注损伤模型的病理生理机制主要模拟损伤和损伤-修复两个损伤相关信号传导过程。损伤信号链主要由炎症细胞介导,脑缺血再灌注24~48 h达到峰值。损伤早期,血管内皮细胞和神经胶质细胞受到血液流变学和缺血影响后释放大量炎症信号,介导大量炎症细胞的募集和细胞因子、趋化因子、粘附因子等炎症相关因子的释放[6],导致损伤局部炎症细胞浸润,进一步加重缺氧直接造成的神经元坏死和凋亡,使缺血损伤区域进一步扩大。炎症细胞造成机体损伤的同时,免疫系统的反馈调节信号,如转化生长因子(TGF)、白细胞介素-10(IL-10)等启动了损伤-修复信号链[7]。参与损伤-修复网络功能的细胞主要涉及神经元、神经胶质细胞、血管内皮细胞和炎症细胞[8],信号包括炎性细胞因子、抗炎性细胞因子和神经营养因子。由于损伤程度不同,此期一般在损伤后的48~72 h被观察到,主要是局部炎症细胞功能下调,损伤-修复相关的神经胶质细胞、血管内皮细胞及神经元功能活动上调,表达和释放大量抗炎性细胞因子,可呈现第2个损伤局部信号高峰。
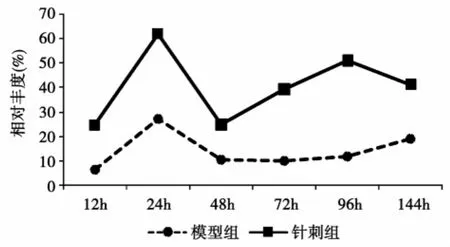
图3 B模型组和针刺组大鼠8 106 Da血清蛋白表达趋势图

图3 C模型组和针刺组大鼠7 886 Da血清蛋白表达趋势图
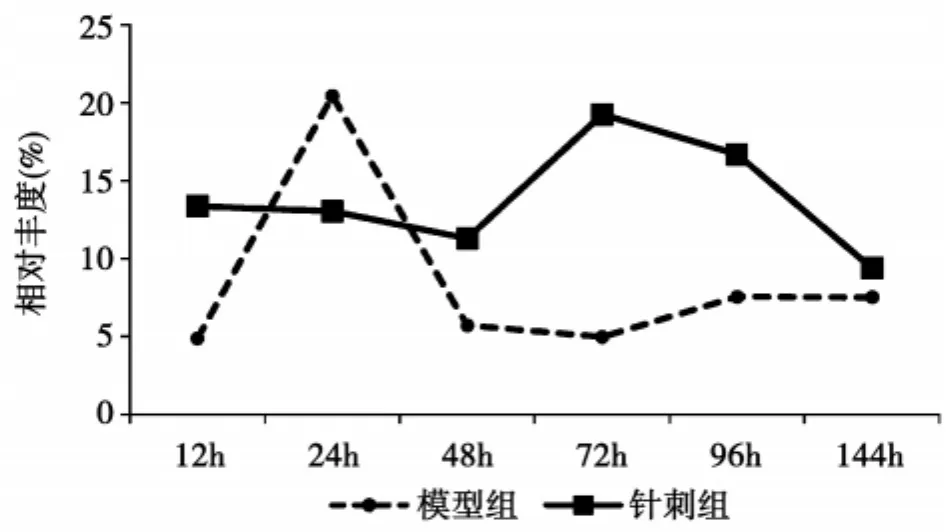
图3 D模型组和针刺组大鼠4 904 Da血清蛋白表达趋势图
外周血是机体宏观调节信号的最有效载体之一,脑缺血再灌注损伤模型模拟局部脑组织损伤、血流恢复后相关信号的传递过程,它不仅能反映损伤局部的变化,而且能反映机体对损伤-应激和损伤-修复产生的全身性应答情况,分析血清中相关信号的变化可以反映局部损伤和损伤-修复相关情况的变化,笔者对实验各组大鼠外周血清样本进行分析的结果与文献报道一致[9]。
针刺机制研究已经证明针刺可调节机体的神经-生理功能,通过神经-免疫调节网络干预疾病的病理生理过程。本研究观察到针刺治疗可多点干预脑缺血再灌注损伤模型大鼠血清蛋白表达谱的变化,有仅单纯的抑制血清中损伤相关蛋白峰的表达,或促进修复相关蛋白峰的表达,或者抑制早期损伤相关蛋白的同时,也促进后期修复相关蛋白的表达。笔者的结果表明针刺百会和足三里穴可能通过上调和下调脑缺血再灌注损伤大鼠外周血中相关蛋白的表达,调节损伤和损伤-修复相关的神经-免疫调节网络,干预脑缺血再灌注模型大鼠的病理生理过程。
[1]Espinoza-Rojo M,Iturralde-Rodríguez KI,Chánez-Cárdenas ME,et al.Glucose transporters regulation on ischemic brain:possible role as therapeutic target[J].Cent Nerv Syst Agents Med Chem,2010,10(4):317-325
[2]徐虹,洪礼传,黄艳秋,等.针刺对脑缺血再灌注模型大鼠脑组织基质金属蛋白酶、细胞间黏附分子表达的影响[J].基础医学与临床,2010,30(7):731-736
[3]沈梅红,李忠仁,项晓人,等.电针对脑缺血再灌注大鼠大脑皮层超微结构的影响[J].针刺研究,2009,34(3):167-170
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91
[5]Bederson JB,Pitts LH,Tsuji M.Ratmiddle cerebralartery occlusion:Evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476
[6]A.Denes,P.Thornton,N.J.Rothwell,et al.Inflammation and brain injury:acute cerebral ischaemia,peripheral and central inflammation[J].Brain Behav Immun.,2010,24(5):708-723
[7]Ekdahl CT,Kokaia Z,Lindvall O.Brain inflammation and adult neurogenesis:the dual role of microglia[J].Neuroscience,2009,158(3):1021-1029
[8]Mergenthaler P,Dirnagl U,Meisel A.Pathophysiology of stroke:Lessons from animal models[J].Metabolic Brain Disease,2004,19(3-4):151-167
[9]Hiroshi Yao,Tatsuo Nakahara,Nobuaki Nakagawa,et al.Regional and Temporal Changes in Proteomic Profile after Middle Cerebral Artery Occlusion with or without Reperfusion in Rats[J].Neurochem Res,2009,34(11):1999-2007

