黄芩苷对FM1肺炎小鼠肺组织细胞凋亡FAS/FAS-L系统的影响
万巧凤,顾立刚,殷胜骏,葛东宇,李根茂
(1.北京中医药大学中医药抗病毒教育部重点实验室,北京 100029;2.宁夏医科大学,宁夏 银川 750004)
黄芩苷(Baicalin,BAI)是从中药黄芩(Scutellaria baicalensis)中提取的多酚羟基黄酮类单体,具有抑菌[1]、抗炎[2]、抗肿瘤[3]、调节免疫功[4]能等多种生物学作用。黄芩苷(960~1 500 mg·kg-1)对甲型流感病毒感染导致的小鼠死亡有良好的保护作用,可明显降低肺内流感病毒的血凝滴度和感染力,对小鼠肺组织炎性病变也有一定的防治作用[5]。本课题组前期体外实验结果表明,黄芩苷可拮抗甲型流感病毒抑制的细胞增殖,调控细胞周期分布,通过抑制 Caspase-8的激活进一步抑制 Caspase-3的活性而拮抗流感病毒感染诱导的细胞凋亡[6]。本实验制备了小鼠甲型流感病毒性肺炎模型,通过检测肺组织细胞凋亡受体途径FAS(CD95)、FAS-L(CD178)及凋亡关键酶Caspase-3的mRNA和蛋白的表达,初步探讨黄芩苷体内抗流感病毒感染的作用机制,以期为抗甲型流感病毒药物研发提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物与流感病毒 ICR小鼠,清洁级,体质量13~15g,小鼠及饲料均由北京维通利华实验中心提供。流感病毒亚甲型鼠肺适应株FM1由中国中医药研究院中医所提供,于9日龄鸡胚尿囊腔连续传代3次后,测血凝滴度为2-9,测定其对小鼠的半数致死量 (LD50)为10-5.75,确定造模浓度为10倍LD50。
1.1.2 实验药品与试剂 黄芩苷,纯度92%,由辽宁中医药大学初正云教授惠赠;利巴韦林(ribavirin,RBV)颗粒,四川百利药业有限责任公司,批号100725。TUNEL细胞凋亡原位检测试剂盒(北京中昊生物,批号1103110),TRIzol(Invitrogen公司),两步法反转录试剂盒 (TaKaRa公司),Agarose(Promega公司),DL2000 DNA Marker(北京全式金生物技术有限公司),引物由上海生工生物工程公司合成,FAS一抗(bioworld,批号 360755),FAS-L一抗(Bioworld,批号360751),Caspase-3 一抗(Beyotime,货号 AC031-1),β-actin一抗(Invitrogen公司),HRP标记山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,批号93974)。
1.2 方法
1.2.1 BAI对流感病毒性肺炎小鼠死亡的保护实验
1.2.1.1 分组及动物模型制备订购体质量13~15 g ICR小鼠120只,♀♂各半,随机分为正常对照组、模型组、RBV 组(100 mg·kg-1),BAI(93.75、187.5、375 mg·kg-1)组。将各组小鼠用乙醚轻度麻醉,除正常对照组以0.05 ml生理盐水滴鼻外,其余各组以0.05 ml的10倍LD50FM1稀释液滴鼻。
1.2.1.2 药物治疗与观察记录于感染后24 h开始灌胃给药,正常对照组、模型组灌同量的蒸馏水,其余各组按相应剂量给药,每天1次,共给药7 d,连续观察14 d,记录小鼠死亡数。
1.2.2 实验样本采集 ICR小鼠96只,♀♂各半,随机分为正常对照组、模型组、RBV组(100 mg·kg-1)、BAI组(93.75、187.5、375 mg·kg-1)。模型制备和给药途径同上。连续给药4 d,d 6禁食不禁水8 h,摘眼球放血致死,无菌摘取全肺,每组随机取4只全肺固定于10%甲醛溶液,其余存于液氮备用。
1.2.3 肺组织细胞凋亡观察 将固定样本行石蜡包埋切片,厚6 μm。TUNEL测试按试剂盒说明书进行,TUNEL染色切片中细胞核有黄棕色颗粒或斑片为凋亡细胞。
1.2.4 RT-PCR 检测 FAS、FAS-L 及 Caspase-3 mRNA表达 TRIzol提取各组肺组织总RNA,紫外分光光度计定量,取3 μg为模板反转录合成cDNA,以2 μl cDNA为模板进行PCR扩增。引物序列为:βactin(385bp):上游 5'-GGTGTGATGGTGGGAATG-3',下 游 5'-GCATAGCCCTCGTAGATGG-3';FAS(491 bp):上游 5'-CCGCAGGCTGCCCACACAGG-3',下游 5'-CTACCTTAGTGACCTTTTCA-3';FAS-L(113 bp):上游 5'-AGAACTCCGTGAGCCAAC-3',下游5'-TGTGTCTTCCCATTCCAG-3';Caspase-3(508 bp):上游 5'-GGGATCAAAGCGCAGTGTCCTGC-3',下 游 5'-AGACTCCGGCAGTAGTCGCCTC-3'。PCR反应总体积为20μl,扩增条件:预变性95℃ 5 min,变性95℃ 30 s、退火 55℃ 30 s、延伸 72℃ 30 s,共30个循环后72℃延伸3 min,4℃终止反应。RTPCR产物行1.2%琼脂糖凝胶电泳,溴化乙锭显色后用凝胶成像分析系统测定各目的条带与β-actin的IOD值,比值为目的基因的相对表达量。
1.2.5 Western blot检测 FAS、FAS-L 及 Caspase-3蛋白表达 将约100 mg肺组织样本于液氮中研磨致粉末,加入裂解液,Bradford法蛋白定量。取总蛋白40 μg,以1×样品缓冲液配平上样体积,沸水浴5 min后上样,SDS-PAGE电泳(浓缩胶80 V,分离胶100 V),半干电转膜仪转膜(30 mA,90 min);封闭后分别加入 FAS、FAS-L及 Caspase-3一抗,4℃过夜;TBS-T漂洗液洗膜10 min,共3次;加入HRP标记的二抗,37℃振荡60 min;加入ECL发光液,X线胶片曝光,经显影、定影、扫描后观察结果。应用Image-Pro Plus软件对扫描图像的目的条带进行灰度分析,各目的条带与β-actin的灰度比值为目的蛋白的相对表达量。
1.3 统计学分析 采用SPSS13.0软件分析。实验数据以±s表示,组间显著性比较采用t检验。
2 结果
2.1 BAI对小鼠死亡的保护作用 如Tab 1所示,正常对照组与RBV组无小鼠死亡,模型组死亡数最多,在BAI 3个剂量组中,375 mg·kg-1剂量组死亡数最少,确定BAI抗甲型流感病毒的最小有效浓度为 187.5 mg·kg-1。

Tab 1 Protection of BAI from death of mice(n=20)
2.2 BAI对小鼠肺组织凋亡细胞形态学及凋亡率的影响 TUNEL结果表明,细胞核呈棕黄色者为凋亡细胞,细胞呈典型的凋亡细胞形态学改变,细胞变小、变圆、核固缩,而正常细胞的细胞核不着色,见Fig 1。与正常对照组比较,模型组肺组织细胞凋亡率明显升高(P<0.01);与模型组比较,RBV组和BAI 187.5、375 mg·kg-1治疗组细胞凋亡率降低(P<0.05),BAI 93.5.mg·kg-1治疗组细胞凋亡率有降低(P >0.05),见 Tab 2。
2.3 BAI对肺组织FAS mRNA及蛋白表达的影响 RT-PCR和Western blot结果显示,模型组FAS mRNA和蛋白表达明显高于正常对照组 (P<0.01);与模型组比较,RBV 组和375 mg·kg-1治疗组FAS mRNA和蛋白表达降低(P<0.01),BAI 187.5 mg·kg-1治疗组FAS mRNA和蛋白表达降低(P <0.05),BAI 93.5.mg·kg-1治疗组 FAS mRNA和蛋白表达降低(P>0.05,P<0.05),见Fig 2。
Tab 2 Effect of BAI on apoptotic rate in FM1 infected mice lung(±s,n=15)

Tab 2 Effect of BAI on apoptotic rate in FM1 infected mice lung(±s,n=15)
△△P<0.01 vs normal;*P<0.05,**P<0.01 vs model
Group Dose/mg·kg-1Apoptotic rate/%Normal 4.132 ±1.164 Model 25.113 ±5.517△△RBV 100 12.703 ±3.338**BAI 93.75 20.748 ±4.924 187.5 16.117 ±3.173*375 13.796 ±3.362**
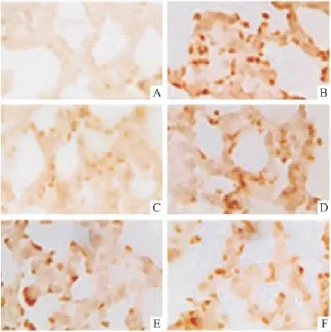
Fig 1 Effect of BAI on cell apoptosis of lung tissue by TUNEL(×400)

Fig 2 Effect of BAI on expression of FAS,FAS-L,Caspase-3 mRNA and proteins in FM1 infected mice lung(±s,n=5)
2.4 BAI对肺组织FAS-L mRNA及蛋白表达的影响 RT-PCR和Western blot结果显示,模型组FAS-L mRNA和蛋白表达明显高于正常对照组(P<0.01);与模型组比较,RBV组和BAI 187.5、375 mg·kg-1治疗组FAS-L mRNA和蛋白表达降低(P<0.01),BAI 93.75 mg·kg-1治疗组 FAS-L mRNA和蛋白表达降低(P>0.05,P<0.05),见Fig 2。2.5 BAI对肺组织Caspase-3 mRNA及蛋白表达的影响 RT-PCR和Western blot结果显示,模型组Caspase-3 mRNA和蛋白表达明显高于正常对照组(P <0.05,P <0.01);与模型组比较,RBV组和BAI 187.5、375 mg·kg-1治疗组 Caspase-3 mRNA 表达降低(P <0.05),RBV 组和 BAI 187.5、375 mg·kg-1治疗组蛋白表达降低(P <0.05,P <0.01),BAI 93.75 mg·kg-1治疗组 Caspase-3 mRNA和蛋白表达降低(P >0.05,P <0.05),见Fig 2。
3 讨论
细胞凋亡是一种重要的生命现象,在凋亡受体途径中,FAS/FAS-L系统是最主要的途径。FAS是细胞表面重要的死亡受体,与其配体FAS-L结合后活化并传导凋亡信号,从而诱导表达FAS的靶细胞凋亡。凋亡传导信号3个途径均以Caspase激活开始[7]。其中Caspase-3是Caspase家族中引发细胞凋亡的关键酶[8],当细胞发生凋亡时其变为有活性的Caspase-3并作用于Caspase家族的其他成员,最终降解靶细胞内的结构蛋白及维持基因组稳定和对细胞周期起调控作用的蛋白等,从而导致细胞凋亡[9]。
细胞凋亡的形态学特征是判断细胞凋亡的基础,形态特征的发生与凋亡细胞内生化变化密切相关[10],流感病毒感染机体可诱导宿主细胞发生凋亡[11-12]。对流感病毒感染与宿主细胞凋亡关系的研究,有利于阐释流感病毒对机体造成损伤的机制,便于采取措施控制流感病毒感染。为了研发预防和控制流感病毒流行的中药单体,本课题组前期做了抗流感病毒药物的筛选工作,最终选出BAI。前期的体外实验表明BAI(0.05~0.1 g·L-1)不但对流感病毒诱导的细胞氧化应激、炎症损伤具有保护作用,而且可拮抗甲型流感病毒抑制的细胞增殖、抑制Caspase-3的活性,同时发现BAI高剂量(>0.1 g·L-1)对实验细胞有一定毒性作用。本研究前期参照文献[5],分别设了 BAI 375、750、1 500 mg·kg-13个剂量组进行BAI抗流感病毒机制研究,结果发现不论是对肺指数、肺组织病理改变、还是对氧化损伤,BAI 375 mg·kg-1的疗效最好(待发)。为了确定BAI抗流感病毒的最小有效浓度,本实验进行了BAI对FM1肺炎小鼠死亡的保护实验,最终确定BAI最小有效浓度为187.5 mg·kg-1。
本实验形态学观察到模型组肺组织细胞凋亡率明显增多,经 BAI 187.5、375 mg·kg-1治疗后细胞凋亡率明显减少,通过RT-PCR和Western blot技术进一步测定各组肺组织FAS、FAS-L、Caspase-3 mRNA和蛋白表达,结果与形态学观察到的现象基本一致。这表明 BAI 187.5、375 mg·kg-1具有抑制流感病毒诱导引起的肺组织细胞凋亡作用。
凋亡的分子机制是涉及多种信号途径的网络调控机制,本实验仅探讨了BAI对凋亡受体途径FAS/FAS-L系统的影响,至于BAI对FAS/FAS-L系统的影响是直接还是间接作用,以及BAI是否影响其它凋亡途径将有待于进一步深入研究。
[1] 熊 英,傅颖媛,况南珍,等.黄芩苷抗白念珠菌作用及机制研究[J].中国药理学通报,2004,20(12):1404-7.
[1] Xiong Y,Fu Y Y,Kuang N Z,et al.Study on activity and mechanism of Baicalin against candida albicans[J].Chin Pharmacol Bull,2004,20(12):1404 -7.
[2] 陈 忻,张 楠,董晓丹,等.黄芩苷磷脂复合物抗炎时效初步研究[J].中国现代应用药学杂志,2007,24(5):359-62.
[2] Chen X,Zhang N,Dong X D,et al.Study on the time effect relationship of phytosomes of baicalin in anti-inflammatory effect[J].Chin JMAP,2007,24(5):359 -62.
[3] 况南珍,傅颖媛,黄彬红,等.黄芩苷对人肝癌细胞系SMMC7721抑瘤作用的实验研究[J].时珍国医国药,2008,19(6):1422-4.
[3] Kuang N Z,Fu Y Y,Huang B H,et al.An experimental study on inhibitory effect of baicalin on human hepatic carcinoma celline SMMC7721 in vitro[J].Lishizhen Med Mat Med Res,2008,19(6):1422-4.
[4] Zeng Y,Song C,Ding X,et al.Baicalin reduces experimental autoimmune encephalomyelitis[J].Braz J Med Biol Res,2007,40(7):1003 -10.
[5] 初正云,初 明,滕 宇.黄芩苷体内抗流感病毒作用[J].中国中药杂志,2007,32(22):2413 -5.
[5] Chu Z Y,Chu M,Teng Y.Effect of Baicalin on in vivo anti-virus[J].Chin J Chin Mat Med,2007,32(22):2413 -5.
[6] 张春晶,顾立刚,于海涛.黄芩苷干预甲型H1N1流感病毒感染诱导的 A549细胞周期分布及凋亡[J].病毒学报,2011,27(2):108-16.
[6] Zhang C J,Gu L G,Yu H T.Antagonism of baicalin on cell cyclical distribution and cell apoptosis in A549 cells infected with influenza A(H1N1)virus[J].Chin J Virol,2011,27(2)108 -16.
[7] 刘 伟,李庆军,卢绮萍.Caspase与细胞凋亡[J].新乡医学院学报,2005,22(1):67-70.
[7] Liu W,Li Q J,Liu Q P.Caspase and apoptosis[J].J Xinxiang Med Coll,2005,22(1):67 -70.
[8] Faubel S,Edelstein C L.Caspases as drug targets in ischmic organ injury[J].Curr Drug Targets Immune Endocr Metabol Disord,2005,5(3):269 -87.
[9] Xu J,Ji L D,Xu L H.Lead induced apoptosis in PC 12 cells:involvement of p53,Bcl-2 family and caspase3 [J].Toxicol Lett,2006,166(2):160- 7.
[10]慈云祥,张春阳,冯 军.细胞凋亡分析测试方法的研究进展[J].化学进展,1998,10(4):451-9.
[10]Ci Y X,Zhang C Y,Feng J.Progress in the analytical methods of apoptosis[J].Prog Chem,1998,10(4):451 -9.
[11] Toshihiro I,Kobayashi Y,Morita T,et al.Virulent influenza A viruses induce apoptosis in chickens[J].Virus Res,2002,84(1-2):27-35.
[12] Sumikoshi M,Hashimoto K,Kawasaki Y,et al.Human influenza virus infection and apoptosis induction in human vascular endothelial cells[J].J Med Virol,2008,80(6):1072 - 8.

