黄连素调节鞘氨醇激酶-1-磷酸鞘氨醇信号通路抗糖尿病小鼠肾损伤的研究
彭 晶,兰 天,黄凯鹏,黄 娟,谢 曦,黄河清
(1.中山大学药学院,2.广东药学院血管生物学研究所,广东广州 510006)
糖尿病肾病(diabetes nephropathy,DN)是糖尿病严重的慢性微血管并发症,又称糖尿病性肾小球硬化症。DN发病机制复杂,迄今尚未完全阐明[1]。鞘氨醇激酶-1-磷酸鞘氨醇(SphK1-S1P)信号通路与DN的关系近年来成为研究的热点,SphK1是催化S1P生成的关键酶[2]。研究表明:长期高血糖、糖基化终产物、氧化应激等可激活SphK1,进而导致S1P的生成增加。本课题组前期研究证实:黄连素(berberine,BBR)可以明显改善STZ诱导的糖尿病肾损伤大鼠的肾功能,明显抑制高糖诱导的肾小球系膜细胞的增殖,胶原合成和细胞外基质成分(如FN)表达,黄连素的上述作用可能与调节血糖与抗氧化应激相关联[3-4]。然而黄连素在此作用机制基础上是否进一步影响了SphK1-S1P信号通路以达到抗糖尿病肾损伤的效应?鉴于此,本研究拟采用四氧嘧啶诱导的糖尿病小鼠模型,研究黄连素是否通过调节肾脏SphK-S1P信号通路达到抗糖尿病肾损伤的作用?以深入探讨黄连素抗DN的作用机制。
1 材料与方法
1.1 实验动物 健康♂C57BL/6小鼠,SPF级,40只,体质量20~25 g,购自广州中山大学实验动物中心,使用实验动物质量合格证明编号:No 0033092;实验动物使用许可证号:SYXK(粤)2007-0081。
1.2 实验药物 四氧嘧啶购自美国Sigma公司;黄连素由陕西赛得高科生物科技有限公司提供,批号:20050220,中山大学测试中心鉴定纯度为95.13%。
1.3 动物实验设施 实验在中山大学实验动物中心动物实验部SPF级实验室进行,动物室内温度20℃ ~25℃、相对湿度40% ~70%、换气次数10~15次/h。实验环境合格证号:粤监证字2004B029,动物实验设施使用证明号:0001057。
1.4 模型复制与分组 依据文献[5]及预实验结果,四氧嘧啶诱导的糖尿病大、小鼠成模后12周左右可导致模型动物肾实质及肾功能的明显受损,因此本实验造模具体方法为:正常动物预喂养3 d后,选取30只小鼠禁食8 h后,单次腹腔注射四氧嘧啶(Alloxan,使用生理盐水新鲜配制)200 mg·kg-1。72 h后禁食6 h测血糖,血糖值≥11.1 mmol·L-1为糖尿病模型小鼠,选取模型动物16只,随机分为模型组、黄连素组,每组各8只。选同批次8只正常小鼠作为正常对照组。实验期间小鼠自由进食、饮水。不使用胰岛素等降糖药物。实验周期为12周。
1.5 实验给药 采用预防性给药。糖尿病模型复制成功后次日,黄连素组小鼠灌胃0.5%醋酸纤维素钠溶液制成的黄连素混悬液300 mg·kg-1·d-1。模型组和正常对照组给予等体积的0.5%醋酸纤维素钠溶液。每日给药时间8:00~9:00 am,每周给药6 d,共12周。
1.6 标本收集 实验结束前1天动物称体重,各组小鼠用代谢笼收集24 h尿液,以待测尿蛋白;各组动物空腹8 h后,称重之后从眼眶静脉丛采血,4℃3 000 r·min-1离心 10 min,分离血清,置于 -20℃冰箱中保存待测血糖(FBG)、血尿素氮(BUN)、血肌酐(Scr)。小鼠用脱臼法处死后取出肾脏,迅速用预冷生理盐水冲洗,除去被膜,游离肾脏,使用刀片将左肾沿正中矢状面纵向剖开,将左肾一半放于包埋盒中做好标记再一起放入于10%福尔马林液中固定,供肾组织病理观察;左肾另一半及右肾分离肾皮质,将所得的全部肾皮质迅速装入冻存管放入液氮中速冻,后转移到-80℃保存,供后续实验研究。
1.7 标本检测
1.7.1 肾功能相关指标的检测 空腹血糖采用One touch ultra雅培血糖仪及其配套试纸尾尖剪尾取血检测,单位用mmol·L-1表示。称取肾重与体重,计算肾重/体重的百分比(肾脏指数);BUN、Scr分别用酶法、速率法由HITACHI 7071A型全自动生化分析仪进行检测,单位分别用 mmol·L-1、μmol·L-1表示;24 h尿蛋白测定用磺基水杨酸-硫酸钠比浊法,单位用μg/24 h表示。
1.7.2 肾脏病理检测 将10%福尔马林液固定的肾组织,进行脱水、包埋、常规石蜡制片,切片厚度约4 μm,苏木素 -伊红(H-E)染色,用OLYMPUS CH-2型光学显微镜进行肾脏组织学观察。每张切片随机观察10个视野肾小球,测定肾小球面积。
1.7.3 Real-time PCR 实时定量 PCR采用 Bio-Rad iCycler Iq系统进行扩增。PCR反应液组份(25 μl反应体系)包括:12.5 μl SYBR Premix Ex TaqTM(2 × )(TaKaRa),2 μl cDNA,各 0.5 μl(5 pmol)上游引物和下游引物,以及9.5 μl灭菌蒸馏水。每个样品平行做3个。采用Primer Premier 5.0软件进行引物设计,实验中所用到的引物如下:小鼠SphK1(forward 5'-GAAGACCTGCTCATCAACTGC-3',reverse 5'-GGTGCCCACTGTGAAACG-3');TGF-β1(forward 5'-TGGTGGACCGCAACAAC-3',reverse 5'-GCACTGCTTCCCGAATGTC-3');FN(forward 5'-CACCCGTGAAGAATGAAG-3',reverse 5'-CAGGCAGGAGATTTGTTAG-3');ColⅣ(forward 5'-GCCTTCTCAAACAACACTC-3',reverse 5'-CCTCTGCTTCCCGTATCTC-3');内参 GAPDH(forward 5'-AGGAGTAAGAAACCCTGGAC-3', reverse 5'-CTGGGATGGAATTGTGAG-3')。各样本目的基因的CT值减去内参GAPDH的CT值,得到△CT值。再用各处理组的△CT值减去空白对照组值,得到△△CT值。最后采用方程2△△CT计算目的基因的相对表达水平。
1.7.4 Western blot 每组取肾组织皮质 20 mg,加300 μl的蛋白裂解液并加入蛋白酶抑制(PI),冰上进行匀浆,裂解后静止在冰浴上30 min,用移液器将裂解液移至1.5 ml离心管中,收集细胞裂解液至1.5 ml EP管中,BCA蛋白定量法测定各组蛋白质含量。经5%浓缩胶、10%分离胶(FN蛋白因分子量较大、采用8%分离胶)SDS-PAGE电泳分离蛋白质,每孔上样量30 μg总蛋白。用Bio-Rad电转仪将凝胶中的蛋白质转移至PVDF膜上,转膜电压为100V/350 mA,4℃电转90 min。TBS-T洗膜3次,每次10 min,5%脱脂奶粉室温封闭1 h;一抗采用5%BSA进行稀释。一抗4℃孵育过夜。实验中所孵育的一抗分别为:抗兔SphK1一抗(1∶1 000,Abcam,Cambridge,MA,USA),抗鼠FN 一抗(1 ∶500,Santa Cruz Biotechnology,Santa Cruz,CA.,USA),抗羊ColⅣ一抗(1 ∶500,Santa Cruz Biotechnology,Inc.,Santa Cruz,CA.,USA)。次日TBS-T洗膜洗3次,每次10 min,辣根过氧化物酶标记的二抗(稀释度1∶2 000;Proteintech Group,Inc,Chicago,IL,USA)室温孵育1 h,TBS-T洗膜3次,每次10 min后加入化学发光试剂,X线胶片曝光。采用美国UVP公司GDS8000系统摄取图像,LABWORK4.0凝胶蛋白分析软件对条带进行灰度分析。
1.7.5 鞘氨醇激酶活性测定 采用裂解液(20 mmol·L-1Tris-HCl,pH 7.4,20%glycerol,1 mmol·L-1β-mercaptoethanol,15 mmol· L-1NaF,1 mmol·L-1EDTA,1 mmol·L-1Na3VO4,1 mmol·L-1PMSF,1× protease inhibitor cocktail)从肾脏组织或肾小球系膜细胞提取含有SphK的蛋白液,经4℃,14 000×g离心20 min后,收集上清,采用BCA蛋白定量试剂盒进行蛋白定量。脂质成分用蛋白浓度进行归一化。
参考我们报道的方法[6]进行SphK活性的LCMS/MS法检测。30 μg总蛋白液用于酶活性测定.反应采用 2.5 μl 200 μmol·L-1C17-Sph(溶于 5%Triton X-100)和2.5 μl 20 mmol·L-1ATP 含 MgCl2(200 mmol·L-1),总体积50 μl。37℃水浴反应20 min 后,用5 μl 1 mol·L-1HCl和200 μl氯仿 ∶甲醇:浓盐酸(100∶200∶1,V/V)终止反应。然后加入10 ng S1P作为内标。剧烈涡旋后,加入60 μl氯仿和60 μl 2 mol·L-1KCl,4 ℃,12,000 ×g 离心5 min。下层的氯仿相转移到新的1.5 ml Eppendorf管,室温真空干燥60 min。挥干的残渣用100 μl流动相(methanol:0.1%formic acid=95∶5,V/V)重悬,然后剧烈涡旋1 min。终溶液进样10 μl进行液质联用(LC-MS/MS)(ThermoFinnigan)分析。
1.7.6 S1P定量实验 参照我们前期报道的方法[7],用LC-MS/MS法进行S1P定量分析。称量冰冻的肾脏组织样本(~20 mg),用400 μl的蒸馏水进行电动匀浆。细胞则用PBS刮取下来,离心,并用100 μl的PBS重悬,采用BCA法进行蛋白定量。S1P及相应的化合物采用甲醇沉淀抽提。混合液涡旋10 min后,4 ℃,12 000 r·min-1离心5 min,然后上清液转移至一干净的玻璃自动上样瓶中。每次进样10 μl进行LC-MS/MS分析。
2 结果
2.1 黄连素对Alloxan诱导的糖尿病小鼠肾脏功能相关指标变化的影响 从Tab 1看出,糖尿病模型组与正常对照组相比,血糖水平明显升高,体重明显下降,肾重/体重(肾脏指数)、血浆尿素氮、血浆肌酐、24 h尿蛋白均明显升高(P<0.01),提示12周时糖尿病小鼠已经出现明显的肾功能损伤。黄连素组与模型组相比血糖水平明显下降,并有效改善肾脏指数,降低血浆尿素氮、血浆肌酐、24 h尿蛋白等肾功能指标(P<0.05)。
Tab 1 Fasting blood glucose,body and kidney weight,and renal function parameters of alloxan-induced diabetic mice after 3 months of berberine treatment(±s,n=8)
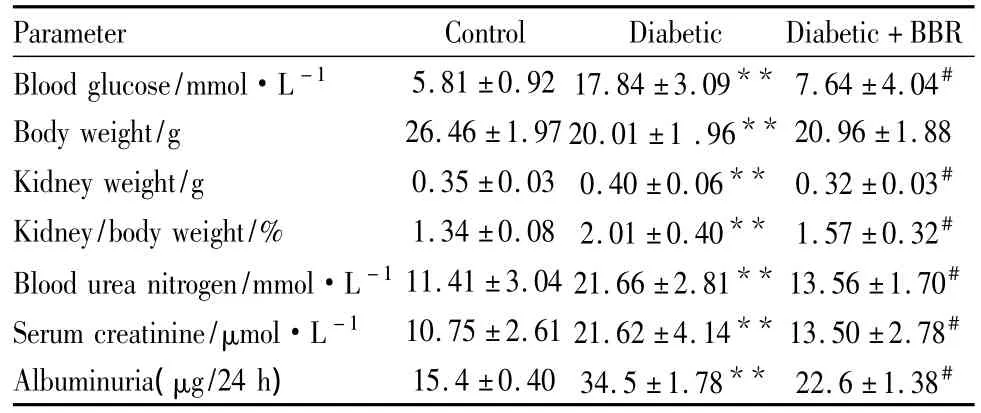
Tab 1 Fasting blood glucose,body and kidney weight,and renal function parameters of alloxan-induced diabetic mice after 3 months of berberine treatment(±s,n=8)
**P<0.01 vs normal;#P<0.05 vs model by ANOVA
Parameter Control Diabetic Diabetic+BBR Blood glucose/mmol·L -1 5.81 ±0.92 17.84 ±3.09** 7.64 ±4.04#Body weight/g 26.46 ±1.9720.01 ±1 .96** 20.96 ±1.88 Kidney weight/g 0.35 ±0.03 0.40 ±0.06** 0.32 ±0.03#Kidney/body weight/% 1.34 ±0.08 2.01 ±0.40** 1.57 ±0.32#Blood urea nitrogen/mmol·L -111.41 ±3.04 21.66 ±2.81** 13.56 ±1.70#Serum creatinine/μmol·L -1 10.75 ±2.61 21.62 ±4.14** 13.50 ±2.78#Albuminuria(μg/24 h)15.4 ±0.4034.5 ±1.78** 22.6 ±1.38#
2.2 黄连素对Alloxan诱导的糖尿病肾小鼠肾脏病理变化的影响 每组随机选取4张切片,光镜下每张切片视野区内对10个肾小球进行观察。结果如Fig 1所示。正常组:肾小球外层上皮细胞与肾小球囊有明显分界,结构未见明显异常。模型组:肾小球体积增大,系膜基质增生明显,系膜区基底膜区深染扩大,且肾小球内上皮细胞与外肾小球囊黏连。
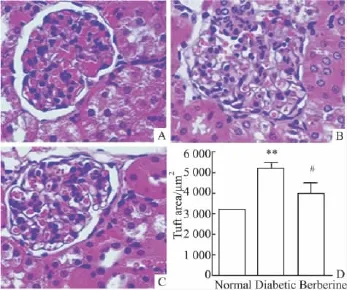
Fig 1 Haemotoxylin and eosin(HE)staining of glomeruli from normal(±s,n=5~8)
黄连素组:与模型组相比,肾小球体积增大明显改善,系膜区基质减少,肾小球内上皮细胞与外肾小球囊黏连减轻。
2.3 黄连素对Alloxan诱导的糖尿病肾损伤小鼠肾脏SphK1基因、蛋白表达及酶活性变化和产物S1P生成量的影响 从Fig 2看出,模型组SphK1基因、蛋白表达水平及活性较正常对照组明显升高,产物S1P的含量明显增加(P<0.01);黄连素治疗组SphK1基因、蛋白表达与活性水平以及产物S1P的含量与模型组相比明显下降(P<0.05),提示模型小鼠肾组织SphK1-S1P信号通路被激活,黄连素用药后能有效抑制模型小鼠肾组织SphK1-S1P信号通路的激活。
2.4 黄连素对Alloxan诱导的糖尿病小鼠肾脏细胞外基质FN和ColⅣ基因和蛋白表达 从Fig 3看出,模型组FN、ColⅣ的基因和蛋白表达水平较正常对照组明显升高(P<0.01);黄连素治疗组FN、ColⅣ的基因和蛋白表达与模型组相比明显下降(P<0.05);提示糖尿病肾损伤小鼠模型,肾脏细胞外基质成分FN、ColⅣ表达增多;黄连素能有效抑制FN、ColⅣ表达的增多。

Fig 2Effects of berberine on SphK1-S1P signaling pathway in alloxan-induced diabetic mouse kidney(±s,n=4)
3 讨论
本研究使用尾静脉注射60 mg·kg-1四氧嘧啶建立C57BL/6糖尿病小鼠模型,实验周期12周。整个实验期间,糖尿病组小鼠表现为多食、多饮、多尿、消瘦、行动迟缓等典型的糖尿病症状,血糖维持在较高水平(空腹血糖值>11.1 mmol·L-1),实验结束时(12周),糖尿病组、模型组小鼠肾脏肥大指数(肾重/体重比)、血尿素氮、血肌酐、24 h尿蛋白等较正常组明显升高;肾小球HE染色显示肾小球肥大,系膜基质增生明显,肾小球系膜区、基底膜区明显深染扩大,且肾小球内上皮细胞与外肾小球囊粘连,提示肾脏肥大、肾小球受损、肾功能障碍等糖尿病肾损伤模型的形成。黄连素治疗组与模型组相比,能明显降低血糖,降低肾脏指数、尿素氮、血肌酐与尿蛋白,改善肾小球病理变化等,表明黄连素能明显改善糖尿病肾损伤模型的肾功能与肾实质的病理变化,这与前期的研究结论相一致[3]。黄连素抗糖尿病肾病的效应是影响多因素的综合效应,我们在研究发现部分效应与其降低血糖、抗氧化应激、调节多元醇通路相关的基础上,本实验进一步观察了黄连素的上述效应与调节SphK1-S1P信号通路的关系。
近年来,SphK1-S1P信号通路与包括糖尿病肾病在内的糖尿病性血管并发症的关系日益受到关注,成为相关领域研究的热点。研究发现,用AGEs处理肾小球系膜细胞(GMC),发现当AGEs低浓度时,神经酰胺酶和鞘氨醇激酶活性明显升高,导致S1P积聚,诱使GMC增殖。观察STZ诱导小鼠4 d后肾脏中SphK活性和S1P含量的变化,结果发现随着肾小球系膜细胞轻度增殖,肾脏中SphK活性和S1P均明显增加,提示SphK-S1P信号通路可能参与了糖尿病肾小球增殖过程[8-9]。本研究显示:用四氧嘧啶诱导糖尿病小鼠模型12周后,模型组小鼠在肾小球结构异常、肾功能降低的基础上,SphK1蛋白表达与活性、S1P含量较正常组相比明显升高;黄连素治疗组与模型组相比,可明显降低SphK1蛋白表达与活性及其产物S1P含量;提示糖尿病小鼠的肾损伤伴随有肾组织的SphK1-S1P信号通路的激活,而黄连素能有效抑制糖尿病肾损伤小鼠肾组织的SphK1-S1P信号通路的激活。

Fig 3 A ~ C Effects of berberine on FN and ColⅣ mRNA and protein expression in alloxan-induced diabetic mouse kidney(±s,n=3)
S1P既可分泌到胞外直接与G蛋白偶联S1P受体结合发挥作用,又可在胞内发挥第二信使作用,导致细胞增殖、血管增生等生物学效应,引起FN、胶原等细胞外基质的积聚,参与肾脏纤维化过程[10-11]。因此本研究在观察模型动物肾组织SphK1蛋白表达与活性、S1P含量的基础上,进一步观察了模型动物肾组织细胞外基质成分FN、ColⅣ的变化。结果显示:四氧嘧啶诱导的糖尿病小鼠肾组织FN、ColⅣ的mRNA和蛋白表达较正常组相比明显增加,提示在糖尿病状态下,SphK1-S1P信号通路激活后,可能进而引起FN、ColⅣ等细胞外基质的积聚,导致肾脏结构与功能受损。黄连素治疗组能明显降低模型动物的 FN、ColⅣ的表达,提示黄连素抑制SphK1-S1P信号通路激活的激活,也可能参与下调FN与胶原等细胞外基质的生成、改善糖尿病肾损伤的病变进程。
综上所述:本实验通过四氧嘧啶诱导的糖尿病小鼠模型,初步明确了黄连素对模型小鼠具有抑制肾组织SphK1-S1P信号通路的激活、下调FN、ColⅣ等细胞外基质积聚的效应,提示黄连素抑制SphK1-S1P信号通路的激活可能是其抗糖尿病肾病的机制之一,值得深入研究探讨。
[1] Panchapakesan U,Chen X M,Pollock C A.Drug insight:thiazolidinediones and diabetic nephropathy——relevance to renoprotection[J].Nature Clin Pract Nephrol,2005,1(1):33 -43.
[2] Taha T A,Hannun Y A,Obeid L M.Sphingosine kinase:biochemical and cellular regulation and role in disease[J].J Biochem Mol Biol,2006,39:113 -31.
[3] 刘慰华,黄河清,邓艳辉,等.黄连素对糖尿病肾损伤大鼠肾功能、氧化应激、肾脏醛糖还原酶的影响[J].中国药理学通报,2008,24(7):955-9.
[3] Liu W H,Huang H Q,Deng Y H,et al.Effects of berberine on renal function,oxidative stress and renal aldose reductase in rats with diabetic nephropathy[J].Chin Pharmacol Bull,2008,24(7):955-9.
[4] 覃肇源,刘慰华,黄河清.黄连素对高糖培养的大鼠肾小球系膜细胞FN及p38MAPK信号通路的影响[J].中国药理学通报,2009,25(9):1201 -5.
[4] Qin Z Y,Liu W H,Huang H Q,et al.Effects of berberine on fibronectin and p38MAPK signal pathway in rat glomerul armesangial cells cultured under high glucose condition[J].Chin Pharmacol Bull,2009,25(9):1201 -5.
[5] im Walde S S,Dohle C,Schott-Ohly P,Gleichmann H.Molecular target structures in alloxan-induced diabetes in mice[J].Life Sci,2002,71(14):1681 -94.
[6] Lan T,Bi H,Xu S,Le K,et al.Determination of sphingosine kinase activity in biological samples by liquid chromatography-tandem mass spectrometry[J].Biomed Chromatogr,2010,24(10):1075-83.
[7] Lan T,Shen X,Liu P,Liu W,et al.Berberine ameliorates renal injury in diabetic C57BL/6 mice:Involvement of suppression of SphK - S1P signaling pathway[J].Arch Biochem Biophys,2010 ,502(2):112-20.
[8] Geoffroy K,Wiernsperger N,Lagarde M,El Bawab S.Bimodal effect of advanced glycation end products on mesangial cell proliferation is mediated by neutral ceramidase regulation and endogenous sphingolipids[J].J Biological Chem,2004,279:34343 -52.
[9] Geoffroy K,Troncy L,Wiernsperger N,et al.Glomerular proliferation during early stages of diabetic nephropathy is associated with local increase of sphingosine-1-phosphate levels[J].FEBS letters,2005579:1249-54.
[10] Xin C,Ren S,Kleuser B,et al.Sphingosine 1-phosphate crossactivates the Smad signaling cascade and mimics transforming growth factor-beta-induced cell responses[J].J Biological Chem,2004,279:35255 -62.
[11] Visentin B,Vekich J A,Sibbald B J,et al.Validation of an antisphingosine-1-phosphate antibody as a potential therapeutic in reducing growth,invasion,and angiogenesis in multiple tumor lineages[J].Cancer Cell,2006,9:225 - 38

