人肺腺癌A549细胞株上皮钙黏素基因甲基化及尿多酸肽干预的研究
王亚丽,陈龙舟,李青国
(扬州大学医学院附属医院淮安市妇幼保健院乳腺科,江苏淮安223002)
表观遗传学异常在肿瘤的发生、发展过程中的作用普遍受到人们重视。基因启动子区域CpG岛的甲基化导致的基因表达的失活是表观遗传学改变的重要方式之一。大量的研究表明,肺癌中存在多种与其发生、发展相关的抑癌基因或促凋亡基因启动子甲基化,其中E-cadherin基因启动子区域CpG岛甲基化是肺癌发病的重要机制之一[1]。E-cadherin基因表达缺失或降低以及功能缺陷与肺癌的分化、侵袭和转移以及生存与预后都存在密切相关,并且大多成负相关[2]。使E-cadherin基因启动子区域CpG岛去甲基化有望成为继手术、放化疗后治疗肺癌的新方法。体内外实验表明,尿多酸肽(cell differentiation agentⅡ,CDA-Ⅱ)具有诱导包括白血病在内的多种肿瘤细胞凋亡和分化的作用[3]。在此试图研究A549细胞E-cadherin甲基化状态、CDA-Ⅱ对 A549细胞株的生长抑制作用及E-cadherin甲基化状态的影响,探讨CDA-Ⅱ成为新的去甲基化药物的可能性。
1 材料与方法
1.1 主要试剂 CDA-Ⅱ购于合肥永生制药公司,系从人尿中提取经纯化制得的,含多种有机酸和相对分子质量<6×103的多肽(每100 mL含马尿酸300 mg,苯乙酰谷氨酰胺300 mg,多肽150 mg,4-羟基苯乙酸 50 mg,5-羟基吲哚乙酸 10 mg;以马尿酸含量计,其浓度为3 g/L);细胞基因组DNA提取试剂盒购于北京天根公司;人体E-cadherin基因甲基化检测试剂盒购于GENMED公司。
1.2 细胞株及细胞培养 人肺腺癌A549细胞株购买于中国科学院上海细胞所。将肿瘤细胞培养于含10%小牛血清、0.1 U/L 青霉素、0.1 μg/L 链霉素的DMEM培养液中,置于37℃,5%CO2,100%饱和湿度的温箱内培养,每隔3天更换一次培养液,并取对数生长期细胞用于实验。
1.3 噻唑蓝(methyl thiazolyl tetrazolium,MTT)测定细胞增殖 将A549细胞按每孔1.0×104个细胞接种于96孔培养板内,实验组分别加入不同浓度的CDA-Ⅱ,对照组加入等体积的 DMEM,置于37℃5%CO2的培养箱内培养24 h。终止培养前4 h每孔加 20 μL MTT(0.005 mg/L),培养结束后,弃上清,每孔加 150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),震荡10 min,至结晶物充分溶解为止。用全自动酶标仪检测490 nm处的吸光度(A490)值,以培养液孔为空白对照调零。计算CDA-Ⅱ每一剂量的细胞存活率。细胞存活率=(CDA-Ⅱ平均A值/细胞对照平均A值)×100%。
1.4 甲基化PCR(MSP) 收集不同处理组细胞,参照细胞基因组DNA提取试剂盒说明书提取基因组DNA,在UV3000紫外分光光度仪上测定吸光度值鉴定 DNA 纯度,A260/A280比值均在1.8~2.0 之间。取2 μg基因组DNA参照人体E-cadherin基因甲基化检测试剂盒产品说明书进行甲基化修饰。分别取修饰DNA及未修饰DNA100 ng进行MSP反应。E-cad基因甲基化引物(M):F:5'-TTAGGTTAGAGGGTTATCGCGT-3';R:5'-TAACTAAAAATTCACCTACCGAC-3'。非甲基化引物(U):F:5'-TAATTTTAGGTTAGAGGGTTATTGT-3';R:5'-CACAACCAATCAACAACACA-3'。反应体系的建立(25 μL):双蒸水(d dH2O)7.0 μL,预混 15.0 μL,上、下引物各1.0 μL,模板DNA 1.0 μL(100 ng)。PCR反应时间和温度:95℃变性9 min,95℃变性30 s,甲基化引物在57℃退火30 s,非甲基化引物在53℃退火30 s,72℃延伸30 s,循环扩增 35次,72℃5 min。使用 Gene Amp PCR System 2400扩增仪(美国PE公司)。取10 μL PCR产物用1.8%琼脂糖凝胶电泳,以 TIANGEN MD101为标准DNA Marker同步电泳,紫外灯下观察,凝胶成像系统记录并分析。M阳性,U阴性为完全甲基化;M阳性,U阳性为部分甲基化;M阴性,U阳性为非甲基化。以各条带的灰度值作为此样本E-cadherin DNA表达的相对强度。
1.5 统计学方法 每个实验重复5次,结果采用SPSS 13.0统计软件处理。SPSS对MTT数据进行概率单位模型分析,回归方程经过几次叠代运算后确定,如方程拟合优度检验χ2值、P值(>0.05),说明曲线拟合良好,并显示各效应概率水平的剂量值(包括0.50,即IC50)。配对资料之间的比较采用配对样本 t检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 CDA-Ⅱ对A549细胞的生长影响 CDA-Ⅱ可显著抑制A549细胞株的生长,并呈剂量依赖性增高(χ2=0.098,P >0.05),2.0 g/L 的 CDA-Ⅱ作用 24 h后细胞存活率仅为3.9%(表1)。半数抑制浓度IC50为 0.23 g/L。
2.2 A549细胞 E-cadherin基因甲基化状态 在A549细胞中E-cadherin基因甲基化状态为部分甲基化(图1)。

2.3 CDA-Ⅱ对A549细胞 E-cadherin基因甲基化程度的影响 经 0、0.125、0.25、0.5 g/L CDA-Ⅱ作用24 h后,A549细胞E-cadherin基因甲基化程度明显降低,呈剂量依赖性(F=37.681,P <0.05)(图 2,表 2)。经 0.25 g/L CDA-Ⅱ作用 0、24、48、72 h后,A549细胞E-cadherin基因甲基化程度明显降低,呈时间依赖性(F=26.745,P <0.05)(图 3,表3)。
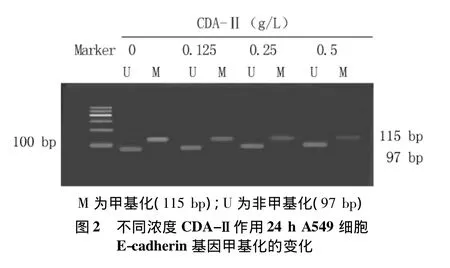

表2 不同浓度CDA-Ⅱ作用24 h A549细胞E-cadherin-M表达灰度值


表3 0.25 g/L CDA-Ⅱ作用不同时间A549细胞E-cadherin-M表达灰度值
3 讨论
肺癌是常见的致死性肿瘤之一,肺癌病死率之所以这样高,很大程度上是由于临床诊断的肺癌多为进展期肺癌,而目前对中晚期肺癌的疗效都不理想。有研究表明,由于基因启动子区发生甲基化而去表达的基因,经去甲基化药物(如5-脱氧氮杂胞苷)处理后可以重新表达。Momparler等[4]对7例未经任何化疗药物治疗的Ⅳ期非小细胞肺癌患者用5-脱氧氮杂胞苷周期性治疗后,6例患者的生存时间随着化疗周期的延长而延长,其中1例患者经过5个周期的化疗后生存了6年。但5-脱氧氮杂胞苷价格昂贵,且在临床使用中会出现一些不良反应,如恶心、呕吐、腹泻、骨髓抑制、基因突变等,可能是这种药物的特异性较差或剂量较大而对正常细胞的毒性作用所致。这些缺点限制了它在临床上的广泛应用。
CDA-Ⅱ是新研发的抗肿瘤药物,它是健康人尿经酸化、吸附、洗脱、真空干燥等工艺流程制成的含有多种有机酸和多肽成分的非细胞毒性尿萃取物。体外实验中,CDA-Ⅱ通过激活过氧化物酶体增生物激活受体γ通路诱导神经胶质瘤SWO-38细胞分化[5]。在肝细胞癌模型中,CDA-Ⅱ可改变蛋白组学外观,诱导细胞分化抑制肿瘤生长[6]。目前普遍认为促进肿瘤细胞分化,诱导肿瘤细胞凋亡是CDA-Ⅱ抗肿瘤作用机制。新的研究发现,CDA-Ⅱ通过下调MUTZ-1细胞DNA甲基转移酶(DNA methyltransferase,DNMTs)DNMT1、DNMT3A 和 DNMT3B表达,发挥去甲基化作用,使PTEN启动子区CpG岛甲基化水平降低,进而诱导MUTZ-1细胞凋亡[7]。Ⅱ期临床结果显示,CDA-Ⅱ能显著改善晚期癌症患者的生活质量[8]。
本研究表明,A549细胞中存在E-cadherin基因部分甲基化,经CDA-Ⅱ作用后,E-cadherin基因甲基化程度显著降低,且呈剂量依赖性及时间依赖性。推测CDA-Ⅱ作为一种甲基转移酶抑制剂,通过抑制甲基转移酶的活性,抑制或逆转E-cadherin基因的甲基化状态,使E-cadherin基因重新表达,恢复其细胞周期调节的功能,进而抑制细胞的过度增殖,达到治疗肺癌的目的。在国内CDA-Ⅱ以其良好的临床效果及相对低廉的价格,有望替代5-脱氧氮杂胞苷,成为治疗存在E-cadherin基因甲基化肺癌的靶向药物。
[1]王红兵,苗慧,张敬川.肺癌E-cadherin基因启动子CpG岛甲基化与蛋白表达的关系及其意义[J].中国癌症杂志,2007,17(8):603-606.
[2]Nakata S,Sugio K,Uramoto H,et al.The methylation status and protein expression of CDH1,p16(INK4A),and fragile histidine triad in nonsmall cell lung carcinoma:epigenetic silencing,clinical features,and prognosticsignificance [J].Cancer,2006,106(10):2190-2199.
[3]Huang J,Yang M,Liu H,et al.CDA-Ⅱ,a urinary preparation,induces growth arrest and apoptosis of human leukemia cells through inactivation of nuclear factor-kappaB in a caspase-dependent manner[J].Food Chem Toxicol,2009,47(1):40-49.
[4]Momparler RL,Eliopoulos N,Ayoub J.Evaluation of an inhibitor of DNA methylation,5-aza-2'-deoxycytidine,for the treatment of lung cancer and the future role of gene therapy[J].Adv Exp Med Biol,2000,465(4):433-446.
[5]Lin CL,Wang MH,Qin YF,et al.Differentiation of SWO-38 glioma cells induced by CDA-2 is mediated by peroxisomeproliferator-activated receptor gamma[J].J Neurooncol,2009,95(1):29-36.
[6]Fan HZ,Liu H,Zhang C,et al.Comparative proteomics and molecular mechanical analysis in CDA-Ⅱinduced therapy of LCI-D20 hepatocellular carcinoma model[J].J Cancer Res Clin Oncol,2009,135(4):591-602.
[7]Huang J,Yang M,Liu H,et al.Human urine extract CDA-2 induces apoptosis of myelodysplastic syndrome-derived MUTZ-1 cells through the PI3K/Akt signaling pathway in a caspase-3-dependent manner[J].Acta Pharmacol Sin,2008,29(8):951-964.
[8]Li Q,Feng FY,Chen Q,et al.Multicenter phase Ⅱ clinical trial of uroacitides injection in the treatment for advanced malignant tumors[J].Zhonghua Zhong Liu Za Zhi,2008,30(7):534-537.

