地榆微波灭菌的研究探讨
王彩英
(溧阳市人民医院,江苏 溧阳 213300)
本品为蔷薇科植物地榆Sanguisorba officinalis L.或长叶地榆Sanguisorba officinalis L.var.longifolia(Bert)Yu et Li的干燥根,前者主产南北各地,后者习称“绵地榆”[1],主产于安徽、浙江、江苏、江西等地。始载于《神农本草经》,被列为中品。其性微寒,味苦、酸、涩,归肝、大肠经,具有凉血止血、解毒敛疮的功效,用于便血痔血、水火烫伤、血痢崩漏、痈肿疮毒等症。地榆根中含有多种苷类及酚酸类化合物,而鞣质为地榆止血的主要成分。近年来,有关地榆皂苷及黄酮类成分的研究渐多,亦发现了一些新的药理作用,如抗氧化、抗癌、增强免疫等,这些都有助于开辟地榆的临床新用途。地榆在试管内对金黄色葡萄球菌、乙型溶血性链球菌、肺炎球菌、脑膜炎球菌以及白喉、痢疾、大肠、伤寒、副伤寒、绿脓、人型结核等杆菌都有抑制作用,对某些致病真菌也有不同程度的抑制作用[2]。本文旨在通过薄膜过滤法[3],消除地榆抗菌成分对微波灭菌效果的结果观察,结合姚远[4]、应月青[5]、梁霞[6]等人的文献综述,论证微波灭菌对于医院制剂原材料灭菌的可行性,并通过多次实验寻求最佳灭菌效果所需要的各项条件。
1 试药与样品
1.1 药材
地榆:购于溧阳市医药公司,产品批号:2010080,安徽海鑫中药饮片有限公司出品。
1.2 仪器
微波灭菌机:WG-5,5000W (山东省青州市精诚医药装备制造有限公司);300g摇摆式高速万能粉粹机:DFY-300,1000W(温岭市林大机械有限公司);马头牌JYT-5架盘药物天平(上海光正医疗仪器有限公司);电热恒温干燥箱:G2X-DH·400-BS-Ⅱ,800W (上海跃进医疗器械厂);电热恒温培养箱:HH·BII·420-BY-Ⅱ,400W (上海跃进医疗器械厂);霉菌培养箱:MJ-160B-Ⅱ,200W(上海跃进医疗器械厂);立式灭菌机:LMQ·C51L,1200W(山东新华器械医疗股份有限公司);菌落计数器:XK97-A(姜堰市新康医疗器械有限公司)。
1.3 试液、稀释剂以及培养基
pH7.0无菌氯化钠-蛋白胨缓冲液;营养琼脂培养基;玫瑰红钠琼脂培养基;酵母浸出粉胨葡萄糖琼脂培养基;胆盐乳糖增菌液;胆盐乳糖发酵培养基;MUG培养基;营养肉汤培养基;改良马丁培养基;改良马丁琼脂斜面培养基。
1.5 实验用菌株
大肠埃希菌 (Escherichia coli):[CMCC(B)44102];金黄色葡萄球菌(StapHylococcus aureus):[CMCC(B)26003];枯草芽孢杆菌 (Bacillus subtilis):[CMCC(B)63501];白色念珠菌(Candida albicans):[CMCC(F)98001];黑曲霉(Aspergillus niger):[CMCC(F)98003]。
2 实验方法
2.1 微波灭菌
在无菌条件下,取地榆饮片6份,3份用纯化水喷淋至微湿,另3份不经喷淋直接置于干燥板上灭菌,在同样的环境下微波灭菌,做三组平行试验。取地榆饮片2份,一份打粉后置于微波灭菌机中灭菌10min,一份原片置于微波灭菌机中灭菌12min。分别多点取样,留用观察。在无菌环境下,先用纯化水将所需实验用地榆饮片淋湿,使其达到一定含水量,以保证最佳灭菌效果[7]。将喷淋的地榆饮片均匀铺于微波灭菌板上,厚度约0.5cm。调节微波灭菌机灭菌波段,我们选择PP01机组,使用微波灭菌机总功率的1/3,灭菌温度控制在75℃~85℃,分别灭菌7、8、9、10、11、12、13、14、15、16min。
2.2 供试品制备
将灭菌后的地榆饮片置于300g摇摆式高速万能粉粹机中粉碎成细粉。取样品适量,放于无菌一次性培养皿中备用。
2.3 无菌检查方法验证
2.3.1 试验菌种及菌液制备

取各菌浓培养液,按1mL→9mL pH7.0无菌氯化钠-蛋白胨缓冲液的10倍稀释法,制成含菌50~100cfu/mL的供试菌液。
2.3.2 薄膜过滤法验证
①试验组:将规定量的地榆供试品按薄膜过滤法过滤,冲洗,在最后一次冲洗液中加入小于100cfu的试验菌,过滤,取出滤膜接种至改良马丁培养基中;②对照组:另取一装有同体积培养基的容器,加入等量试验菌,作为对照。按规定培养3~5d,各试验菌同法操作。
结果判断:使用薄膜过滤法的供试品容器中的试验菌生长良好,则供试品地榆粉末的该检验量在该检验条件下无抑菌作用或其抑菌作用可以忽略不计,照此检查法和检查条件进行供试品的无菌检查。故宜采用薄膜过滤法检查微生物限度。
2.3.3 菌落计数的验证
①试验组:薄膜过滤法计数:取规定量试验可能用的最低稀释级供试液,过滤,冲洗,在最后一次的冲洗液中加入50~100cfu试验菌,过滤,取出滤膜,菌面朝上贴在营养琼脂培养基或者玫瑰红钠琼脂培养基或酵母浸出粉胨葡萄糖琼脂培养基平板上置相应的温度培养相应的时间。②菌液组:分别测定所加的试验菌数,菌—>平皿;③供试品对照组:取规定量供试液,按菌落计数方法测定供试品的细菌、霉菌和酵母菌数(即供试品的本底菌数);④稀释剂对照组:用相应的稀释液替代供试品,加入试验菌,使最终菌浓度为每1mL供试液含50~100cfu,按试验组的供试液制备方法和菌落计数方法测定其菌数。
回收率计算:①试验组:(试验组-供试品组)/菌液组×100%
②稀释剂组:稀释剂组/菌液组×100%
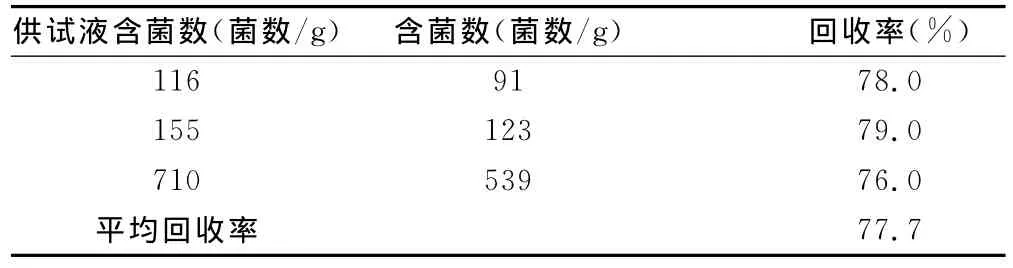
表1 薄膜过滤法菌回收率
结果判断:在3次独立的平行试验中,稀释剂对照组的菌回收率和试验组的菌回收率均不低于70%,说明薄膜过滤法计数可行。
2.3.4 控制菌检查方法验证
程序:(预增菌培养)增菌培养→分离培养→纯培养→革兰染色镜检、生化反应。①试验组:取规定量供试液及10~100cfu试验菌加入增菌培养基中,依相应控制菌检查法进行检查。当采用薄膜过滤法时,取规定量供试液,过滤,冲洗,试验菌应加在最后一次冲洗液中,过滤后,注入培养基或取出滤膜接入增菌培养基中;②阴性菌对照组:供试液+阴性菌,同试验组——验证该控制菌检查方法的专属性[10];③阴性对照菌株:金黄色葡萄球菌——验证大肠埃希菌、大肠菌群、沙门菌;大肠埃希菌——验证金黄色葡萄球菌、铜绿假单孢菌、梭菌检查。
2.4 微生物限度检查法
2.4.1 实验用培养基以及器材消毒灭菌
将配制好的pH7.0氯化钠-蛋白胨缓冲液、营养琼脂培养基、玫瑰红钠琼脂培养基、胆盐乳糖增菌液、胆盐乳糖发酵培养基、PYD培养基、MUG培养基分别放于相应锥形瓶或试管中,瓶口或管口用灭菌塞子塞好,并用布扎好,于立式灭菌机中121℃消毒灭菌1h。玻璃培养皿罐装于带盖不锈钢桶,置于恒温干燥箱中160℃灭菌120min。
2.4.2 供试品溶液配制
精密称取灭菌后的地榆10g至200mL锥形瓶,加pH 7.0氯化钠-蛋白胨缓冲液至100mL,配成1:10供试液。
2.4.3 细菌、霉菌和酵母菌计数
(1)10倍递增稀释试验组。用一次性无菌注射器吸取1:10供试液1mL,均匀经滤膜滤过,再用不少于100mL pH7.0氯化钠-蛋白胨缓冲液溶液冲洗滤膜,用镊子将滤膜取出,菌面朝上贴于无菌双碟底部。另取1mL供试液,注入9mLpH7.0氯化钠-蛋白胨缓冲液,配成1:100稀释级供试液,同法制备四个碟子。再取1:100稀释级供试液1mL配成1:1000稀释级,同法再制备四个碟子。每一稀释级每种培养基至少注2个平皿。
(2)阴性对照。待各级稀释液注皿完毕后,用1支1mL针管吸取稀释剂(pH7.0氯化钠-蛋白胨缓冲液)各1mL,分别注入四个平皿中。其中两个作细菌阴性对照,两个作霉菌、酵母菌数阴性对照。另外准备两个无菌空平皿作培养基空白。
(3)倾注培养基。将预先配制好的细菌计数用的营养琼脂培养基;霉菌、酵母菌计数用的玫瑰红钠琼脂培养基和YPD琼脂培养基熔化,冷却至约45℃时,倾注上述各个平皿约15mL,以顺时针或逆时针方向快速旋转平皿,使供试液或稀释液与培养基混匀,盖上陶瓦盖,置操作平台上待凝。
(4)培养。细菌计数平板倒置于32℃电热恒温培养箱中培养48h。霉菌、酵母菌计数平板倒置于25℃、相对湿度75%霉菌培养箱中培养72h。
(5)菌落计数。将培养好的平皿放置于菌落计数器上或从平板背面直接以肉眼点计,以透射光衬以暗色背景,仔细观察。尽量不漏计细小的琼脂层内及平皿边缘生长的菌落。并注意与地榆供试品粉末颗粒、培养基沉淀物、气泡的鉴别。必要时,用放大镜或低倍显微镜直接观察。菌落极小不易辨认的延长培养时间到5d。
2.4.4 控制菌检查——大肠埃希菌
(1)薄膜过滤法。用一次性无菌注射器吸取供试液10mL,注入稀释剂100mL中,摇匀,以无菌操作加入装有直径45mm,孔径0.45μm微孔滤膜的薄膜过滤器中,过滤,用稀释剂冲洗滤膜,不少于100mL,用镊子取出滤膜,加入预先配制好的100mL胆盐乳糖增菌液培养基中。另一份100mL胆盐乳糖(BL)培养基中加入等量稀释剂作阴性对照。培养18~24h,必要时延长到48h。取上述培养物0.2mL,接种至含5mLMUG培养基的试管内,培养,于5、24h在366nm紫外光下观察,同时用未接种的MUG培养基作本底对照。观察后,沿培养基的管壁加入数滴靛基质试液。液面呈玫瑰红色,为靛基质阳性;呈试剂本色,为靛基质阴性。本底对照的MUG和靛基质应为阴性。如MUG阳性,靛基质阳性,判断检出大肠埃希菌;如MUG阴性、靛基质阴性,判供试品未检出大肠埃希菌。如呈现MUG阳性、靛基质阴性或MUG阴性、靛基质阳性时,应将上述供试品BL增菌培养液轻轻摇动,以接种环沾取1~2环培养液划线于EMB或麦康凯琼脂培养基平板上,培养18~24h。若平板上无菌落生长、或生长菌落与菌落形态特征不符,判供试品未检出大肠埃希菌。
(2)结果及结论。在紫外光下管内培养物不呈现荧光,MUG阴性。加入靛基质试液后,液面呈试剂本色,为靛基质阴性。判断地榆粉末供试品中未检出大肠埃希菌[8]。
2.4.5 大肠菌群
(1)增菌培养。取不少于10mL胆盐乳糖发酵培养基管3支,加入1:10供试液1mL(含供试品0.1g);1:100稀释的供试液1mL(含供试品0.01g)和1:1000稀释的供试液1mL(含供试品0.001g)。取2支胆盐乳糖发酵培养基10mL管,一支加入稀释剂1mL作为阴性对照,一支不加作为培养基空白对照。均培养18~24h,观察结果。加供试液的胆盐乳糖发酵培养基管中无菌生长或有菌生长但不产酸产气,则判断该管未检出大肠菌群,若胆盐乳糖发酵管产酸产气,应进一步分离培养。
(2)分离培养。将上述产酸产气的发酵管中的培养物,分别划线接种于曙红亚甲兰琼脂培养基或麦康凯琼脂培养基的平板上,培养18~24h。若平板上无菌落生长,或生长的菌落与特征不符或为非格兰阴性无芽孢杆菌,判断未检出大肠菌群;若平板上生长有菌落形态特征菌或者疑似菌落,且为格兰阴性芽孢杆菌,应进行确证实验。
(3)确证实验。从上述分离平板上挑出4~5个疑似菌落,接种于乳糖发酵管中,培养24~48h。若产酸产气,判断胆盐乳糖发酵管中检出大肠菌群,否则判未检出大肠菌群。

表2 地榆饮片干片与湿片微波灭菌效果比较

表3 不同工艺程序对灭菌效果的影响

表4 微波灭菌不同时间效果
3 结果与讨论
在实验过程中,不断摸索最佳灭菌条件,经过多次重复试验,发现地榆的灭菌温度控制在75℃~85℃是比较合适的,在此温度下,比较容易控制时间,不会因为升温过快导致地榆炭化等问题促使试验失败。我们采用频率2450MHz,功率0~3kW 的连续高功率微波[12],对干湿状态的细菌进行不同强度及时间的辐照,比较其杀灭率。实验显示:不同强度及辐照时间的微波对干菌作用后,其温度无显著变化,但活菌数显著减少;对湿菌的杀灭效果显著高于干菌。已有文献资料显示含水量对杀菌效果影响较大,当含湿率≤25%时,含湿率越高,杀菌效果越好[11]。所以以后医院在制剂原材料灭菌方面,我们推荐用纯化水将药材喷淋后灭菌打粉入药。
对于先灭菌还是先打粉的问题,通过实验,我们发现先打粉后灭菌的地榆饮片的灭菌效果虽然不错,但差异很大,且灭菌温度不易控制,在灭菌12min后,粉状地榆多处出现炭化现象。故建议医院制剂进行原药材灭菌时,采取先灭菌后打粉的方法。地榆的微波灭菌,随着灭菌时间的增长,灭菌效果变化较大,灭菌7min,微生物检查不合格,8min接近合格,在15min达到最佳灭菌效果,到达16min后,地榆饮片在微波灭菌过程中局部出现炭化现象。因此,地榆的最佳灭菌时间段为9~16min。
微波是实现安全、可靠、高效灭菌的一种方法,只要时间和温度控制得当,就能达到很好的灭菌效果。但微波对不同药材和菌种的灭菌,还需通过实验摸索具体的灭菌条件,对特殊的使用条件须设计相应的微波设备,对微波灭菌机理的解释仍存在很多疑问,这将是该领域今后研发的一个重点。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:117-118.
[2]吴开云,黄雪芳,彭宣宪.冰片、虎杖、地榆抑菌作用的实验研究[J].江西医学院学报,1996,2(25):53-55.
[3]张喜平,周田美,董晓勤,等.地榆皂苷注射液体外抗菌作用实验研究[J].医学研究杂志,2006,35(8):39-41.
[4]姚远,曹永献,王芹,等.微波炉对常见病原微生物的杀灭作用[J].中国消毒学杂志,2004,21(1):20-21.
[5]应月青,张礼生,农向群,等.微波对固体培养基灭菌效果的观察[J].中国消毒学杂志,2007,24(1):36-38.
[6]梁霞,李群,胡晓军.微波菌及液体培养技术研灭究[J].中国马铃薯,2006,20(6):349-351.
[7]李荣芬.微波的杀菌机理[J].中国消毒学杂志,1992,9(4):243.
[8]中国药学会上海分会.临床药学手册[M].上海:上海科学技术出版社,1985:10.
[9]潘玉钦,宫慰,陈宝国,等.微波炉灭菌效果的试验观察[J].海峡预防医学杂志,2002,8(3):59-60.
[10]席晓莉,金友煌,吴道澄,等.高功率微波对细菌杀灭效应的实验研究[J].生物医学工程学杂志,2000,17(2):231.

