迷迭香酸对大鼠局灶性脑缺血再灌注损伤的保护作用及机理探讨
高丽萍,张文斌,景玉宏,郑荣梁
(1.兰州大学 基础医学院,甘肃 兰州 730000;2.上海交通大学 药学院,上海 200240;3.兰州大学 生命科学学院,甘肃 兰州 730000)
迷迭香酸是有一定生理活性的酚酸类化合物,为丹参素与咖啡酸的缩合物。迷迭香酸是许多唇形科植物如迷迭香、罗勒、柠檬香蜂草和留兰香的主要成分。其分子结构中有四个酚羟基,具有多种生物活性,包括抗氧化[1],抗过敏[2]、抗炎和抗病毒作用[3],对肝损伤和肺损伤也具有保护作用[4,5]。我们研究发现迷迭香酸可以抑制H2O2诱导的星形胶质细胞的凋亡[6],Iuvone等[7]研究表明迷迭香酸可以保护PC12细胞免受β-淀粉样蛋白诱导的神经毒性作用,这些研究表明迷迭香酸对神经系统有一定保护作用。因此,我们利用线栓法制作了脑缺血/再灌注动物模型,研究迷迭香酸对大鼠脑缺血/再灌注损伤的保护作用及其机理。
1 材料与方法
1.1 试验药物与试剂
迷迭香酸购自Sigma公司。2,3,5-三苯基氯化四氮唑(TTC)为中国医药上海化学试剂公司产品。SOD、GSH-Px和MDA试剂盒为南京建成生物工程研究所产品。
1.2 动物
雄性Wistar大鼠,体重200~280g,由兰州大学医学实验动物中心提供。
1.3 仪器
病理图象分析系统(四川大学产品),UV29100紫外可见分光光度仪(北京第二光学仪器厂产品)。
1.4 方法
1.4.1 分组及给药
大鼠35只随机分为5组,腹腔注射给药3天后用线栓法造模[8],缺血4h后再灌注2h,然后观察各项指标。
1.4.2 行为学评分[9]
评分标准:①提鼠尾,左前肢内收,左肩内旋者1~4分。②将大鼠置光滑平面,推右肩向左侧移动,阻力降低者1~3分。③左前肢肌张力降低1~3分。共10分。分数越高,动物的行为障碍越显著。
1.4.3 脑梗塞体积的测定
大鼠股动脉取血然后迅速断头处死,连续冠状切片,迅速放入2%TTC溶液(37℃)中染色30min,缺血区呈苍白色,正常区为玫瑰色,采用病理图象分析系统计算脑梗塞体积所占百分比。
1.4.4 MDA含量测定
大鼠股动脉取血制备血清,测定血清MDA含量。
1.4.5 SOD和 GSH-Px的活力测定
采用SOD和GSH-Px试剂盒测定血清SOD和GSHPx的活力。
1.4.6 统计学处理
2 结果
2.1 迷迭香酸对大鼠行为学的影响
除假手术组未出现神经缺损的症状外,其余各组出现不同程度的神经缺损的症状。表现为左前肢内收;躯体向病灶对侧倾斜,向左侧推阻力下降;部分大鼠活动时有向瘫痪侧打转现象。与假手术组比较,模型组出现严重的神经缺损症状。与模型组比较,迷迭香酸10、50mg/kg及葛根素50mg/kg均能显著改善大鼠神经缺损的症状(P<0.01)。在剂量相同时,迷迭香酸的作用与葛根素相当(P>0.05)。结果见表1。
表1 迷迭香酸对脑缺血再灌注大鼠行为学和脑梗塞体积的影响(n=7,)
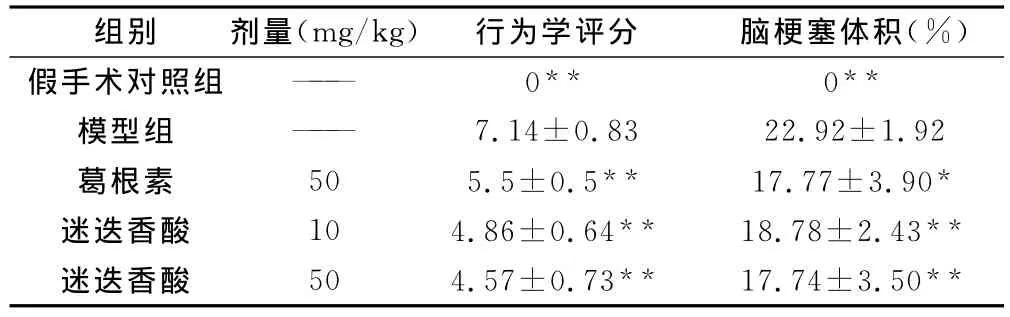
表1 迷迭香酸对脑缺血再灌注大鼠行为学和脑梗塞体积的影响(n=7,)
注:与模型组比较,*P<0.05,**P<0.01。
组别 剂量(mg/kg) 行为学评分 脑梗塞体积(%)假手术对照组 —— 0** 0**模型组 —— 7.14±0.83 22.92±1.92葛根素 50 5.5±0.5** 17.77±3.90*迷迭香酸 10 4.86±0.64** 18.78±2.43**迷迭香酸 50 4.57±0.73** 17.74±3.50**
2.2 迷迭香酸对大鼠脑梗塞体积的影响
与假手术组比较,模型组出现严重的脑梗塞,脑梗塞体积为(22.92±1.92)%。与模型组比较,迷迭香酸10和50mg/kg对脑梗塞体积均有显著的降低作用,分别使梗塞体积降低到(18.78±2.43)%和(17.77±3.90)%。在剂量相同时,迷迭香酸的作用与葛根素相当(P>0.05)。结果见表1。
2.3 迷迭香酸对大鼠血清MDA含量的影响
模型组与假手术组比较,血清MDA含量显著升高(P<0.01)。与模型组比较,葛根素50mg/kg使 MDA含量降低39.69%,迷迭香酸10和50mg/kg分别使MDA含量减低42.05%和45.52%(P<0.01)。结果见表2。
表2 迷迭香酸对脑缺血再灌注大鼠血清MDA含量、SOD和GSH-Px活力的影响(n=7,)
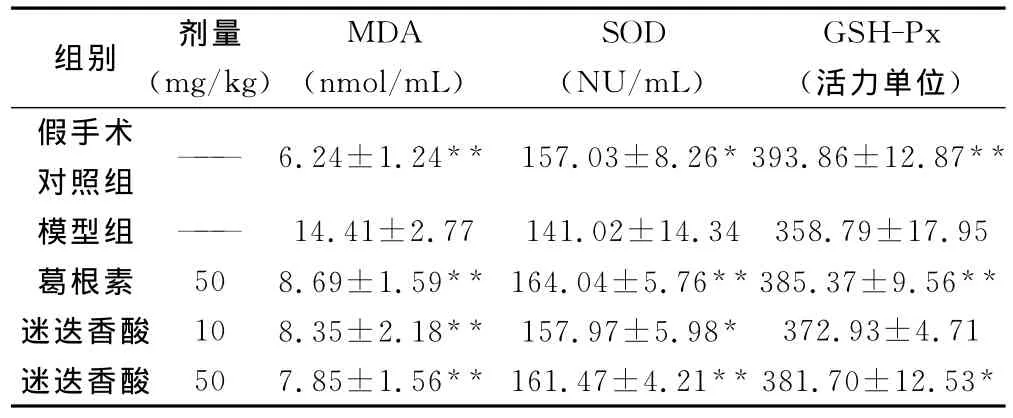
表2 迷迭香酸对脑缺血再灌注大鼠血清MDA含量、SOD和GSH-Px活力的影响(n=7,)
注:与模型组比较,*P<0.05,**P<0.01。
组别 剂量(mg/kg)MDA(nmol/mL)SOD(NU/mL)GSH-Px(活力单位)假手术对照组—— 6.24±1.24** 157.03±8.26*393.86±12.87**模型组 —— 14.41±2.77141.02±14.34358.79±17.95葛根素 508.69±1.59** 164.04±5.76**385.37±9.56**迷迭香酸 108.35±2.18** 157.97±5.98* 372.93±4.71迷迭香酸 507.85±1.56** 161.47±4.21**381.70±12.53*
2.4 迷迭香酸对大鼠血清SOD和GSH-Px活力的影响
模型组与假手术组比较,血清SOD活性显著降低(P<0.01)。与模型组比较,葛根素50mg/kg使血清SOD活性增加1.16倍,迷迭香酸10和50mg/kg分别使血清SOD活性增加1.12和1.15倍(P<0.01)。结果见表2。
模型组与假手术组比较,血清GSH-Px活性显著降低(P<0.01),与模型组比较,葛根素50mg/kg使血清 GSHPx活性增加1.07倍,迷迭香酸50mg/kg使血清GSH-Px活性增加1.06倍(P<0.01)。结果见表2。
3 讨论
大脑中动脉(MCA)是人群脑缺血的多发部位,MCA闭塞模型被普遍认为是局灶性脑缺血的标准动物模型,而插线法这种模型无须开颅,MCA闭塞效果较理想,是目前能进行再灌流损伤研究的理想动物模型。本实验采用线栓法制作大鼠大脑中动脉缺血再灌注损伤模型,观察迷迭香酸对大鼠脑缺血的影响。结果显示迷迭香酸可减少大脑中动脉阻断所致的脑梗塞体积,改善脑缺血大鼠的行为障碍。研究结果表明迷迭香酸对脑缺血性损伤具有明显的保护作用。
涉及再灌注损伤机制的因素有许多,其中氧自由基的生成在其中起重要作用。一般认为,脑缺血时自由基的损害以脑缺血后再灌注为甚,可能是不完全性脑缺血残留的滴状供血,提供微量氧气,使脂质过氧化得以维持进行,加重损害。脂质过氧化的终产物(MDA)有很强的毒性和反应性,它们可使脂质过氧化在细胞膜系统蔓延导致细胞功能的破坏,所以测量脂质过氧化的终产物被认为是氧自由基损伤的重要指标。在正常状态下,机体ROS的产生和清除间存在着动态的平衡,产生的自由基可被SOD、GSH-Px和过氧化氢酶等清除,测定抗氧化酶类的活性可以间接反应体内清除自由基的能力变化。脑缺血再灌注时,ROS的生成过多,超过了抗氧化酶对它的清除,就会导致氧化应激和细胞损伤。脑缺血大鼠再灌注后,MDA含量明显升高,SOD和GSH-Px显著降低,表明脑缺血再灌注期脂质过氧化增加,机体抗氧化能力降低。迷迭香酸能显著降低MDA含量,提高SOD和GSH-Px的活性,表明迷迭香酸对脑损伤的保护作用与其抗氧化作用有关。
[1]ZHENG W,WANG SY.Antioxidant activity and phenolic compounds in selected herbs[J].J.Agric.Food Chem,2001,49:5165-5170.
[2]ITO H,MIYAZAKI T,ONO M,ET al.Antiallergic activities of rabdosiin and its related compounds:chemical and biochemical evaluations[J].Bioorg Med Chem,1998,6:1051-1056.
[3]SWARUP V,GHOSH J,GHOSH S,et al.Antiviral and antiinflammatory effects of rosmarinic acid in an experimental murine model of Japanese encephalitis[J].Antimicrob Agents Chemother,2007,51:3367-3370.
[4]OSAKABE N,YASUDA A,NATSUME M,et al.Rosmarinic acid,a major polyphenolic component of perilla frutescens,reduces lipopolysaccharide (LPS)-induced liver injury in D-galactosamine(D-GalN)-sensitized mice[J].Free Radic.Biol.Med,2002,33:798-806.
[5]SANBONGI C,TAKANO H,OSAKABE N,et al.Rosmarinic acid inhibits lung injury induced by diesel exhaust particles[J].Free Radic.Biol.Med,2003,34:1060-1069.
[6]GAO LP,WEI HL,ZHAO HS,et al.Antiapoptotic and antioxidant effects of rosmarinic acid in astrocytes[J].Pharmazie,2005,60:62-65.
[7]IUVONE T,DE FILIPPIS D,ESPOSITO G,et al.The spice sage and its active ingredient rosmarinic acid protect PC12 cells from amyloid-beta peptide-induced neurotoxicity[J].J Pharmacol Exp Ther,2006,317:1143-1149.
[8]LONGA EZ,WEINSTEIN PR,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[9]LEKIEFFRE D,BENAVIDES J,SCATTON B,et al.Neuroprotection afforded by a combination of eliprodil and a thrombolytic agent,rt-PA,in a rat thromboembolic stroke model[J].Brain Res,1997,776:88-95.

