椎体成形术后椎体界面骨血管内皮生长因子mRNA表达的实验研究
赵 刚,胡侦明,舒 钧,劳汉昌
(1.昆明医学院第二附属医院 急诊科创伤骨科组,云南 昆明 650101;2.重庆医科大学第一附属医院 骨科,四川 重庆 400016;3.昆明医学院第二附属医院 骨科,云南 昆明 650101)
聚甲基丙烯酸甲酯(PMMA)因其良好的疗效及安全性能受到广泛使用,但PMMA植入体内致骨组织损伤后修复过程至今仍未清楚,骨组织对PMMA植入后的反应尚不清楚,国内外均未见报到。本实验旨将PMMA骨水泥模仿椎体成形术植入老龄骨质疏松兔腰椎椎体内,观察骨水泥-骨界面周围骨组织的形态学改变及炎症反应情况,用适时定量PCR及蛋白印记技术(Western blot)检测骨水泥-骨界面周围骨组织内VEGF mRNA的扩增及蛋白表达情况,拟从细胞及分子水平了解骨质疏松性椎体压缩骨折行椎体成形术后PMMA骨水泥周围骨组织的损伤及修复情况,为全面评价PMMA骨水泥对机体的长期影响及转归提供一定的理论及实验室依据。
材料及方法
一、实验器械及材料 腰椎前路器械、硬膜外穿刺针;骨密度仪(美国LUNAR公司),PMMAⅢ型复合骨水泥(天津市合成工业材料研究所);低温高速离心机(Heraeus),紫外可见分光光度计(Unico),Real-time PCR仪(Bio-Rad), 酶标仪(Tecan).Western Blot试剂:小鼠抗兔VEGF单克隆抗体、山羊抗鼠HRP标记IgG抗体、BCA-100蛋白质定量试剂盒(上海申能博彩生物科技有限公司),其它试剂均为国产分析纯以上级别。
二、实验方法 1.动物分组:老年新西兰雌兔72只,体重3.1~4.2kg,平均3.7kg(由昆明医学院实验动物中心提供),经DXA检测符合骨质疏松兔标准者采用。术前拍腰椎正侧位X线片,显示正常腰椎序列及骨质结构。72只实验动物随机编号,分为实验组和对照组,再分为术后1h,24h,3d,7d,4w,12w亚组,每亚组各6只。实验组选择L2、L4椎体节段植入PMMA骨水泥。各相应对照组只进行手术不植入PMMA,分别于术后1h,24h,3d,7d,4w,12w6个时相段处死动物观察。
2.动物模型的制备和材料植入:手术步骤:⑴4%戊巴比妥那(1ml/kg)耳缘静脉注射麻醉;⑵将兔子俯卧固定于操作台上,定位L7(两髋最高点连线交界处),取背部正中切口,显露L2~L6椎体的前半部分(后半部分外走行脊神经,勿显露,以防损伤)。由椎弓根中线与横突前缘连线交点后方1mm处进针,与水平面呈35°~40°夹角,与冠状面呈0°~5°夹角,进针深度4~6mm。将PMMA调配成可注射的稀糊状(骨水泥粉∶液为4ml∶1g)装入1ml注射器内,通过硬膜外穿刺针缓慢注射,边注射边拔出穿刺针,注射量约0.5~0.6ml。以上操作每只进行2个椎体,每组完成6只;⑶术后处理,术后7d肌肉注射青霉素100万U/只,1次/d。手术过程顺利,实验组有1只术后因操作失误将穿刺针刺入椎管引起瘫痪。术后所有兔子均由本院试验动物中心专业人员饲养。术中、术后均无死亡。
3.X线检查:在术后即刻和1h,24h,3d,7d,4w,12w处死动物前,分别摄腰椎侧位X线片检查,观察植入材料是否在椎体内部,是否脱落和崩裂,观察植入材料的形态。
4.标本制作:⑴术后1h,24h,3d,7d,4w,12w取椎体检测;⑵新鲜取出的椎体节段,去除椎体附件,包括附着的肌肉、韧带、椎弓根、椎板和椎间盘,仅剩椎体,双层塑料袋密闭后冷藏于-75℃保存备用,测试前取出在室温下自然解冻。
5.分子生物学操作:⑴配制试剂;⑵RT-PCR;⑶目的基因检测;⑷Western Blot显影定影。
研究中所用的引物如下。

6.实验结果分析:⑴VEGF mRNA RT-PCR扩增结果计算 首先样品Ct-内参Ct=⊿Ct,以其中一个样本⊿Ct(通常为对照组)为参照,计算⊿⊿Ct。计算方法为⊿Ct(样本) -⊿Ct(参照)。最终样本之间倍数关系为2的-⊿⊿Ct次幂
⑵蛋白表达结果 将X线胶片置于Tanon凝胶图像处理系统,测定目的条带的强度和面积,计算蛋白相对含量值,相对含量值=强度×面积。
7.组织学观察:在骨组织与材料交界处取材,仅留界面周围骨组织,锯成0.5cm×0.5cm×0.5cm大小,用10%中性福尔马林液固定,EDTA脱钙、脱水、透明石蜡包埋,8μm连续切片,HE染色后在光镜下观察炎症反应、骨坏死和新骨形成情况。
结 果
一、X线检查 所有的填充材料未见脱落、崩裂、松动。术后3个月植入材料与骨交界部位模糊不清,有新骨形成,但材料体积无明显缩小。对照组,术后及3个月均见实验椎体有约有0.5大小直径的圆形低密度区。
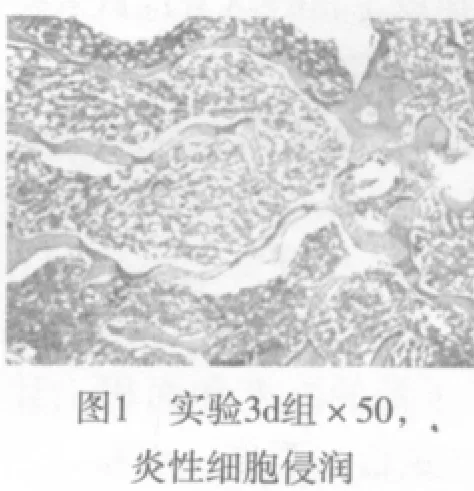
二、组织形态学观察 植入PMMA组术后24h组界面骨组织见明显炎性细胞浸润,未见明显骨组织坏死表现,3d后炎症反应达高峰,至7d减轻,4w时未见明显炎性细胞,12w无任何炎症表现;4w时椎体骨与材料交界处出现软骨细胞呈团状生长并向编织骨分化,12w时细胞内成骨明显,可见大量的板层骨形成,偶尔可见到造血骨髓(见图1~4)。
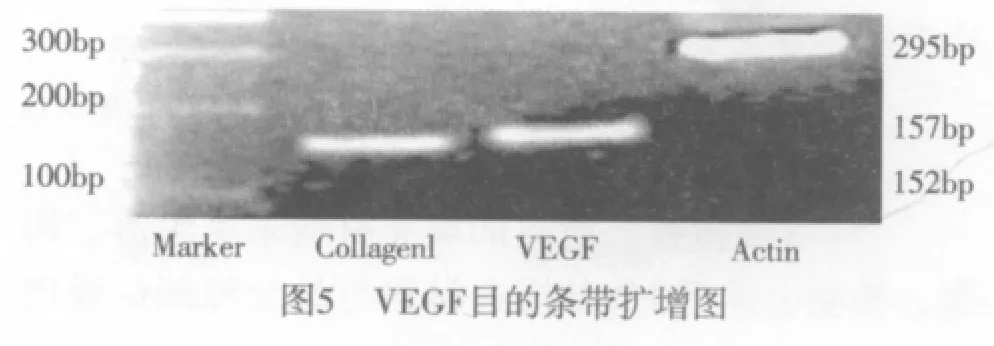
三、VEGF RT-PCR扩增及蛋白表达 1.VEGF RT-PCR扩增 以Actin作为内参扩增到分子量为157 bp目的条带,根据内参推断,与文献中扩增到的基因片段一致,说明此即为VEGF的目的条带(见图5)。
2.VEGF mRNA扩增结果 PMMA术后1h及24hVEGF的表达减少且低于对照组,有统计学差异(P<0.05);而术后3dVEGF的表达明显增加,至7d时再次降低,低于对照组,差异有统计学意义(P<0.05);4~12wVEGF的表达持续增加,与实验7d组及相应对照组比,差异有统计学意义(P<0.01)(见表1)。



3.VEGF蛋白检测结果 PMMA术后1h及24hVEGF的表达略有升高,而术后3dVEGF的表达明显增加,至7d时再次降低,而4~12wVEGF的表达明显增加,差异有统计学意义(P<0.05),见表2。
讨 论
骨损伤后3d在间叶细胞和成骨细胞中可见TGF-β1,2,3,bFGF,FGFR,PDGF的表达[1],5d VEGF的表达明显增强,此时软骨血管内皮中这些物质的表达达峰值,骨折7d后软骨向骨转化,骨折后14d出现软骨内骨化。Steinbrech等[2]的研究发现,在骨折愈合过程中VEGF的表达是上调的;机制为:骨折部位有缺氧;各种细胞在缺氧刺激下表达VEGF;缺氧能通过刺激成骨细胞产生VEGF,缺氧微环境能促进成骨细胞的增殖、分化。但过度严重的缺氧也会减少细胞的增殖,细胞抗原分化减少,相应的VEGF表达下调,从而认为VEGF在骨折愈合及软骨内骨化中起到了关键作用。VEGF的表达,一定程度上可引起血管新生从而引导血流至骨折端,促进骨折愈合。Komatsu[3,4]的研究表明,在骨折愈合的过程中均有VEGF的表达。骨折局部氧浓度的大小作为刺激原激活缺氧诱导因子(Hypoxia-inducible factor-1,HIF-1),刺激成骨细胞产生VEGF,在骨折的3~10d内VEGF的表达即达到高峰,骨小梁内可见VEGF的表达增高。Li[5]的研究表明,许多细胞因子最终是通过激活VEGF或使其表达上调而促进骨折愈合。Hu[6]的研究表明,骨形态发生蛋白能增强VEGF及Ⅰ型胶原的活性而促进骨折愈合,VEGF亦能增强BMP的作用,促进骨矿化,但VEGF的含量过高会降低二者的协同作用。Chua[7]等离体加入TGF后2h即可见VEGF的表达增强,当一定量离子辐射损害细胞分泌水平使TGF减少,破骨细胞增殖加速使VEGF的表达减少,骨折愈合延迟,表明TGF促进骨骼生长的作用是通过增强成骨细胞表达VEGF来实现的[8~10]。当机体发生感染后,如脓毒血症、骨髓炎等,能致VEGF mRNA表达降低,使VEGF合成减少,致感染时骨折延迟愈合甚至不愈合[11]。VEGF是在成骨细胞、巨噬细胞、成纤维细胞内产生合成,然后以自分泌或旁分泌的方式分别参予骨矿化和血管新生作用[5]。该类细胞所处的细胞外微环境对VEGF的产生有非常显著的影响。微环境中的PH及乳酸浓度能对VEGF的表达产生独立的影响。VEGF产生的最佳微环境为机体的中性环境(即pH=7.35~7.45,平均7.40) 最佳,当pH值为7.0时,VEGF的表达明显减少,而乳酸浓度增高时亦能抑制成骨细胞VEGF的表达[12]。国内的研究表明[13],VFGF表达量在伤后不同时相不尽相同,骨折后8h其表达己达到较高的水平,在24h有所降低,之后迅速回升,并在骨折后72h-3周维持在高表达状态,5-8周表达连续降低。早期的研究表明[14,15],PMMA对培养细胞的毒性主要是引起成骨细胞坏死,是通过PMMA单体释放羟自由基引起过氧化反应造成细胞损伤。PMMA单体自由基可使骨-水泥界面处的巨噬细胞释放花生四烯酸,并可使局部组织细胞产生释放乳酸脱氢酶增多,产生类似肉芽肿性炎症反应引起组织损伤。我们的研究结果显示:PMMA术后1h及24h VEGF的表达减少且低于对照组,而术后3dVEGF的表达明显增加,至7d时再次降低,而4~12w VEGF的表达明显增加。24h组的降低可能与PMMA凝固时的放热反应及单体自由基的氧化反应改变细胞的微环境抑制了成骨细胞活性,致VEGF的表达减少;至3d时由于炎症反应明显增强,炎性细胞如巨噬细胞、成纤维细胞等表达VEGF而出现VEGF高峰,7d随着炎症反应的消退,炎性细胞减少,VEGF的表达减弱。随着氧自由基的减少和热反应损伤的修复,细胞微环境恢复,成骨细胞活性正常,4w后可见VEGF的高表达,至12wVEGF表达降低,HE染色见骨组织修复完成,此时主要为破骨细胞释放VEGF。从我们的实验结果可以发现:PVP术后PMMA骨水泥对周围骨组织的损伤修复有一定影响,主要表现为时间延迟,但并未造成不可逆的缺血损伤。修复机制与正常骨折愈合是相似的,结果也无明显区别,但时间比正常愈合进程延迟4W左右。PVP术后骨水泥-骨界面周围骨组织的细胞微环境改变有待进一步研究。
表1 VEGF mRNA经 RT-PCR 扩增⊿⊿Ct值 (s,n=6)
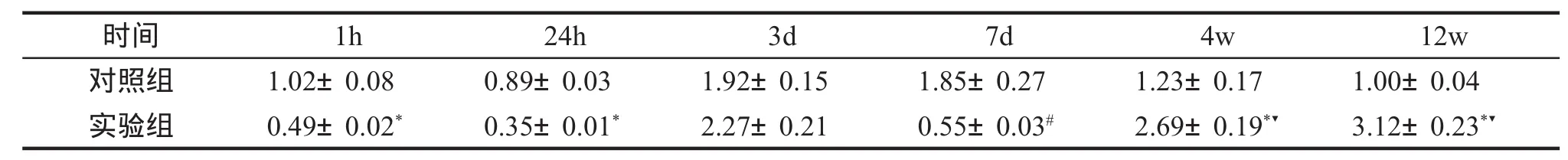
表1 VEGF mRNA经 RT-PCR 扩增⊿⊿Ct值 (s,n=6)
注:*VS相应对照,P<0.05;#VS对照 7d组,P<0.05;▼VS实验 7d组,P<0.001。
表2 VEGF蛋白表达检测结果(s,n=6)

表2 VEGF蛋白表达检测结果(s,n=6)
注:*VS相应对照,P<0.05。
[1]VLADIMIROVBS,DIMITROVSA.Growth factors-importance and possibilities for enhancement of the healing process in bone fractures[J].Folia Med(Plovdiv),2004,46(2):11-17.
[2]STEINBRECH DS,MEHRARABJ,SAADEH PB,et al.Hypoxia regulates VEGF expression and cellular proliferation by osteoblasts in vitro[J].Plast Reconstr Surg,1999,104(3):738-347.
[3]KOMATSU DE,HADJIARGYROU M.Activation of the transcription factor HIF-1 and its target genes,VEGF,HO-1,iNOS,duringfracture repair[J].Bone,2004,34(4):680-688.
[4]HARRYLE,PALEOLOGEM.Fromthe cradle tothe clinic:VEGF in developmental,physiological,and pathological angiogenesis[J].Birth Defects Res C Embryo Today,2003,69(4):363-374.
[5]LI G,CUI Y,MCILMURRAYL,ALLENWE,et al.rhBMP-2,rhVEGF(165),rhPTN and thrombin-related peptide,TP508 induce chemotaxis of human osteoblastsand microvascular endothelial cells[J].J Orthop Res,2005,23(3):680-685.
[6]HU Z,PEELSA,HO SK,et al.Role ofbovine bone morphogenetic proteins in bone matrix protein and osteoblast-related gene expression during rat bone marrow stromal cell differentiation[J].J Craniofac Surg,2005,16(6):1006-1014.
[7]PENGH,USASA,OLSHANSKI A,et al.VEGF improves,whereas sFlt1 inhibits,BMP2-induced bone formation and bone healing through modulation of angiogenesis[J].J Bone Miner Res,2005,20(11):2017-2027.
[8]CHUACC,HAMDYRC,CHUABH.Mechanismoftransforming growth factor-beta1-induced expression of vascular endothelial growth factor in murine osteoblastic MC3T3-E1 cells[J].BiochimBiophys Acta,2000,1497(1):69-76.
[9]SAADEH PB,MEHRARA BJ,STEINBRECH DS,et al.Transforming growth factor-beta1 modulates the expression of vascular endothelial growth factor by osteoblasts[J].Am J Physiol,1999,277(4 Pt 1):C628-637.
[10]WANGFS,KUOYR,WANGCJ,et al.Nitric oxide mediates ultrasound-induced hypoxia-inducible factor-1alpha activation and vascular endothelial growth factor-A expression in human osteoblasts[J].Bone,2004,35(1):114-123.
[11]KHODAPARAST O,COBERLY DM,MATHEY J,et al.Effect of a transpositional muscle flap on VEGF mRNA expression in a canine fracture model[J].Plast Reconstr Surg,2003,112(1):171-176.
[12]SPECTOR JA,MEHRARA BJ,GREENWALD JA,et al.Osteoblast expression of vascular endothelial growth factor is modulated by the extracellular microenvironment[J].Am J Physiol Cell Physiol,2001,280(1):C72-80.
[13]初同伟,王正国,朱佩芳.骨折愈合过程中血管内皮生长因子基因扩增及蛋白表达研究[J].中华实验外科杂志,2002,19(4):367-368.
[14]KENNEDY JG,O'GRADY P,MCCARTHY DR,et al.An investigation into the role of oxygen free radical scavengers in preventing polymethylmethacrylate-induced necrosis in an osteoblast cell culture[J].Orthopedics,2000,23(5):481-485.
[15]HOROWITZ SM,GAUTSCH TL,FRONDOZA CG,et al.rMacrophage exposure to polymethyl methacrylate leads to mediator release and injury[J].J Orthop Res,1991,9(3):406-413.

