胆碱模块自动化合成11C-car fentanil及Micro PET显像
张锦明,徐志红,张晓军,向晓辉,田嘉禾
(1.中国人民解放军总医院核医学科,北京 100853;2.江常熟苏华益化工有限公司,江苏 常熟 215522;3.北京大学神经科学研究所,北京 100191)
目前11C标记的卡芬肽尼(11C-carfentanil,11C-CFN)是唯一用于人体的μ受体显像类药物,它对μ受体有很高的亲和性和选择性(与κ和δ受体亲和性低)[1],但CFN的生理效应很强,其药理作用是吗啡的 10 000倍[2],因此对11C-CFN的比活度要求很高,以减少载体对人体的药理作用。11C药物的比活度除与碘代甲烷的比活度有关外,与合成速度也相关,合成速度快,最终产品放射性活度高,比活度也高。目前尚无专一合成11C-CFN的模块,多采用手动或修改商品化模块程序合成11C-CFN。Dannals RF等[3]最先报道了用11CH3I与去甲基的钠盐前体加热反应合成11C-CFN,产品需经HPLC纯化,尽管起始比活度较高,但合成时间长达30 min,合成结束时比活度为1.07×1014Bq/g。Jew ett[4]采用固相萃取方法,选用活性更高的11C-CH 3-triflate与前体反应,合成时间缩短到20 m in,比活度可达3.3×1014Bq/g。Shao等[5]修改了商业多功能碳模块的程序,自动化合成了11C-CFN,但没有测量比活度。本研究拟比较LOOP法和反应瓶法两种合成方法,采用国产的胆碱模块,优化合成参数,自动化合成11C-CFN,并用Micro PET/CT显像证实其在脑内的分布特征。
1 主要实验材料
1mol/L氢化锂铝和前体4-哌啶乙酸,4-[(1-丙羰基)苯胺]-1-(2-苯乙基)[游离酸]:德国ABX公司提供;DMSO:A lfa Aesar公司产品;DMF、57%的氢碘酸、1mol/L四丁基胺甲醇溶液:Sigma-A ldrich公司产品;无水乙醇:美国Millennium公司产品,氨水:北京化工厂产品。CFN标准品和前体4-哌啶乙酸钠,4-[(1-丙羰基)苯胺]-1-(2-苯乙基)[钠盐]:自制[6]。
Sep-Pak C-2柱:美国 A lltech公司产品;Sumitomo HM-20S回旋加速器:日本驻友公司产品;11C-碘代甲烷合成器和11C-多功能合成仪:北京派特生物技术有限公司产品;高效 HPLC分析仪:美国Waters公司产品,配515泵,2487紫外检测器和BioScan流动放射性检测器。LC/MS/MS、API2000:美国 API公司产品。eXPlore V ista Micro PET/CT成像系统:美国GE公司产品。
SD大鼠:1只,230 g,SPF级,由中国人民解放军军事医学科学研究院动物所提供。
2 实验方法
2.1 11C碘代甲烷生产及Triflate的在线转换
在Sumitomo HM-20S回旋加速器上,用40μA 20 MeV质子轰击含1%氧的氮气,利用14C(p,α)11C核反应,在靶内生成11C-CO2。由单管、液相法自动化合成11C-碘代甲烷(11C-CH3I)。具体过程为:加速器生成的11C-CO2被液氮捕获后,由氮气以 40 m L/min速率载带入0.2m L 1 mol/L氢化锂铝/THF溶液中反应,加热除去THF后加入0.2m L 57%的氢碘酸,生成的11C-CH3I由40 m L/m in氮气载带通入Triflate-Ag转化炉;11C-CH3 I在线转化为11CH3-triflate[7]。
2.2 11C-CFN的合成
分别采用 LOOP法和反应瓶法合成11CCFN。采用固相萃取法分析标记率,HPLC方法分析放化纯度。
2.2.1 LOOP法合成
分别采用游离酸型和钠盐型二种标记前体合成11C-CFN。
采用游离酸型标记前体:将1 m g游离酸型前体溶于0.2m L DMSO或DMF中,并加入等量的碱,将该溶液加入到HPLC的5m L的装液环(LOOP环)中,将2.1节合成的11CH3-triflate通过该环,11CH 3-T riflate与环内的液体膜接触反应生成11C-CFN。
采用钠盐型标记前体:用0.2 m L DMSO或DMF溶解1 mg钠盐型前体后将其加入到HPLC的5 m L的装液环(LOOP环)中,将 2.1节生成的11CH 3-triflate通过该环,11CH 3-triflate与环内的液体膜接触反应生成11C-CFN。
2.2.2 反应瓶法合成
采用游离酸型前体:用0.2 m L DMSO或DMF溶解1 mg游离酸型前体,并加入等量的碱后置于反应瓶内,并将2.1节合成的11CH3-triflate通入反应瓶,在反应瓶内合成11C-CFN。
采用钠盐型前体:在反应瓶内用0.2 m L DMSO或DMF溶解1 mg钠盐型前体,将2.1节合成的11CH3-triflate通入反应瓶,在反应瓶内合成11C-CFN。
2.3 11C-CFN的全自动化合成装置
合成碘代甲烷和胆碱模块的示意图示于图1。该合成模块与合成11C胆碱的模块不同,主要在于以下三处:1)用合适的溶剂溶解前体后装在反应瓶中,取代了用C-18柱装载前体;2)用Sep-Pak C2柱取代Sep-Pak CM柱;3)纯化溶剂有区别,合成11C-CFN的淋洗液分别为10 m L 1%氨水、10m L水和1.0m L的无水乙醇。纯化程序无区别,C2柱用5m L无水乙醇活化,再用10m L水冲洗即可。
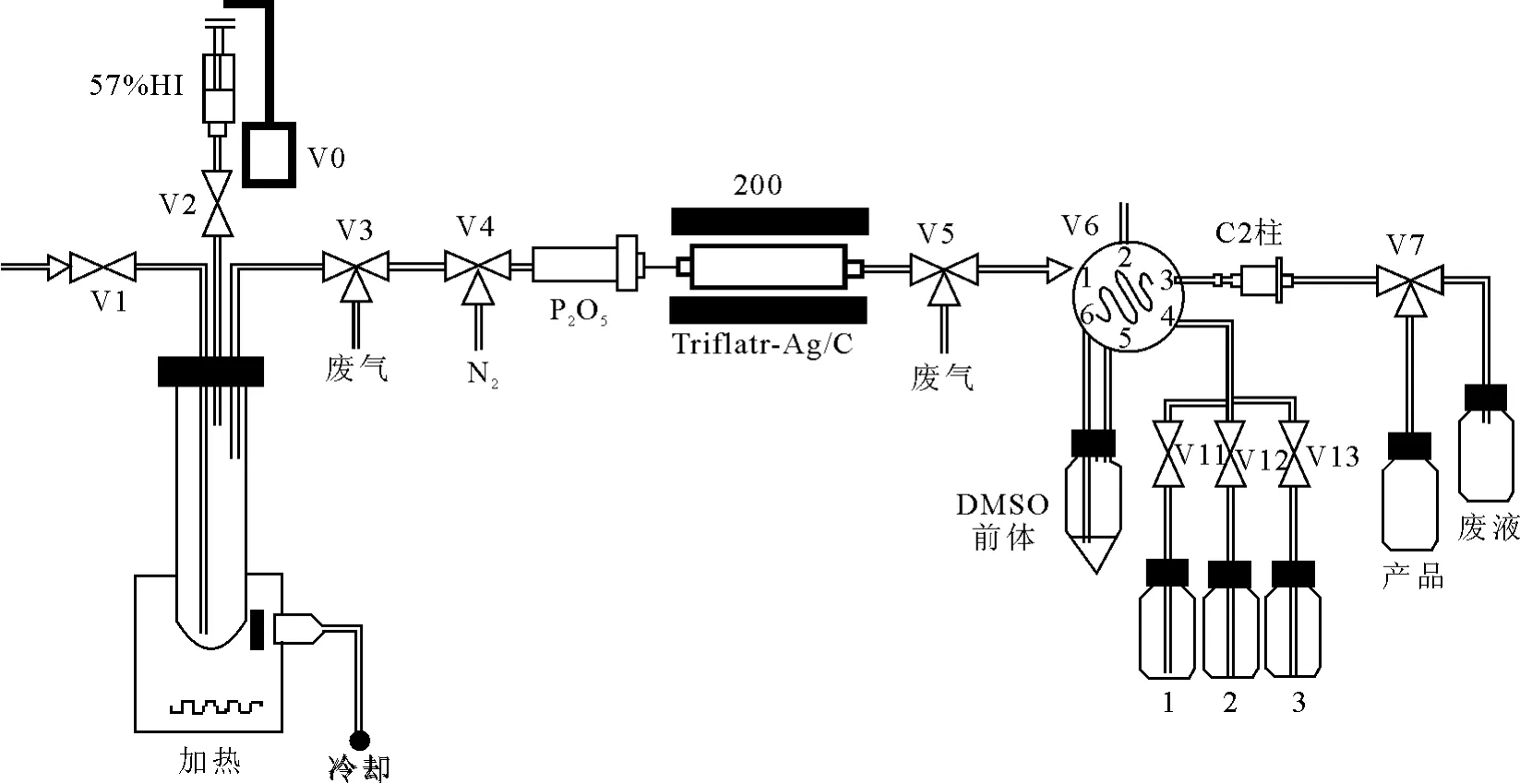
图1 胆碱模块合成11C-CFN示意图
2.4 11C-CFN质量控制
用HPLC分析产品的放化纯度,分析柱为G race A lltima C18(5 μm,10 mm ×250 mm),流动相为V(30%MeCN)∶V(水(含0.2%冰乙酸)),流速为1 m L/m in。用 LC/MS/MS测量产品的比活度[8]。
2.5 Micro PET/CT大鼠显像
取SD大鼠,尾靜脉注射 0.2 m L的11CCFN样品111 MBq。注射后25 min以2 m L/kg的剂量腹腔注射5%水合氯醛麻醉,置于eX-plore Vista Micro PET/CT上扫描脑部5 m in,先扫描PET再扫CT以定位,确定11C-CFN在大脑的浓集部位。
3 结果与讨论
3.1 两种标记方法合成11C-CFN的比较
选择两种溶剂DMSO和DMF溶解钠盐前体,并装载于LOOP环内,采用 DMSO为溶剂时,11C-CFN的合成效率为 5%,而采用DMF为溶剂的合成效率为10%。采用相同体积的DMSO溶解前体,反应瓶法的合成效率约为80%。
目前很多11C药物采用LOOP法合成[5,9],如11C-胆碱,直接将胆碱前体装载于 LOOP环内,合成效率>90%;2-(4'-N-11C-甲胺基苯)-6-羟基苯并噻唑(11C-PIB)也可以采用LOOP法,不校正合成效率约16%,而且是选择性地在胺基上甲基化。LOOP法的原理主要针对小的反应体积,将含前体溶液均匀涂布于四氟管的内径,以增加反应面积,当放射性气体通过时与前体发生反应,降低了反应温度,提高了标记效率。Studenov AR等[10]采用四丁基胺作催化剂,DMF作溶剂,用11C-CH3I为甲基化试剂合成11C-CFN,合成效率为64.1%,与本研究的结果相差很远。对比文献与本研究的合成条件可知,文献中主要以15 m L/min氦气载带碘代甲烷,将生成的约95%以上的放射性保留在LOOP环内,而本研究中载带气流为40m L/min,LOOP环仅能保留25%的放射性,其余均以气体方式从LOOP环的另一端溢出;将载带气流流速降低到15 m L/min,合成效率提高不明显,原因不详,故以下研究及自动化合成均采用反应瓶法。
3.2 二种CFN前体合成11C-CFN
采用 4-哌啶乙酸,4-[(1-丙羰基)苯胺]-1-(2-苯乙基)[游离酸]作前体,合成前加入等量的四丁基胺或NaOH或DMSO作溶剂,11C-CFN的合成效率为67.3%±2.3%(n=3)。以4-哌啶乙酸钠,4-[(1-丙羰基)苯胺]-1-(2-苯乙基)[钠盐]作前体,合成效率为83.3%±3.1%(n=10),略高于以游离酸为前体的合成效率。这可能是由于以游离酸为前体时,加入的碱的量不能中和酸使反应介质呈酸性,因此以下合成采用钠盐前体。
3.3 不同溶剂中甲基化
采用钠盐前体,DMSO作溶剂,常温下合成11C-CFN的合成效率为83.3%±3.1%(n=10)。采用相同前体,丙酮作溶剂,0℃下捕获11CH3-triflate,捕获完毕后升至室温1 min,11CCFN的合成效率为72.3%±5.8%(n=3),略低于DMSO体系。
11C甲基化时,低温下用丙酮作溶剂,丙酮捕获11CH3-triflate或11CH 3 I的效率高于其他溶剂,同时在丙酮中甲基化效率高[11]。本研究采用丙酮的效率没有明显提高,可能是由于CFN的甲基化是羧基的甲酯化,不同于其他碳-氮或碳-氧甲基化。此外,丙酮甲基化时需将反应瓶置于0℃,反应完毕需升至常温。因此本研究的自动化采用DMSO作溶剂。
3.4 11C-CFN的全自动化合成
根据以上优化的条件,用0.2m L DMSO溶解0.5 mg去甲基CFN钠盐前体,装载于尖底瓶中,并如图1所示安装于11C多功能模块上,反应瓶中插入11CH 3-triflate通气管,另一端插排气管(二管分别接在六通阀上);由模块生成的碘代甲烷通过在线转换生成11CH 3-triflate,11CH3-triflate经二位六通阀 V 6通入尖底瓶中。11CH3-triflate传输完毕,启动纯化程序,计算机自动切换二位六通阀V 6,将原来的气体通路变成液体通路,依次将1号瓶内的10 m L 1%氨水压入到尖底反应瓶,稀释反应液,混合液流经C-2柱分离,产品吸附在C-2柱上,用2号瓶内10 m L水清洗C-2柱,最后用 3号瓶内1.0 m L的无水乙醇将产品从C-2柱上洗脱到收集瓶,在收集瓶中加入9 m L生理盐水。将收集瓶中的溶液过无菌滤膜后测量放化纯度和比活度。
采用40μA 20 MeV的质子轰击氮气靶30m in,最后能得到14.8~18.5 GBq的11CCFN。共合成了55次,校正的合成效率>80%(依据11CH3-triflate计算)。从11CO2合成11CCH 3 I开始计时,到最后得到终产品,耗时18m in,其中合成11C-CH 3 I耗时12min,合成11C-CFN耗时6 min。
1%氨水清洗C-2柱的废液的HPLC分析结果示于图2。由图2可以看出,HPLC谱图上仅有一个保留时间为2.5m in的峰,说明产品未从C-2柱上漏穿。

图2 1%氨水清洗C-2柱的废液的HPLC
3.5 11C-CFN的质量控制
产品的HPLC分析结果示于图3。分析图3可知,产品11C-CFN的放化纯度>99%。图3中,与放射性峰相对应的紫外分析有一很小的吸收峰,其保留时间为7.36 m in,未见有其他化学杂质,放射性和紫外检测器之间有一0.5 min死时间。由于载体CFN的量很少,为提高测量准确性,采用 LC/MS/MS测量产品的比活度,结果显示其比活度为1.4×1014Bq/g。
3.6 Micro PET/CT显像
注射11C-CFN后25m in,Micro PET/CT大鼠头部显像示于图4。由图4可以看出,放射性主要分布于丘脑、纹状体、大脑皮质和嗅球等部位。这一分布特点与采用放射自显影和原位杂交实验得到的μ阿片受体及其m RNA的分布特点[12]一致。说明11C-CFN可以用于μ阿片受体的PET显像研究。

图3 11C-CFN的 HPLC分析
图 4 大鼠注射11C-CFN后25~30m in的Micro PET/CT显像
4 结 论
(1)利用商业11C胆碱模块可以在18m in内合成出总活度 14.8 GBq、比活度大于 1.4×1014Bq/g、放化纯度大于95%的11C-CFN。
(2)Micro PET/CT显像证实,11C-CFN可用于μ阿片受体的PET显像研究。
[1]Bencherif B,Fuchs PN,Sheth R,et al.Pain activation of human sup raspinal opioid pathways as demonstated by[11C]carfentanil and positron em ission tomographpy(PET)[J].Pain,2002,99:589.
[2]朱国政,戴敦华.强效镇痛药卡芬太尼的合成[J].医药工业,1988,19:9.
[3]Dannals RF,Ravert HT,Frost JJ,et al.Radiosynthesis o fan opiate recep tor binding radiotracer:[11C]carfentanil[J],Int JApp l Radiat Isot,1985,36:303.
[4]Jew ett DM.A sim p le synthesis of[11C]carfentanil using an ex traction disk instead o f HPLC[J].Nucl Med Bio l,2001,28:733.
[5]Shao X,K ilbourn MR.A simplemodification of GE tracerlab FX C Pro for rapid sequential preparation of11C-carfentanil and11C-raclopride[J].App l Radiat Isot,2009,67:602.
[6]张锦明,桂媛,徐志红,等.阿片受体显像剂:11CCarfentanil的前体合成及放射性标记[J].核化学与放射化学,2011,待发表.
[7]张锦明,田嘉禾,王武尚,等.在线制备11C-triflate-CH3[J].同位素,2006,19(2):124.
[8] Zhang XJ,Zhang JM.Quality control of11CCarfentanil[C]//Eighth China-Japan Joint Seminar on Radiopharmaceutical Chem istry.Beijing:Beijing Normal University,2010:73.
[9]Wilson AA,Garcia A,Chestakova A,et al.A rapid one-step radiosynthesis o f theβ-amy loid imaging radiotracer N-methy l-[11C]-2-(4'-methy lam ino-pheny l)-6-hydroxy benzothiazo le([11C]-6-OH-BTA-1)[J].J Labeled Com pd Radiopharm,2004,47:679.
[10]Studenov AR,Jivan S,Buck ley KR,et al.Ef ficient in-loop synthesis of high specific radioactivity[11C]carfentanil[J].J Lab Comp Radiopharm,2003,46:837.
[11]Zhang JM,Tian JH,Wang WS,et al.A new technique for labeling of[11C]-choline,a positronem itting tracer for tumor imaging[J].JRadio and Nucl Chem,2006,267:665-668.
[12]Mansour A,Fox CA,Akil H,et al.Opioid-receptormRNA expression in the ratCNS:anatom ica l and functional implications[J].Trends Neurosci,1995,18:22.

