新型多肽示踪剂131I-RRL肿瘤分子显像研究
卢 霞,王荣福,张春丽
(1.北京大学 第一医院核医学科,北京 100034;2.北京航天总医院 影像中心,北京 100076)
恶性肿瘤是目前导致患者死亡最主要的疾病之一,在全世界的发病率仍然呈持续增长的势头。分子功能显像综合了分子生物学、合成化学及可视化技术的优势,在肿瘤的基础研究领域、临床前研究及临床研究中有重要的应用价值。示踪剂的敏感性和特异性是目前肿瘤诊断及治疗研究的难点。
肿瘤新生血管生成是维持肿瘤快速生长及远处转移不可缺少的重要因素,已经引起越来越多研究者的关注。大多数研究都致力于发现能够示踪肿瘤新生血管生成的新型肿瘤示踪剂。放射性核素标记的单克隆抗体示踪肿瘤新生血管内皮特征分子是肿瘤新生血管示踪的主要研究方向。与放射性核素标记单克隆抗体相比,核素标记多肽相对分子质量小,能够更容易进入其作用的靶点[1]。Brow n等[2]利用大肠杆菌肽展示文库发现了小分子肽片段精氨酸-精氨酸-亮氨酸(Cys-Gly-Gly-A rg-A rg-Leu-Gly-Gly-Cys,RRL)能够特异性结合于肿瘤来源的血管内皮细胞,而与正常的血管内皮细胞不结合。已有研究者[3]将气体微泡(MB)连接于 RRL多肽,通过RRL特异性结合于肿瘤新生血管内皮细胞性质,进行肿瘤新生血管显像。其研究结果显示,肿瘤血管来源的内皮细胞中,MB-RRL的结合量是对照组及心肌组织中的3倍多。MB-RRL能够优先结合于肿瘤新生血管内皮细胞,能够示踪肿瘤新生血管的形成,有潜在的肿瘤血管靶向治疗应用可能性。
本课题组在放射性核素标记RRL方面已经做了一些尝试性研究[4]。研究结果显示,修饰小分子肽RRL的原有结构,在其氨基端添加一个酪氨酸,变成包含十个氨基酸的小肽,能够被放射性核素131I标记,且标记物能选择性地浓聚于肿瘤组织内。本工作拟在此基础上进一步评价131I-RRL体外的生物学特性及与肿瘤实质细胞的关系;进行体内黑色素瘤肿瘤模型动物SPECT成像,了解标记物在肿瘤分子成像中的价值。
1 主要实验材料
1.1 主要仪器与装置
RM 905型活度计:中国计量科学研究院提供;ND-1000型分光光度计:美国NanoDrop Technologies公司产品;SPECT显像仪(GEMRP):美国 GE公司产品;CO2孵箱:美国Thermo Fisher公司产品;细胞培养超净工作台:美国Thermo Fisher公司产品;倒置显微镜CK 40、FV 1000激光共聚焦显微镜:Olympus公司产品。
1.2 主要材料与试剂
氯胺-T:分析纯,上海国药集团化学试剂有限公司产品;Na131I溶液:原子高科股份有限公司产品;RRL多肽:纯度大于99%,北京中科亚光生物技术公司产品。其他试剂均为分析纯,购自北京化学试剂公司。
人脐静脉内皮细胞(HUVEC)、人肝癌细胞(HepG2)、黑色素瘤细胞(B16)、人主动脉内皮细胞(HAEC):购自南京凯基生物有限公司;胎牛血清:美国Gibco公司。
1.3 荷瘤裸鼠模型制备
BALB/c裸鼠:雄性,4~6周龄,20~22 g,SPF级,北京大学医学部实验动物中心提供。每只裸鼠左前肢皮下接种B16细胞(1×107),待肿瘤直径长至0.8~1.0 cm时进行动物实验。
2 实验方法
2.1 多肽RRL的131I标记
采用氯胺-T法进行 RRL的131I标记。于81μL 0.5 mol/L的PB(pH 7.4)中加入 50μg RRL多肽,待多肽完全溶解后加入 10μL(74 MBq)Na131I,然后加入 9μL(0.9 g/L)新鲜配制的氯胺-T,振荡反应2m in,用45μL(4 g/L)偏重亚硫酸钠溶液终止反应。
固定其他标记条件不变,分别延长标记时间,改变氯胺-T的浓度及反应总体积,进行标记条件的优化,以获得较高的标记率。
将标记的混合产物用经牛血清白蛋白(Bovine Serum A lbumin,BSA)饱和,0.05mol/L、pH 7.4的PBS平衡3次的Sephadex G25柱纯化分离,流动相用0.05 mol/L(pH 7.4)PBS冲洗,洗脱液用高压灭菌EP管逐管连续收集(每0.5 m L,共20管)。分光光度计分析每管多肽含量,活度计测量每管放射性活度。收集高峰管(OD280值以及放射性活度值均最高的管),即为标记产物131I-RRL。
采用纸层析法测定标记物的标记率及放化纯度。新华1号层析纸为固定相,V(丙酮)∶V(NS)=3∶1为展开剂,采用γ放射免疫计数器测量各段放射性计数,计算标记率(纯化前标记物峰的计数占各峰总计数的百分比)和放化纯度(纯化后标记物峰的计数占各峰总计数的百分比)。
2.2 多肽与肿瘤细胞结合实验
小分子多肽RRL合成过程中,在其羧基端连接绿色荧光素(FITC),形成标记多肽FITCRRL,进行体外结合实验。培养肿瘤实质细胞和正常组织对照细胞,待细胞生长状态良好、处于指数生长期时,将细胞转移至6孔板中,使细胞完全贴壁。加入FITC-RRL(2 mg/L)与细胞共同培养24 h,此后用4%的多聚甲醛固定细胞30min,PBS(0.05 mol/L,pH 7.4)轻轻漂洗细胞3次;用0.1%的T ritonX-100对细胞进行透膜,使得染料能够进入细胞核,用PBS轻轻漂洗细胞3次;用4',6-二脒基-2-苯基吲哚(4',6-diam idino-2-pheny lindole,DAPI)染核。在激光共聚焦显微镜下观察FITC-RRL在肿瘤实质细胞和正常对照细胞中的结合状况。实验重复3次。
2.3 SPECT显像
取3只荷瘤BA LB/c裸鼠,于显像前3天用含1%的碘化钾(K I)的饮水,对模型动物的甲状腺进行封闭。每只荷瘤鼠腹腔注射 444 MBq131I-RRL多肽。分别于注射后6、12和24 h俯卧位进行全身静态SPECT显像。采集条件:能峰365 keV,窗宽 20%,矩阵256×256,放大倍数2.0,每只裸鼠采集105计数。
3 结果与讨论
3.1 多肽标记结果
采用氯胺-T法标记RRL多肽。最佳标记条件为:多肽用量 50μg,Na131I用量10μL(74 MBq),氯胺-T用量 90μg,反应总体积100μL,振荡反应 3m in。标记率>69%。用Sephadex G25柱对标记产物进行分离纯化,分光光度计对多肽含量进行分析,结果示于图1。由图1a可以看出,第2管放射性计数达峰值,第5管后放射性计数已很低。由图1b可见,吸收峰形成于2、3、4管,峰值位于第2管,此峰与活度计检测结果的峰吻合,验证了淋洗出的化合物是131I标记的多肽RRL。优化标记条件后,131I标记RRL的标记率达到 69%,与前期实验标记率60%[4]相比有所提高。放化纯度大于95%。131I是最早应用于临床的核素之一,不仅可以用于显像诊断,也是应用于放射性核素治疗的最重要的核素。在甲状腺功能亢进症和甲状腺肿瘤的治疗中有着广泛的临床应用及良好的治疗效果。131I的物理半衰期为8.04 d,发射γ和β两种射线,发射的γ射线的能量为 365 keV,可用于SPECT显像;发射的β射线能量为607 keV,能量较高,能够用于甲状腺功能亢进症及肿瘤的治疗;而且131I能够大量生产,价格低廉,因而有较好的临床应用价值。
3.2 FITC-RRL体外结合实验

图1 131I-RRL纯化结果
FITC-RRL与不同种类细胞在37℃孵育24 h后,其荧光显色结果示于图2。绿色荧光素通过小分子肽RRL与细胞特异性的结合作用而被细胞摄取,细胞中绿色荧光强度的差异与细胞摄取绿色荧光素的能力及小分子多肽RRL的能力大小呈正相关。由图2可知,具有肿瘤血管内皮细胞生物学特性的人脐静脉内皮细胞(HUVEC)及肝癌细胞(HepG2)株中,呈现中等强度的绿色荧光信号,与 RRL呈现中等量的结合;黑色素瘤细胞(B16)株中呈现强绿色荧光信号,与RRL呈现大量的结合;正常血管内皮对照细胞(HAEC)中绿色信号很弱,与RRL结合量很少。
文献[2]报道,FITC标记的RRL能够与肿瘤来源的内皮细胞大量结合,气体微泡连接的RRL与肿瘤血管内皮细胞的结合量是正常心肌细胞的3倍多[3]。本实验中,尽管RRL在HUVEC细胞中有大量的摄取,但是与恶性黑色素瘤肿瘤实质细胞大量结合 RRL相比,FITCRRL与HUVEC呈中等量的结合,FITC-RRL与正常的血管内皮细胞即人主动脉内皮细胞(HAEC)几乎不结合,与文献[3]报道一致。此外,图2还显示,结构修饰的RRL(氨基末端连接酪氨酸)除与肿瘤血管内皮细胞结合之外,还能够与肿瘤实质细胞,包括鼠黑色素瘤细胞(B16)和人肝癌细胞株(HepG2)结合,此现象在国内外均未见报道。RRL能够特异性地与肿瘤实质细胞及肿瘤来源的血管内皮细胞结合,通过一定的转运途径进入细胞后,可能与肿瘤血管内皮细胞及肿瘤实质细胞特异表达的共同受体蛋白质结合。文献报道,在肿瘤血管内皮细胞及某些肿瘤实质细胞中,均发现有血管内皮生长因子受体2亚型(Vascular Endothelial Grow th Factor 2,VEGFR-2)特异性高表达[5]。RRL准确的作用机制还有待于进一步深入研究。
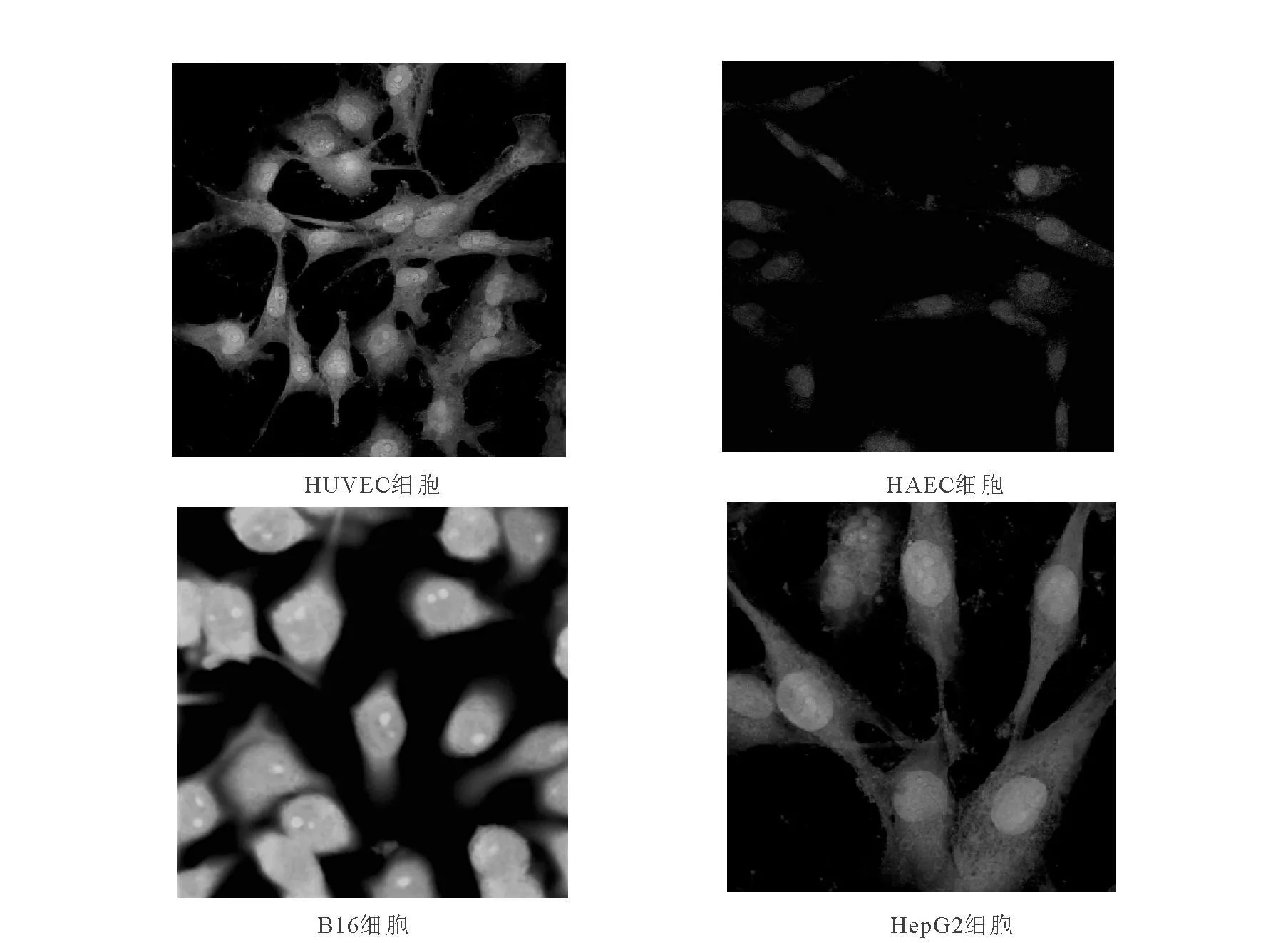
图2 FITC-RRL在肿瘤细胞与正常对照细胞结合荧光显色结果
3.3 SPECT显像
在黑色素瘤(B16)肿瘤模型动物注射131IRRL后不同时间点,肿瘤显像结果示于图3。由图3可见,腹腔注射131I-RRL后6 h SPECT显像,腹腔内可见大量放射性核素浓聚;12 h肿瘤组织可见放射性核素浓聚,24 h肿瘤组织有明显的放射性显像剂存留。在前期实验[4]研究中证实,由尾静脉给前列腺癌肿瘤模型动物BALB/c裸鼠注射131I-RRL后,随着时间的延长,除了肿瘤组织以外其余组织放射性活度都明显下降。肿瘤对131I标记的RRL在6、24 h的摄取明显高于对131I标记的对照肽GGG的摄取。随着注射显像剂后时间的延长,RRL多肽的肿瘤与血液、肿瘤与肌肉的 T/NT比值逐渐升高,至24 h时分别达到1.3和9.1;而对照肽的肿瘤与血液、肿瘤与肌肉的 T/NT比值无升高趋势。
在本研究小组前期的实验研究[4]中发现131I-RRL体内稳定性好。生物分布结果显示,131I-RRL注入体内24 h后,主要滞留在肿瘤组织内,其他组织器官分布较少。本实验中,腹腔注射显像剂131I-RRL 444 MBq后,6 h显像,放射性药物主要浓聚于腹腔内,肿瘤组织分布较少;12 h显像,腹腔内放射性聚集明显降低,肿瘤组织显像;24 h后显像,肿瘤组织放射性浓聚灶清晰可见。RRL不但如文献报道,能够大量结合于肿瘤来源血管内皮细胞,同时还能够与多种不同组织来源的肿瘤实质细胞结合,特异性地浓聚于肿瘤组织内,是很有前景的肿瘤小分子多肽显像剂。

图3 注射131I-RRL后不同时间点黑色素瘤模型鼠SPECT成像
4 结 论
(1)RRL不仅能够与肿瘤来源的内皮细胞结合,更重要的是能够与不同组织来源的肿瘤实质细胞结合。
(2)131I-RRL不但对于前列腺癌有肯定的显像效果,也能够特异性浓聚于黑色素瘤模型鼠的肿瘤组织内,对恶性黑色素瘤有肯定的显像效果。
该实验结果提示,RRL不仅是一种新型的肿瘤新生血管显像剂,而且是一种值得继续深入研究的广谱肿瘤分子靶向显像剂,具有应用于肿瘤放射免疫治疗的可能性。
[1] Fo lkman J.Role of angiogenesis in tumor grow th and metastasis[J].Semin Onco l,2002,29:15-18.
[2] Brow n CK,Modzelew ski RA,Johnson CS,et al.A novel app roach for the identification of unique tumor vasculature binding peptides using an E.coli pep tide display library[J].Annals of Surgical Oncology,2000,7:743-749.
[3] Weller GE,Wong MK,Modzelewski RA,et al.U ltrasonic imaging o f tumor angiogenesis using cont rast m icrobubb les targeted via the tumor binding peptide arginine-arginine-leucine[J].Cancer Research,2005,65:533-539.
[4] 王荣福,于明明,张春丽,等.131I标记肿瘤血管靶向多肽的实验研究[J].同位素,2009,22:96-100.
[5] Li S,Peck-Radosavljevic M,Koller E,et al.Characterization of123I-vascu lar endothelial grow th factor-binding sites expressed on human tumour ce lls:possible imp lication for tumour scintigraphy[J].Int JCancer,2001,91:789-796.

