取代杯[6]芳烃的制备及在18F-FET制备中的应用
彭 程,马云川,陈萧萧,李桂霞,李石磊,张淑婷,贺 勇,齐传民
(1.首都医科大学 宣武医院 PET中心,北京 100053;2.教育部放射性药物化学重点实验室,北京师范大学化学学院,北京 100875)
正电子发射断层显像(PET)是近年来迅速发展起来的一种核医学诊断技术,所用放射性核素18F具有相对较长的半衰期(t1/2=110 min),有较充足的药物标记和显像时间。18F标记的显像剂由于具有诊断率高、特异性强、评价疗效好的优点,越来越受到重视,成指数倍增长[1-4],FET就是最常用的肿瘤诊断药物之一。因标记成功与否对放射性药物的制备至关重要,因此18F标记方法的研究成为当前放射性药物研究的热点之一[5-6]。目前大多数18F标记中采用冠醚(如 K ryptofix 2.2.2,K 2.2.2)络合金属离子,裸露18F-,同时起到相转移催化剂作用,但K2.2.2不仅价格昂贵,且对某些反应催化效果有限。杯芳烃(Calixarene)是由酚单体通过亚甲基在酚羟基邻位连接而成的大环化合物,是继冠醚和环糊精之后的第3代主体分子[7-8]。它由苯环单元通过碳原子连接而成,其疏水性强弱和空穴大小可以通过化学合成进行调节,能配合识别离子型客体,热稳定性、化学稳定性好,因此杯芳烃广泛用作氟化反应的相转移催化剂,具有显著的催化效果[8-10]。但物理性质多样性的杯芳烃仅在19F-取代反应中有报道,还未见到有关在18F标记中采用杯芳烃作为络合金属离子配体及其相转移催化剂研究的相关报道。
本工作拟参考文献[11]合成对(对甲苯磺酸酯)乙基苯甲酰(BOC)氨基酸酯,并以其为活泼前体,分别以自行合成的两种杯[6]芳烃(对磺酸基杯[6]芳烃和对叔丁基杯[6]芳烃)为催化剂研究催化活泼前体的19F取代反应和18F标记活性,合成 O-(2-氟乙基)-L-酪氨酸甲酯(18FFET),研究这两种杯[6]芳烃作为18F标记反应催化剂的可行性。
1 主要试剂和仪器
1.1 试剂
H218O:丰度 95%,美国 Isotec公司产品;18F-:RDSⅢ回旋加速器制备,德国西门子公司产品;三氟乙酸(TFA):德国Merck公司产品;氢氧化钠、碳酸钾、乙酸乙酯、二氯甲烷、乙腈、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)等均为分析纯或光谱纯试剂,北京化工厂产品。所有化学试剂均未经进一步纯化。
1.2 仪器
RY-1型熔点测定仪:天津市分析仪器厂;Nicolet 360 Avatar红外光谱仪:美国Nicolet公司;Bruker-500 MH z及Bruker-400 MHz共振仪:德国 Brucke公司;HP1100 HPLC-MSD型质谱仪:美国惠普公司;Pekin-Elm er240-C元素分析仪:美国Perkin Elmer公司;WIZARD1470型γ计数器:美国PE公司;Grace A lltech高效液相色谱分析柱(5μm,250 mm×4.6mm):美国Perkin Elmer公司;A lltech高效液相分析仪:中国计量科学研究院。
2 实验部分
18F-FET的合成路线[13]示于图1。在图1的合成路线中,中间体4与F-的取代反应是关键步骤,该步反应需要相转移催化剂。目前一般都采用价格昂贵的氮杂冠醚K 2.2.2为相转移催化剂,本工作将其更换为杯芳烃,希望得到更为廉价、高效的催化剂。
2.1 催化剂杯芳烃的合成
2.1.1 对磺酸基杯[6]芳烃钠盐的合成[12,13]
(1)在100 m L三口瓶中加入2.0 g(3.1 mm ol)对氢基杯[6]芳烃和15.4 m L 98%的浓硫酸,在搅拌的同时将混合物加热至 100℃。反应3 h后冷却至室温。(2)将所得黑色反应液过滤,将滤饼溶于100 m L水中。向所得水溶液中加入碳酸钡,调至中性,滤除硫酸钡沉淀。(3)向滤液中加入碳酸钠调溶液的pH为8~9。过滤除去碳酸钡沉淀,将滤液用活性炭进行脱色。滤除活性炭后,蒸除滤液中的水,得到的白色粉末状产品即为对磺酸基杯[6]芳烃的钠盐1.8 g(1.44mmol),收率70.1%。
2.1.2 对叔丁基杯[6]芳烃的合成[12,13]

图1 18F-FET的合成路线
将5.0 g(33.3 mmo1)对叔丁基苯酚、6.8m L(90 mmol)37%的甲醛溶液和0.755 g(12.5 mmol)粒状氢氧化钾的水溶液依次加入装有通氮气装置、搅拌器、分水器、冷凝管的100 m L四口瓶中,搅拌加热,通氮气升温至130℃,保持2 h,分水操作。加入50 m L二甲苯,加热回流3.5 h后将混合液冷却至室温,过滤,用二甲苯洗涤,得到5.9 g无色固体,加入120 m L氯仿和40 m L(0.1 m ol/L)盐酸溶液,分出有机相,用MgSO4干燥,过滤,滤液浓缩至100 m L,沸腾下加入100 m L热的丙酮溶液,冷却,过滤得到白色粉末状对叔丁基杯[6]芳烃4.7 g,收率 86%(文献[13]值:83%)。
2.2 O-(2-[19 F]氟乙基)-L-酪氨酸(19 F-FET)(6)的合成
2.2.1 N-叔丁氧羰基-(O-2-氟乙基)-L-酪氨酸甲酯(5)的制备
将1mmol杯芳烃溶解到1.5m L无水乙腈中,加入1 mmol KF,氮气气氛中加热搅拌,不断通入氮气使乙腈蒸干,再加入1m L乙腈重复上述操作两次,加入0.7 mmol化合物4的8m L无水二甲基亚砜(DMSO)溶液,搅拌下加热160℃反应5 h。TLC检测反应,待反应基本完全后,减压蒸馏除去DMSO,经硅胶柱层析纯化(淋洗液为V(乙酸乙酯)∶V(石油醚)=1∶1的混合液)得到白色固体。
2.2.2 O-(2-[19F]氟乙基)-L-酪氨酸(19FFET)(6)的合成
向含有80 mg化合物5的2m L二氯甲烷溶液中加入2m L三氟乙酸,室温下搅拌5 m in,之后连续通入氮气将溶液吹干,向残留物中加入2m L甲醇和1 m L 0.5 mol/L的氢氧化钠水溶液,80℃下搅拌反应10 min,用0.5 mo l/L的盐酸溶液中和反应液,调节pH,直至析出白色沉淀。滤出沉淀,干燥,得到白色固体。用HPLC分析产物。
2.3 O-(2-[18F]氟乙基)-L-酪氨酸(18F-FET)的制备
将30 mg相应的杯芳烃和3mg K 2 CO3分别溶解在1 m L乙腈和0.5 m L水中,并配成混合液,淋洗捕获18F-的QMA柱子,将18F-冲洗到反应瓶中,测定活度;向反应瓶中不断吹入N2,加入1 m L无水CH3CN,120℃油浴下共沸除去H 2O,重复3次,以确定H2 O被完全除去。将3m g标记前体(化合物4)溶于DMF中,迅速转移至反应瓶中,在160℃下反应30~55min。反应液冷却后,加入 10 m L水稀释,通过Sep-Pak C18柱,滤液收集到1号瓶(主要是没有参与反应的18F-)中。再用10m L H2 O洗涤柱子,滤液收集到2号瓶(确保将没有参与反应的18F-彻底淋洗干净)中,氮气吹干Sep-Pak C18柱。此后,用2m LCH3 CN洗脱C18柱,收集产品滤液到3号瓶中。分别测量1、2、3号反应瓶的放射性活度,计算标记产率。用HPLC分离粗产品。HPLC分析条件:流速为5 m L/m in,流动相为V(乙腈)∶V(水)=70∶30。
3 结果与讨论
3.1 结构鉴定
3.1.1 催化剂杯芳烃的结构鉴定
1)对磺酸基杯[6]芳烃钠盐的结构鉴定
产品熔点大于320℃。IR(KBr,cm-1):ν 3 440、1 176 、1 043、840;文献[12]值为 IR(KBr,cm-1):ν3 440 、1 160 和 1 040 cm-1。1HNMR(D2O,400 MH z):δ4.15(s,12H,6CH 2)、7.56(s,12H);文 献[12]值 为1HNMR(D2O,400 MHz):δ4.32(s,12H,6CH 2)、7.84(s,12H)。
2)对叔丁基杯[6]芳烃的结构鉴定
产品熔点:374~377℃;(文献[13]值:375~378 ℃)。1HNMR(CDCl3,300 MHz,):δ1.25(m,54H,CH3)、3.90(s,12H,CH 2)、7.25(s,12H,Ph—H)、10.53(m,6H,OH)。
3.1.2 O-(2-[19F]氟乙基)-L-酪氨酸(19FFET)(6)的结构鉴定
1)N-叔丁氧羰基-(O-2-氟乙基)-L-酪氨酸甲酯(5)的结构鉴定
1HNMR(400 MHz,DMSO):δ7.22(d,J=8.0 Hz,1H,NH)、7.13(d,J=8.4 Hz,2H,A r—H)、6.86(d,J=8.4 Hz,2H,A r—H)、4.70(dt,J=47.8 Hz,3.7 Hz,2H,—CH2CH2F)、4.17(dt,J=30.2 Hz,3.8 Hz,2H,—CH2CH2F)、4.10(d,J=4.7 Hz,1H,—CH—)、3.59(s,3H,—OCH3)、2.90(dd,J=13.8 Hz,5.2 Hz,1H,A r—CH —H —)、2.77(dd,J=13.6 Hz,10.0 Hz,1H,A r—CH —H —)、1.32(s,9H,—OC(CH 33)。
2)19F-FET的结构鉴定
HPLC分析条件:流速为5 m L/min,流动相为 V(乙腈)∶V(水)=70∶30。19F-FET 的HPLC谱图示于图2。由图2可见HPLC峰出时间 2.28 min,纯度 >99%;1HNMR(500 MHz,DMSO):δ8.56(s,2H,—NH2)、7.22(d,J=8.6 Hz,2H,A r—H)、6.92(d,J=8.6 Hz,2H,A r—H)、4.73(d,J=47.8 Hz,3.7 Hz,2H,F —CH2—)、4.21(dt,J=30.3 Hz,3.7 Hz,2H,F—CH2—CH2—)、4.06(d,J=5.5 Hz,1H,NH2—CH —COOH)、3.11(d,J=6.2 Hz,2H,A r—CH2—)。
3.1.318F-FET的结构鉴定
HPLC分析条件:流速为5 m L/m in,流动相为 V(乙腈)∶V(水)=70∶30。18F-FET 的HPLC谱图示于图2。由图2可知,18F-FET的出峰时间2.67 m in与19F-FET的出峰时间2.28min相吻合(在仪器允许误差范围内),放化产率约为11%(未经衰变校正);HPLC测得放化纯度>99%。
3.2 杯[6]芳烃对FET前体的氟化催化反应的影响因素
3.2.1 杯芳烃作用机理
使用相转移催化剂(PTC)能很好地提高F-在有机溶剂中的浓度,从而提高反应的收率,这是因为杯芳烃能和K+配合成为有机阳离子进入有机溶剂的同时也将F-带入有机溶剂中,这种配合作用的结果:一是促进KF的电离,使F-游离出来,增加亲核活性,易于进攻前体中与磺酸酯基相连的碳原子,发生取代反应;二是在有机阳离子进入有机溶剂时,会将部分F-带入有机相中,从而与溶解在溶剂中的反应物(前体)接触,发生亲核取代反应。相转移催化剂与KF的结合方式示于图3。
由于KF是无机盐,几乎不溶于有机溶剂,而反应中间体4易溶于有机溶剂而不溶于水,故反应物不能很好接触,导致反应速度慢,反应效率低,即使采用非质子极性溶剂,增加KF的溶解性,效果仍不理想。因此上述相转移催化剂的使用是必要的。
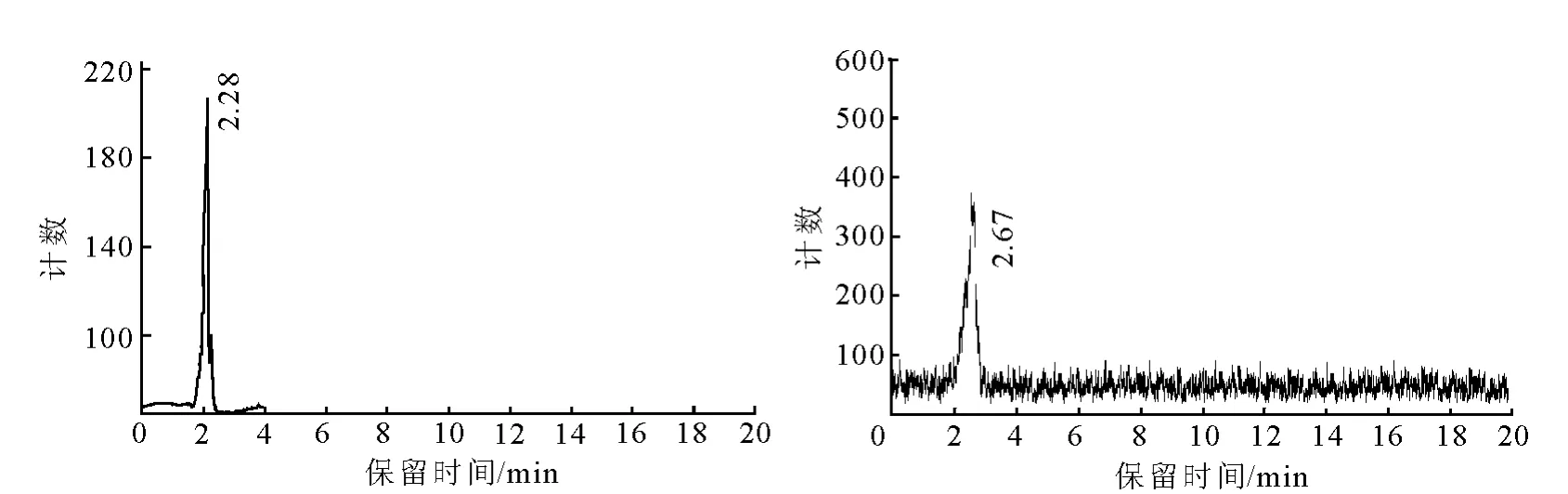
图2 19 F-FET和18F-FET的HPLC
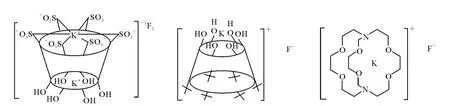
图3 相转移催化剂杯[6]芳烃、K rypto fix 2.2.2与K+的络合方式
实验证明,在任何温度下使用对叔丁基杯[6]芳烃作为催化剂都没有对FET前体显示出氟代催化作用,它参与的18F标记中没有产物生成,证明没有催化作用。而对磺酸基杯[6]芳烃不仅在催化19F取代反应中有催化作用(尽管收率不高),而且在催化FET前体18F标记中是有一定效果(但与K 2.2.2相比效果要差得多)。两种杯芳烃的催化效果的差异原因可能是两种杯[6]芳烃对K+的作用方式不同、极性不同、络合能力不同等所致催化能力有本质上的差异。而对位磺酸基的引入使得杯芳烃的极性大幅增强(极性接近冠醚),有助于杯芳烃分子与极性溶剂分子相互作用,增加溶剂和催化剂间的转移效果,增大溶剂效应。同时6个磺酸基负离子能够直接与K+络合,这种络合作用带来的影响甚至会大于6个羟基与K+的络合作用,因此6个磺酸基负离子能够直接与K+络合也可能对催化剂的催化活性具有重要的贡献。由于对叔丁基杯[6]芳烃在18F标记中没有催化活性,因此没有对它进一步研究。只研究了对磺酸基杯[6]芳烃作催化剂在18F标记反应中的催化作用。
3.2.2 反应温度对催化的影响
氟代反应活化能较高,而升高温度是克服活化能最有效的方法,因此温度对反应的影响是显著的。本实验中反应温度对催化的影响结果列于表1。由表1可以看出,相转移催化剂对叔丁基杯[6]芳烃和对磺酸基杯[6]芳烃在110℃下都没有催化作用;在当温度高到180℃时,催化剂对叔丁基杯[6]芳烃催化反应液的HPLC显示没有氟代产物生成,它在催化18F标记中也没有18F标记产物生成。而对磺酸基杯[6]芳烃催化19F取代反应中要好得多,但收率也不高;在催化18F标记中也有一定效果(但与K2.2.2相比效果要差得多)。通常使用的PTC是季铵盐,但是由于氟化反应需要高温,季铵盐对高温不稳定,常发生很多副反应。因此热稳定性好的杯芳烃与冠醚有更好的应用前景。
表1结果表明,升高温度对提高杯[6]芳烃的催化性能远比其他相转移催化剂重要,因为杯[6]芳烃与K 2.2.2相比含有6个苯环,其非极性成分比K2.2.2要大得多,其刚性也大得多,随着温度的升高,分子的能量升高、自由能增大,相转移催化性能增强,而杯芳烃自身与其他相转移催化剂相比具有热稳定性、化学稳定性好的特点[8]。因此加热对杯芳烃的催化反应是有利的。而它的反应机理和与冠醚类化合物的反应机理类似。与K2.2.2对K+的作用也逐渐接近,而到目前为止,K2.2.2对F-的催化作用仍是最强的。
3.2.3 其他因素对催化性能的影响
参考相关文献[10]对杯芳烃催化剂性能的研究,考察了对磺酸基杯[6]芳烃用量对催化活性的影响,选择对磺酸基杯[6]芳烃与原料的摩尔比为1∶1、5∶1和10∶1进行了探讨,结果列于表1。表1结果显示:对磺酸基杯[6]芳烃与原料的摩尔比为5∶1时,催化效果最好:在180℃下,反应240m in,18F-FET的收率可达32%。
在对磺酸基杯[6]芳烃作催化剂的18F标记反应中,溶剂的影响也很显著。由表1可知,在极性很小的二甲苯中没有反应,说明溶剂的溶剂化作用非常重要,非质子极性溶剂对反应更有利;沸点较低的溶剂无法在受热时达到所需要的温度,因此在乙腈等低沸点的极性溶剂中也不反应。DMF和DMSO两种溶剂沸点高、极性大,因此是上述反应的最佳选择。
反应时间对磺酸基杯[6]芳烃催化氟化反应的影响列于表1。由表1可知,在180℃反应温度和相同溶剂等条件下,反应5 h基本达到平衡,反应时间短,收率偏低,但延长反应时间,收率并没有进一步提高。18F的标记与普通氟的取代反应有很大不同,主要是因为在18F标记反应中,18F-用量很少,反应时分子的接触面积大,反应速度快,因此反应时间要短,一般在1 h内就能完成。

表1 对磺酸基杯[6]芳烃对FET前体的氟化催化影响因素
4 结 论
1)对叔丁基杯[6]芳烃对FET的18F标记无催化活性,对磺酸基杯[6]芳烃钠盐对FET的18F标记有一定催化作用。
2)杯芳烃更适合在150~200℃的高温下进行催化反应。
本研究结果提示,通过改进杯芳烃的取代基、改变杯芳烃分子的性质也许会找到有前景的18F标记相转移催化剂。
[1] Gibson RE,Burns HD,H amill TG,et al.Ingentaconnect non-invasive radiotracer imaging as a tool for drug development[J].Current Pharmaceutical Design,2000,6:973-989.
[2] Delbeke D.Oncological app lications o f FDG PET imaging:brain tumors,colorectal cancer lymphoma and me lanoma[J].JNuc Med,1999,40:591-603.
[3] Engel H,Steinert H,Buck A,et al.Whole-body PET:physiological and artifactua l fluorodeoxyg lucose accumulations[J].NuclMed,1996,37:441-446.
[4] Varagnolo L,Stok kelMPM,Mazzi U,etal.18F-labe led radiopharmaceuticals for PET in oncology,excluding FDG[J].Nuc Med Bio l,2000,27:103-112.
[5] Lowe VJ,Fletcher JW,Gobar L,et al.Prospective investigation of positron em ission tomography in lung nodules[J].JClin Oncol,1998,16(3):1 075-1 084.
[6] 张家胤,李彪.正电子药物在肿瘤诊断中的进展[J].临床核医学,2006,30(1):30-35.
[7] Bohmer V.Calixarenes,macrocyclesw ith(almost)unlim ited possibilities[J].Angew Chem Ed Eng1,1995,34(7):713-745.
[8] 冯亚青,洪学传,李熙风,等.对叔丁基杯[4]芳烃对聚丙烯热氧稳定性的影响及其动力学研究[J].高等学校化学学报,2001,22(3):185-488.
[9] 洪学传,冯亚青,李熙风,等.杯芳烃一新型有机材料光稳定剂[J].中国塑料,2000,14(1):71-74.
[10]孟祥启,冯亚青,孟舒献,等.杯芳烃作为相转移催化剂用于四氟对苯二甲酸二甲酯的合成[J].化学试剂,2006,28(1):5-7.
[11]王明伟,尹端沚,程登峰,等.直接亲核反射氟化法合成O-(2-[18F]氟乙基)-L-酪氨酸[J].核技术,2006,29(7):522-526.
[12] Seiji Shinkai,Seiichi Mori,H iroshi Koreishi,et al.Hexasulfonated Calix[6]larene derivatives:a new class of catalysts,surfactants,and hostmolecules[J].J Am Chem Soc,1986,108:2 409-2 416.
[13] Gutsche CD,Lee-gin Lin.p-tert-Buty lclalix[6]arene[J].Organic Synthesis,1990,68:238-242.

