Re/99Tcm(CO)3+黄酮复合物的合成及其与Aβ斑块的结合特性
杨 洋,刘永娟,张华北
(放射性药物教育部重点实验室,北京师范大学 化学学院,北京 100875)
阿尔茨海默病(AD)是老年人最常见的脑神经退化疾病,临床特征包括记忆力减退、认知功能障碍和痴呆等[1]。AD的神经病理学特征包括大脑神经细胞外大量的老年斑(SPs)和神经细胞内大量的神经元纤维缠结(NFTs)。脑中Aβ斑块的形成是AD病理学的关键[2-4]。因此,利用PET和SPECT技术进行显像测定Aβ沉积的位置和数量,可对阿尔茨海默病进行早期无创诊断[5,6]。
如今,用来直接对活体大脑内Aβ斑块进行特异性显像的显像剂的发展为AD的诊断提供了契机。这些研究主要集中于Aβ斑块的特异性配体,近期报道的较成功的AD显像剂有18FFDDNP[7,8]、11C-PIB[9,10]、11C-SB-13[11,12]和11CBF-207[13]。迄今为止,已经报道了一系列新型的用于活体Aβ斑块显像的碘标记的黄酮和苯乙烯色酮衍生物,并且碘标记的黄酮类化合物有较高的脑摄取量并能快速从脑内清除,有望成为探测Aβ斑块的候选显像剂。然而,用于Aβ特异性显像的99Tcm标记的黄酮衍生物还没有得到发展,目前还没有用于人体AD评价的99Tcm标记显像剂。相对于PET显像剂,99Tcm标记的显像剂制备更简单、方便,是更适用的定量分析AD的SPECT显像方法。
99Tcm(T1/2=6 h,140 keV,由99Mo-99Tcm发生器生产)是诊断用放射性药物中最常用的放射性核素[14],99Tcm发射的中等能量γ射线能被γ照相机探测,物理半衰期与动物分布和显像所需要的滞留时间相匹配[15]。为了研制出99Tcm标记的Aβ特异性显像剂,根据黄酮衍生物与本小组拟设计合成以99Tcm(CO)3+为中心的黄酮类Aβ(1-40)斑块显像剂,并根据 Re和 Tc性质十分相似这一特点[16,17],合成其相应的铼配合物Re(CO)3+-flavone,以证明99Tcm(CO)3+-flavone的结构,用荧光方法定量铼配合物与Aβ(1-40)斑块的体外结合常数,并进行99Tcm(CO)3+-flavone在正常小鼠体内的生物分布实验,研究99Tcm(CO)3+-黄酮类衍生物作为AD显像剂的可能性。
1 主要实验材料
1.1 试剂和仪器
99Mo-99Tcm发生器:北京新科斯达医药公司产品;[99Tcm(CO3(H 2O3]+:参照文献[18]制备 ;Aβ(1~40)纤维:参照文献[19]制备 ,并在制备后立即使用。所有药品和试剂都是从市场上购买,直接使用而未进行再次处理。
反相高压液相色谱(RPHPLC):配A lltech系统(HPLC泵模型626,LINEAR UVIS-201,BIOSCAN流度计),分析 C-18柱(4.6 mm×250mm,5μm,Venusil MP-C18,美国艾杰尔科技有限公司),采用1m L/min流速洗脱。
Bruker-400 NMR核磁共振仪:美国Varian公司产品;Trance MS2000质谱仪:Finnigan公司提供;AVATAR 360傅立叶变换红外光谱仪(KBr压片):美国 Nicolet公司提供;1470WizardTM自动γ计数器:美国Wallac公司;Fluorolog Tau-3荧光分光光度计:法国J-Y公司产品;Cintra 10e紫外分光光度计:澳大利亚GBC公司产品。
1.2 实验动物
昆明小鼠:12只,18~20 g,SPF级,北京大学动物中心提供。
2 实验方法
2.1 Re(CO)3+-flavone(E)的合成
利用分子对接研究黄酮分子与Aβ(1~40)纤维(蛋白)相互作用以及黄酮分子本身的三维定量构效关系(3D-QSAR),以设计全新的能够用99Tcm核心标记的黄酮类衍生物。根据研究结果设计的Re(CO)3+-flavone合成路线示于图1。2.1.1 羟乙基胺基二乙酸叔丁酯(A)的合成将44.5 g(228.2 mmol)溴乙酸叔丁酯和25.67 g(256.7 mm ol)KHCO3溶于150 m L DMF中,将体系温度降到0℃,搅拌,缓慢滴加(40m in)6.2m L(102.9 mm ol)2-氨基乙醇;此后,水浴加热,维持温度在38~45℃,反应24 h,停止加热和搅拌,使体系自然冷却至室温;向体系中加入饱和NaHCO3溶液调pH至7,然后加入乙醚萃取,分液,有机相再用饱和NaCl溶液洗3次(每次 100 m L),分液,有机相用饱和Na2 SO4干燥36 h,过滤,旋蒸除去乙醚。粗产品通过硅胶柱纯化(流动相为V(石油醚)∶V(乙酸乙酯)=2∶1),产品的R f为 0.45,得到的产品为白色晶体。
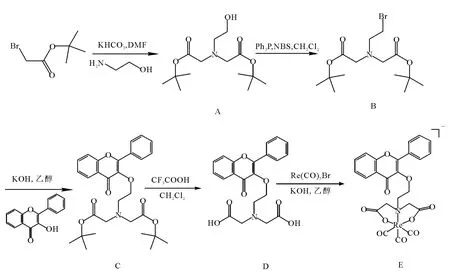
图1 Re(CO)3+-flavone的合成路线
2.1.2 溴乙基胺基二乙酸叔丁酯(B)的合成将1.75 g A(6.0 mm ol),6.32 g(24.1 mmol)Ph3 P溶于30 m L CH 2 Cl2中,将体系温度降至0℃,向体系中加入4.31 g(24.2 mm ol,溶于100 m L CH2 Cl2)NBS,1.5 h滴完,室温下反应16 h。旋蒸除去溶剂CH 2 Cl2,用乙醚洗涤,旋蒸除去乙醚,得到白色固体。粗产品通过硅胶柱分离(流动相为V(石油醚)∶V(乙酸乙酯)=8∶1),产品的R f值为0.7,得到无色油状产品。
2.1.3 2-苯基-3-(二叔丁基二乙酸基胺基)乙氧基-4-氧代-苯并吡喃(C)的合成 50mg黄酮醇、10.5 mg KOH和B(65.5mg)溶于150m L乙醇溶剂中,在室温下搅拌24 h。析出白色固体,过滤除去固体得到淡黄色溶液,旋蒸除去溶剂,用硅胶柱分离得到最终产品(V(石油醚)∶V(乙酸乙酯)=2∶1,产品的Rf值为0.6)。最终产品为亮黄色固体。
2.1.4 2-苯基-3-(二羧基胺基)乙氧基-4-氧代-苯并吡喃(D)的合成 1 g C和2 g CF3 COOH溶解在 150 m L CH 2 Cl2中,室温下搅拌4 d,停止反应,向体系中缓慢加入饱和NaHCO3溶液调节体系的pH为7,分液,保留有机相,有机相多次用饱和NaHCO3溶液洗涤,分液,旋蒸除去溶剂,得到黄色油状固体。
2.1.5 Re(CO)3+-flavone(E)的合成 取55m g化合物 D、55 m g Re(CO)5Br和 15 mg KOH溶于50m L乙醇溶剂中,在55℃下搅拌4 h,旋蒸除去溶剂,粗产物用乙醚洗涤得到橙红色油状物,用硅胶柱分离得到最终产品(V(CH2 Cl2)∶V(乙醇)=4∶1,产物的R f=0.9)。
2.2 99Tcm(CO)3+-flavone的制备
将0.5 m L(约10 GBq/L)[99Tcm(CO3(H 2O3]+溶液加入盘尼西林小瓶中,再加入0.1m L D的水溶液(D的质量浓度为0.05 g/L)。调pH到8,100℃下加热30 min。
2.3 标记产物的分析
2.3.1 HPLC分析 HPLC分析条件为:0~0.01 min,乙腈 0%,水100%;0.01~10.00 min,乙腈 100%,水 0%;10.01~ 15.00min,乙腈100%,水0%。流速1.0m L/min。
2.3.2 TLC分析 TLC用来定性分析反应产物99Tcm(CO)3+-flavone和[99Tcm(CO3(H2O3]+核心。分析条件为:聚酰胺纸(10 cm×0.5 cm)为固定相,生理盐水为展开剂。用1470 WizardTM自动γ计数器测放射性计数。标记物的TLC分析结果显示,99Tcm(CO)3+-flavone和[99Tcm(CO3(H 2O3]+的 R f分别为0.8~0.9和0~0.1。
2.4 溶液中Aβ纤维的结合实验
2.4.1 Aβ(1-40)纤维的形成 Aβ(1-40)纤维按照文献[19]方法制备:将1m g Aβ(1-40)单体溶于2m L PBS(pH=7.4)溶液中,得到0.5 g/L的Aβ溶液,向溶液中加入EDTA(1 mm ol/L)后将上述溶液置于恒温摇床内,在37℃下,350 r/min,摇动72 h。得到微浊的、有白色絮状悬浊液。借助荧光光谱用硫磺素 T证明Aβ(1-40)纤维的形成[20]。Aβ(1-40)纤维在制备后立即使用。
2.4.2 荧光方法研究Re(CO)3+-flavone与Aβ纤维的结合能力 用500μL PBS溶液(pH=7.4)稀释新鲜的Re(CO)3+-flavone溶液至4~9 nmo l/L,再加入5μL Aβ(1-40)纤维溶液。在对以上混合液测荧光强度前,先在室温下培育1min。测荧光强度的条件为:狭缝宽2 nm,当发射波长为456 nm时,激发波长为380 nm;扫描范围410~620 nm。每个浓度的溶液平行做3份,每份测3次,取平均值。根据得到的溶液浓度-荧光强度,采用MicrocalO rigin 6.0软件作双倒数图,得到解离常数Kd值。
2.5 99Tcm(CO)3+-flavone在正常小鼠体内的生物分布
取0.1 m L(约 177 kBq)所合成的99Tcm(CO)3+-flavone的生理盐水溶液,由尾静脉注入小鼠体内。分别于注射后2、30、60和120 min时断颈处死小鼠,分别测定血液及各个脏器(肝、肾、骨、脑)的质量和放射性计数,并计算每克组织或器官的放射性摄取(%ID/g),以1%ID作为标准。每个时相平行3只小鼠,取平均值,并计算标准偏差。
3 结果和讨论
3.1 化学合成结果
化合物A 、B、C、D、E 按照图 1所示的路线制备,并用1HNMR、13CNMR、ESI-MS 和 IR 分析表征。
3.1.1 羟乙基胺基二乙酸叔丁酯(A) IR:3 438.3 cm-1、2 978.5 cm-1、2 933.7 cm-1、1 456.8 cm-1、1 393.6 cm-1、1 732.0 cm-1、1 368.6 cm-1、1 223.5 cm-1、1 070.9 cm-1、1 150.5 cm-1。1HNMR(CDCl3,400 MH z):3.90(s,1H)、3.53(t,J=5.1 Hz,2H)、3.45(s,4H)、2.89(t,J=5.1 H z,2H)、1.47(s,18H)。13CNMR(CDCl3,400 MH z):δ28.13、56.64、57.07、59.34、81.49 、171.46。MS:m/z 290.3[M+H]+、234.3[M+H-C(CH 33]+。3.1.2 溴乙基胺基二乙酸叔丁酯(B) IR:3 467.8 cm-1、2 977.3 cm-1、1 709.0 cm-1、1 439.2 cm-1、1 368.2 cm-1、1 159.4 cm-1、1 120.8 cm-1、725.0 cm-1、542.9 cm-1。1HNMR(CDCl3,400 MH z):3.51(s,4H)、3.46(t,J=7.5,3H)、3.16(t,J=7.4,3H)、1.47(s,18H)。13CNMR(CDCl3,400 MHz):δ28.17、30.21 、56.52 、56.73 、81.24、170.45。MS:m/z 352.0[M+H,79Br]+、354.1[M+H,81Br]+、272.2[M-Br]+。
3.1.3 乙-苯基-3-(二叔丁基二乙酸基胺基)乙氧基-4-氧代-苯并吡喃(C) IR:2 977.5 cm-1、2 928.1 cm-1、1 729.5 cm-1、1 640.2 cm-1、1 613.8 cm-1、1 467.9 cm-1、1 393.2 cm-1、1 367.8 cm-1、1 223.9 cm-1、1 147.7 cm-1、1 031.4 cm-1、760.6 cm-1。1HNMR(CDCl3,400 MHz):8.20(d,J=32 Hz,1H)、8.15(d,J=6 Hz,1H)、8.13(d,J=6Hz,1H)、7.67(m,1H),7.51(m,4H),7.40(t,J=8 H z,1H)、4.19(t,J=8 Hz,2H),3.52(s,4H)、3.13(t,J=8 Hz,2H)、1.43(s,18H)。13CNMR(CDCl3,400 MHz):δ170.61 、155.75、140.66、133.36、131.06、130.65、128.77、128.48、125.86、124.61、124.28 、118.00 、80.85、70.82、69.76、66.36、56.21、53.99、28.18。MS:m/z 532.4[M+Na]+、510.4[M+H]+、454.4[M+H-C(CH3)3]+、398.4[M+2H-2C(CH3)3]。
3.1.4 乙-苯基-3-(二羧基胺基)乙氧基-4-氧代-苯并吡喃(D) IR:3 435.6 cm-1、2 975.6 cm-1、2 928.1 cm-1、2 871.2 cm-1、1 731.7 cm-1、1 640.7 cm-1、1 614.7 cm-1、1 468.4 cm-1、1 446.6 cm-1、1 201.3 cm-1、1 148.3 cm-1、834.0 cm-1、694.1 cm-1。1HNMR(CD3OD,400 MH z):8.09(m,3H)、7.71(m,1H)、7.60(m,1H)、7.47(s,3H)、7.40(m,1H)、4.02(t,J=5 Hz,2H)、3.74(s,1H)、3.54(s,1H)、3.37(t,J=7 H z,2H)、3.23(s,4H)。13CNMR(CD3OD,400 MH z):δ176.92 、172.97、172.25、156.89、141.60、135.28、132.39 、129.87 、129.82 、126.33 、119.49 、82.24 、71.90、70.59、61.52、57.16、55.13。 MS:m/z 398.3[M+H]+。
3.1.5 Re(CO)3+-flavone(E) IR:3 429.8 cm-1、2 956.8 cm-1(Re-CO)、2 924.6 cm-1(Re-CO)、2 852.4 cm-1(Re-CO)、2 010.0 cm-1(酯基,C=O)、1994.5 cm-1(苯并吡喃,C=O)、1 881.1 cm-1(C—O)、1 685.4 cm-1(C=C)、1 541.3 cm-1(C-N)、1 490.5 cm-1、 1 438.2 cm-1、1 207.0 cm-1(苯并吡喃C-H)、1 135.7 cm-1(苯并吡喃C-H)、1 016.8 cm-1(苯并吡喃CH)、842.1 cm-1(苯环 C-H)、801.9 cm-1(苯环 C-H)、732.9 cm-1(苯环 C-H)。1HNMR(CD3OD,400 MHz):7.35(m,3H,苯并吡喃)、7.26(m,3H,苯环)、6.88(m,2H,苯环)、3.73(s,4H,O=C-CH 2-N)、3.67(t,2H,-CH2-O)、3.00(t,2H,-CH 2-N)。13CNMR(CD3OD,400 MH z):δ199.90(Re-CO)、198.83(Re-CO)、178.43(酯基,C=O)、158.29(苯并吡喃,C=O)、157.99、134.20、131.03、128.68、128.42、125.15、125.00、124.15、121.73、118.75、118.42、115.77、68.81、63.26、45.66。MS(187/185Re,ES-):m/z 666.4、664.6[M]-。
3.2 HPLC分析
化合物 Re(CO)3+-flavone、99Tcm(CO)3+-flavone和化合物D HPLC-UV分析谱图示于图2。由图2b可知,99Tcm(CO)3+-flavone保留时间为3.2 min,计算得99Tcm(CO)3+-flavone的放化纯度>95%。与Re(CO)3+-flavone(保留时间=3.2min,HPLC-UV在λ=254 nm 处,图2a)和标记前体化合物D(保留时间=7.4 m in,HPLC-UV在λ=254 nm处,图2c)比较可知,Re(CO)3+-flavone与99T cm/Re(CO)3+-flavones有相同的结构。

图2 标记物的Radio(UV)-HPLC分析结果a—— Re(CO)3+-flavone;b——99Tcm(CO)3+-flavone;c——化合物 D
3.2.1 Aβ纤维的制备结果 Aβ(1-40)聚集前后的电镜图像分别示于图3a和图3b,在透射电镜下观察到Aβ(1-40)聚集成了纤维状结构。硫磺素-T溶液荧光图示于图4.由图4可知,当 5μL Aβ(1-40)纤维溶液加到 500μL硫磺素 T(4μm ol/L)溶液中时,在485 nm处荧光强度有明显加强,此现象也表明Aβ(1-40)纤维的形成。
3.2.2 Re(CO)3+-flavone与Aβ纤维的结合能力 通过铼配合物的紫外-可见吸收及荧光发射性质,找到了铼配合物的最佳激发波长,在此最佳激发波长(420 nm)下,测每个浓度的铼配合物溶液,及加入Aβ(1-40)纤维溶液后的荧光强度,结果示于图5。由图5可见,加入 Aβ(1-40)纤维后,铼配合物溶液的荧光信号显著增强,且发射波长的位置几乎没有变化(460~458 nm),说明Re(CO)3+-flavone与Aβ纤维的结合。

图3 Aβ(1-40)聚集前后的电镜图像a——单体 Aβ(1-40),b——纤维状聚集的 Aβ(1-40)

图4 硫磺素-T溶液荧光图
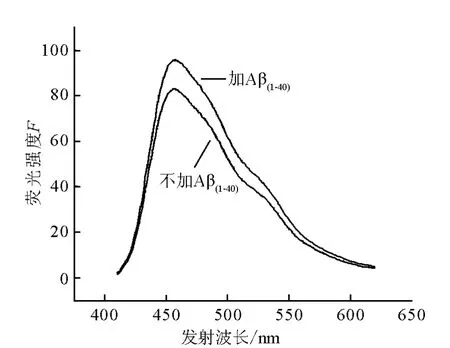
图5 铼配合物溶液的荧光强度
以铼配合物的浓度的倒数(1/C)为横坐标,以铼配合物与Aβ(1-40)纤维结合后和结合前的荧光强度差值(E)的倒数(1/F)为纵坐标,用Origin 6.0软件作双倒数图,结果示于图6。直线与x轴的交点为-1/K d,拟合图6得到直线方程为y=3.460 31×10-4+0.001 88 x,R=0.973 97,s=3.663 29×10-5,P=0.026 03,F=36.925 73。直线方程中y为荧光增强的倒数;x为浓度的倒数;R为线性相关系数;s为标准偏差;F为铼配合物与Aβ(1-40)纤维结合后和结合前的荧光增强。

图6 铼配合物溶液浓度-荧光强度双倒数图
由此方程得到铼配合物与Aβ(1-40)纤维结合的解离常数:
此结果表明,铼配合物与Aβ(1-40)纤维作用的解离常数在nmol/L级,说明二者的相互作用很强。
几种化合物与Aβ纤维结合的抑制常数列于表1。由表1可知,与放射性碘标记的黄酮和苯乙烯基色酮衍生物相比较,Re(CO)3+-flavone与Aβ纤维结合力更强。
3.3 99Tcm(CO)3+-flavone在小鼠体内的生物分布
99Tcm(CO)3+-f lav one 在正常小鼠体内的生物分布列于表 2。由表 2可以看出,99Tcm(CO)3+-flavone在脑内的初始摄取值高(2 min时为0.46±0.23%ID/g),且清除迅速(120 min时,脑内放射性摄取只有0.13±0.04%ID/g)。此外,99Tcm(CO)3+-flavone在其他器官内也清除较快。其在正常小鼠体内初始摄取值较高,代谢较快,预示化合物具有较高的信噪比,有望成为Aβ成像探针。

表1 化合物与Aβ纤维结合的抑制常数







表2 99Tcm(CO)3+-f lavone在正常小鼠体内的生物分布(±s,n=3)
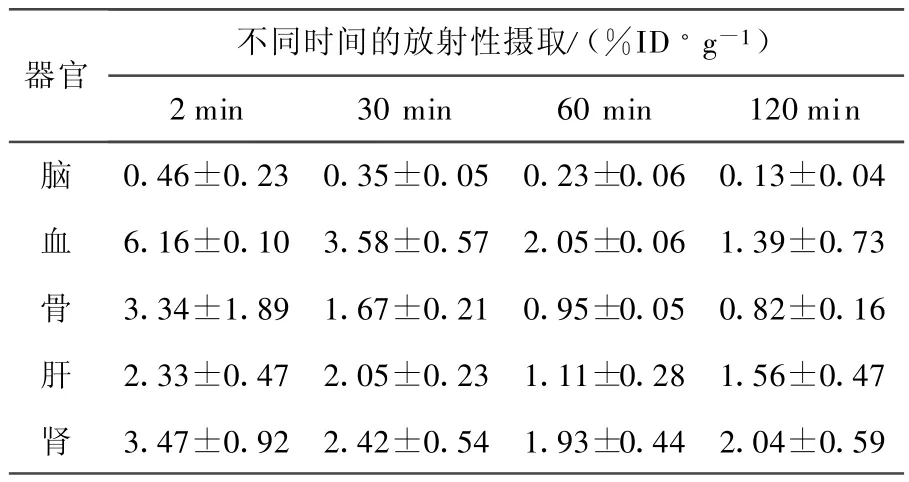
表2 99Tcm(CO)3+-f lavone在正常小鼠体内的生物分布(±s,n=3)
不同时间的放射性摄取/(%ID·g-1)器官2m in 30 m in 60 m in 120m in脑 0.46±0.23 0.35±0.05 0.23±0.06 0.13±0.04血 6.16±0.10 3.58±0.57 2.05±0.06 1.39±0.73骨 3.34±1.89 1.67±0.21 0.95±0.05 0.82±0.16肝 2.33±0.47 2.05±0.23 1.11±0.28 1.56±0.47肾 3.47±0.92 2.42±0.54 1.93±0.44 2.04±0.59
4 结 论
(1)设计并合成了新型的与Re(CO)3+同型的99Tcm(CO)3+黄酮衍生物作为 Aβ斑块SPECT显像候选物。
(2)合成了相应的铼配合物以证明其结构,研究了其相应的铼配合物Re(CO)3+-flavone的紫外和荧光性质,利用荧光方法得到了 Re(CO)3+-flavone与Aβ(1-40)纤维的体外亲和力达5.43 nmol/L。
(3)99Tcm(CO)3+-flavone在正常小鼠体内注射后2~120 min,有较高的脑摄取量和快速清除。
以上特点表明,99Tcm标记的黄酮类似物作为体内Aβ斑块显像剂值得进一步研究。
[1] Hardy J,Selkoe DJ.The amy loid hypothesis of Alzheimer's Disease:p rogress and problems on the road to therapeutics[J].Sci,2002,297(5 580):353-356.
[2] H ardy JA,H iggins GA.A lzheimer's Disease:the am y loid cascade hypothesis[J].Sci,1992,256(5 054):184-185.
[3] Selkoe DJ.Imaging Alzheimer's amyloid nat[J].Biotechnol,2000,18(7):823-824.
[4] Selkoe DJ.A lzheimer's Disease:genes,proteins,and therapy[J].Physiol Rev,2001,81(2):741-766.
[5] Mathis CA,Wang Y,Klunk WE.Imaging betaamyloid p laques and neuro fibrillary tang les in the aging human brain[J].Curr Pharm Des,2004,10(13):1 469-1 492.
[6] Nordberg A.PET imaging of amy loid in A lzheimer's Disease[J].Lancet Neuro l,2004,3(9):519-527.
[7] Shoghi-Jadid K,Small GW,Agdeppa ED,et al.Localization of neurofibrillary tangles(NFTs)and beta-amyloid p laques(APs)in the brains of living patients with Alzheimer's Disease[J].2002,Am JGeriatr Psychiatry,10(1):24-35.
[8] Sma ll GW,Kepe V,Ercoli LM,et al.PET of brain amy loid and tau inm ild cognitive impairment[J].N Engl JMed,2006,355(25):2 652-2 663.
[9] K lunk WE,Engler H,Nordberg A,et al.Imaging brain amyloid in Alzheimer's Disease with pittsburgh compound-B[J].Ann Neuro l,2004,55(3):306-319.
[10]Eng ler H,Forsberg A,A lmkvist O,et al.Tw oyear fo llow-up of amy loid deposition in patients with A lzheimer's Disease[J].Brain,2006,129(11):2 856-2 866.
[11]Verhoeff NPLG,Wilson AA,Takeshita S,et al.In-vivo imaging of Alzheimer's Disease beta-amyloid w ith[11C]SB-13 PET[J].Am JGeriatr Psychiatry,2004,12(6):584-595.
[12]Ono M,Wilson A,Nobrega J,etal.C-11 labe led stilbene derivatives as Aβaggregate-specific PET imaging agents for A lzheimer's Disease[J].Nucl Med Bio l,2003,30(6):565-571.
[13]Kudo Y,Okamura N,Furumoto S,et al.Styrylbenzoxazole derivatives for in vivo imaging of amyloid p laques in the brain[J].J Nucl Med,2007,48(4):553-561.
[14]Jurisson SS,Berning D,Jia W,et al.Coordination compounds in nuclear medicine[J].Chem Rev,1993,93(3):1 137-1 156.
[15]Zhuang ZP,Kung MP,H ou C,et al.Bipheny ls labeled w ith technetium-99m for imagingβ-amyloid p laques in the brain[J].Nucl Med Biol,2005,32(2):171-184.
[16]Ono M,Watanabe R,Kaw ashima H,et al.18F-labeled flavones for in vivo imaging o f beta-amy loid plaques in A lzheimer's brains[J].Bioorg Med Chem,2009,17(5):2 069-2 076.
[17]Ono M,Yoshida N,Ishibashi K,etal.Radioiodinated flavones for in vivo imaging o fβ-amy loid p laques in the brain[J].J Med Chem,2005,48(23):7 253-7 260.
[18]A lberto R,Schib li R,Eg li A,et al.A novel Organometallic aqua comp lex of technetium for the labeling of biomolecules:synthesis of[99Tcm(OH2)3(CO)3]+from[99TcmO4]-in aqueous solution and its reaction with a bi-functional ligand[J].J Am Chem Soc,1998,120(31):7 987-7 988.
[19]K lunk WE,Jacob RF,Preston MR.Quantifying am y loid β-Pep tide(Aβ)aggregation using the congo red-Aβ (CR-Aβ)spectrophotometric assay[J].Anal Chem,1999,266(1):66-76.
[20] LeVine H,Thioflavine T.Interaction with synthetic A lzheimer's Disease beta-amy loid peptides:detection of amyloid aggregation in so lution[J].Protein Sci,1993,2(3):404-410.
[21]Ono M,Maya Y,H aratake M,et al.Synthesis and characterization o f sty ry lchromone derivatives as beta-amyloid imaging agents[J].Bioorg Med Chem,2007,15(1):444-450.

