紫贻贝配子细胞表面糖基的定位研究
刘慧慧,李太武,苏秀榕
(1.浙江海洋学院海洋科学学院,浙江舟山 316004;2.宁波大学海洋学院,浙江宁波 315211)
紫贻贝Mytilus edulis Linnaeus俗称青口、海红,其干制品称淡菜,有很高的营养价值、药用和保健功效,是我国目前主要的贝类养殖品种之一,在山东、浙江、广东等沿海省份都有广阔的养殖海域。目前对紫贻贝的研究主要集中在组织学、营养学、养殖技术、分子特征[1]及杂交育种[2]等方面,对其受精机理的研究还未见报道。
在对受精机制的研究中,精子与卵细胞表面的糖蛋白受到了广泛重视,应用凝集素亲和细胞化学方法,在多种动物和人配子细胞表面已证实有糖蛋白分布,另有研究发现鲍精子顶体泡和卵细胞表面分布大量糖蛋白类物质,是否贻贝的配子细胞也具有同样特征,有待于研究证实。因此,我们选用可以特异性结合半乳糖、葡萄糖、甘露糖、岩藻糖(精卵识别中起重要调节作用)的荧光标记凝集素,对紫贻贝配子细胞中对应的糖进行研究,以期为贻贝生殖机理的研究奠定基础。
1 材料和方法
1.1 样品制备
贻贝新鲜的雌雄性腺组织用改良的Carnoy液固定,常规脱水、石蜡包埋、切片(厚度为7 μm)。
1.2 凝集素
本实验所用FITC标记的LCA(兵豆凝集素)、PNA(花生凝集素)、UEA(荆豆凝集素)、和WGA(麦胚凝集素)均购自美国Sigma化学公司,LCA与α-D甘露糖特异性结合,PNA特异性结合α,β-半乳糖,WGA可与葡萄糖特异性识别,UEA则特异性识别岩藻糖,上述几种凝集素的工作液浓度均为50 μg/mL。
1.3 凝集素细胞化学
切片按常规二甲苯脱蜡,梯度乙醇重新增加水,再以蒸馏水冲洗,入0.1 mol/L pH 7.4 PBS(内含1%牛血清白蛋白和 0.3%Triton X-100)洗 5 min×3,后转入 PBSC(0.1 mol/L pH 7.2 的 PBS,含 0.1 mmol/L Ca-Cl2、MgCl2和MnCl2)20 min。除去多余液体后用微量注射器加上50 μg/mL FITC-凝集素(用PBSC稀释),放在潮湿容器内,37℃避光孵育0.5 h。PBS洗5 min×3,除去未被结合的标记凝集素,荧光显微镜观察(Olympus荧光显微镜,激发波长490 nm,发射波长520 nm),照相。另有部分切片做HE染色以进行结构对照。
1.4 结果判定
荧光显微镜下仔细观察整个切片的染色情况,根据组织染色强度不同分为阴性(-)、弱阳性(+)、阳性(++)、强阳性 (+++)。
2 结果
2.1 紫贻贝卵细胞分布特征及凝集素标记
贻贝卵巢是由薄层肌肉和结缔组织将之分割成一个个小区或称分枝的管状结构,管壁由复层上皮和非细胞结构的基膜构成,生殖上皮不断向腔内产生卵原细胞,再由之经初、次级卵母细胞、最终发育为成熟的卵子。当卵巢发育至成熟期时,管腔内充满成熟卵子,由于互相挤压而表现为不规则的形状,在随之而来的排放期中,腔内的成熟卵子明显减少,多表现为圆形或椭圆形。实验中所观察到的紫贻贝卵细胞正处于该期,其糖分布及含量如表1和图版1所示。在滤泡间隔区和细胞核区,甘露糖、半乳糖、岩藻糖、葡萄糖都没有分布,这4种糖在卵细胞边缘的标记特征亦不明显,只是半乳糖和葡萄糖在一些卵细胞边缘有区域性分布;但在细胞质区,这4种糖均有少量分布。
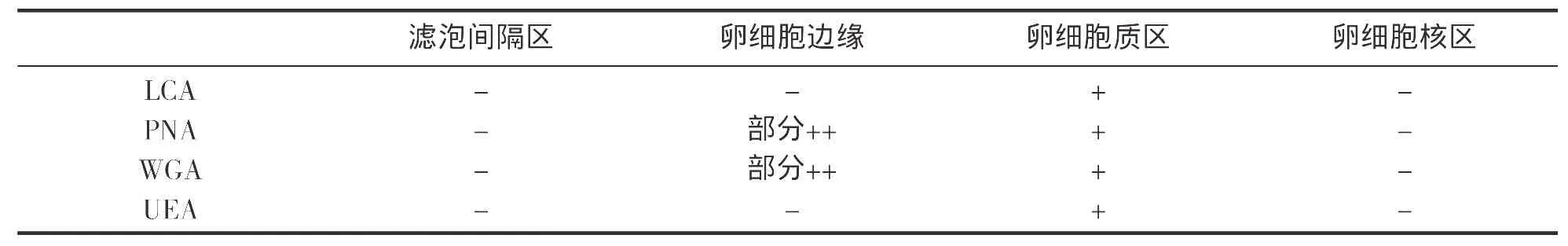
表1 紫贻贝卵细胞荧光凝集素标记强度Tab.1 Reaction of FITC-labeled lectin on eggs of Mytilus edulis
2.2 紫贻贝精子分布特征及凝集素标记
紫贻贝的精巢是由无数的生殖小管缠绕在一起构成的,各小管间由薄层肌肉和少量结缔组织隔开。到了生殖高峰期,输精小管内充满精子,仅在输精小管边缘有少量的精原细胞、精母细胞、精细胞按照由外向内逐级呈辐射状排列。精原细胞大,圆形或卵圆形,核大,形状与细胞一致;初级精母细胞小于精原细胞,圆形,核圆形;次级精母细胞小于初级精母细胞,圆形,数量比初级精母细胞多,核圆形;精细胞小,圆形,核大多呈半月形;精子最小,三角形,集中于生精小管腔中央,悬浮于精液中。
半乳糖和岩藻糖在紫贻贝的精巢的精细胞和成熟精子区为较均匀的弱阳性标记,根据甘露糖和葡萄糖在贻贝精巢中的分布状况,可将其分为4个区域(图版Ⅱ):输精小管间隔区、输精小管边缘、精母细胞区、精子区,甘露糖仅在输精小管边缘有分布;葡萄糖的含量相对较多,但也只是在输精小管边缘以及成熟精子区有一定的标记。
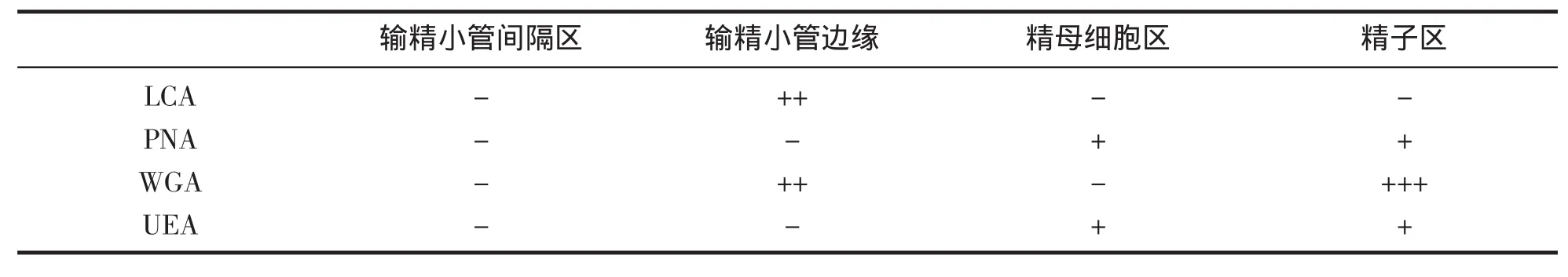
表2 贻贝精子细胞荧光凝集素标记强度Tab.2 Reaction of FITC-labeled lectin on sperms of M.edulis
3 讨论
3.1 糖在紫贻贝卵细胞的分布
前人[3]通过观察卵的超微结构发现,大多未受精的动物卵细胞由糖蛋白外被或卵黄膜包围着,贝类也不例外,鲍的卵细胞由一层隆起的、约6 μm厚的卵黄膜包被,该层卵黄膜由很多糖蛋白纤丝紧密缠绕构成[4]。本研究证实,甘露糖、岩藻糖在贻贝卵膜区无明显标记,半乳糖和葡萄糖在一些卵细胞边缘有区域性分布,说明不同糖在卵细胞膜上的分布和含量存在变化,而这些变化直接影响着卵细胞膜上糖蛋白中糖的组成和结构,可能造成不同品种贻贝卵细胞上配子识别物的差异,进而决定其配子之间的特异性识别。
紫贻贝卵细胞质中4种凝集素均表现为弱阳性标记,说明卵细胞中含有甘露糖、半乳糖、岩藻糖、葡萄糖等糖基,还可能存在若干我们未检测到的其他种类的糖。这些糖在细胞质中以何种方式存在还未知。人们通过研究锯缘青蟹Scylla serrata[5]、中华绒螯蟹Eriocheir sinensis[6]、罗氏沼虾Macrobrachium rosenbergii[7]、中国鲎 Tachpleus tridentatus[8]、缢蛏 Sinonovacula constricta[9]、栉孔扇贝 Chlamys(Azumapecten)farreri[10]、太平洋牡蛎Olympia oysters[11]、文蛤Meretrix meretrix、微黄镰玉螺Lunatia gilva[12]等无脊椎动物的卵细胞超微结构及卵黄形成过程发现,卵黄的形成与细胞核、线粒体、高尔基体、内质网及核糖体等细胞器密切相关,其中粗面内质网是卵黄粒形成的主要场所,并且粗面和滑面内质网又与糖类的合成有关,因此来源于内质网的卵黄颗粒中往往含有一定的糖类物质;高尔基体具有合成糖蛋白的功能,所以经过高尔基体酿造、加工而形成的卵黄粒中含有糖蛋白。本实验中贻贝的卵细胞质中,4种糖均有弱阳性标记,可能就是那些来自于内质网和高尔基体的卵黄颗粒通过其中糖蛋白与荧光标记凝集素结合而表现出来的。另外,罗氏沼虾的卵细胞在卵黄形成后期,仍能见到高尔基体通过它的细小管道向已形成的卵黄粒输送它的合成产物[6],栉孔扇贝卵细胞成熟过程中,细胞质中的糖成分不断增多[13]。本研究中的4种糖在紫贻贝细胞质中广泛存在,这些糖类可能存在于卵细胞质中的卵黄颗粒中,其存在形式不只是糖蛋白,也可能还包括多糖类物质。
3.2 精子中糖的分布
精子中的配子识别物位于顶体中,VACQUIER等[14]曾对鲍精子识别蛋白进行研究发现,决定生殖隔离的识别蛋白(lysin和sp18)就位于成体鲍的发达顶体泡中。本研究中半乳糖和岩藻糖在紫贻贝精巢的精细胞和成熟精子区为较均匀的弱阳性标记,甘露糖仅在输精小管边缘有分布;葡萄糖的含量相对较多,但也只是在输精小管边缘以及成熟精子区有一定的标记,该结果说明,贻贝精子形成过程中,不同糖类物质的产生的先后顺序有所差别,起到识别作用的糖蛋白的组成和分布也可能不同。该结论与前人研究哺乳动物[15]及昆虫[16]精子得到的糖蛋白分布具有变化性特征的结论相似。
成熟精子中糖主要存在于精子的顶体部分,顶体是由前顶体颗粒逐渐发育形成的,前顶体颗粒出现的时期在不同贝类中有差异,合浦珠母贝Pinctada fucata在初级精母细胞期形成,而企鹅珍珠贝Pteria penguin则在次级精母细胞和精子细胞时期形成[17],栉孔扇贝前顶体颗粒在次级精母细胞初期开始形成,在精子细胞变态的早期是一个继续和增强的过程[18]。紫贻贝的精子发生过程中,葡萄糖基的分布变化特征最为明显,但这种糖类物质是在精细胞发育阶段的哪一期产生,是在前顶体颗粒形成时已经存在,在顶体发育过程中包装到顶体泡中,还是随着顶体的形成而逐步合成的,需要用电镜的方法进一步确定。另外,许多研究者借助能与糖专一性结合的凝集素对各种哺乳动物精子表面糖复合物进行研究表明,精子表面的糖复合物出现与睾丸内的发生阶段,在附睾内的成熟过程中发生明显的修饰,而体外或体内获能时仍有某种程度的改变。贻贝和哺乳动物的这种变化特征除了与种的特异性有关以外,还可能与其生理功能的发挥密切相关。
细胞表面糖蛋白中糖的特性对于细胞的相互识别起着重要作用,无论是实验条件下使配子细胞表面的糖残基缺失,还是由于自身免疫病使精子表面糖基被掩盖均可导致精卵不能结合,这表明配子细胞表面糖蛋白的糖组分是精卵结合所必需的。精卵识别是精子头部表面糖蛋白的糖残基与卵细胞表面糖蛋白的糖残基互补配对的过程,即互补的结合位点匹配的过程,这是保证配子种间特异性结合的分子基础。本研究证实在紫贻贝精巢和卵巢分布区不同程度含有甘露糖、半乳糖、葡萄糖、岩藻糖,糖种类和数量的差异体现了配子细胞表面糖基的组成的差别,决定了同种生物配子间识别的特异性。邓泽沛等[15]研究指出,麦胚凝集素(WGA)结合糖复合物是精卵结合所必需的,是否其他几种凝集素所结合的糖复合物也在精卵识别及结合中也发挥必不可少的作用,以及在低等贝类中,这些凝集素受体是否也具有该特征,还需要进一步验证。
[1]HEIKO S,KATRIN M,SASCHA P,et al.Detection and Characterization of Gamete-Specific Molecules in Mytilus edulis Using Selective Antibody Production[J].Molecular Reproduction&Development,2009,76:4-10.
[2]CAREN E B,GEORGE N S.Ecological gradients and relative abundance of native(Mytilus trossulus)and invasive(Mytilus galloprovincialis)blue mussels in the Californiahybrid zone[J].Marine Biology,2006,148:1 249-1 262.
[3]MOZINGO N M,VACQUIER V D,CHANDLER D E.Structural features of the abalone egg extracellar matrix and its role in gamete interaction during fertilization[J].Mol Rep And Devel,1995,41:493-502.
[4]SWANSON W J,VACQUIER V D.The abalone egg vitelline envolope receptor for sperm lysin is a giant multivalent molecule[J].Proc Natl Acad Sci,1997,94:6 724-6 729.
[5]成永旭,李少菁,王桂忠,等.锯缘青蟹卵黄发生期卵母细胞和卵泡细胞之间的结构变化[J].动物学报,2002,48(1):80-92.
[6]堵南山,赖 伟,陈鹏程,等.中华绒螯蟹卵黄形成的研究[J].动物学报,1999,45(1):88-92.
[7]姜乃澄,卢建平,袁保京.罗氏沼虾初级卵母细胞在卵黄形成期超微结构的变化[J].东海海洋,2001,19(1):35-43.
[8]夏传武,洪水根,虢华珊.中国鲎卵黄发生的电子显微镜研究[J].华中师范大学学报:自然科学版,1998,32(2):215-218.
[9]上官步敏,刘正琮.缢蛏卵母细胞卵黄发生过程的超微结构研究[J].海洋与湖沼,1995,26(1):48-52.
[10]刘德模,洪水根.栉孔扇贝卵母细胞卵黄发生的研究[J].厦门大学学报:自然科学版,1996,35(3):412-416.
[11]任素莲,王德秀,王如才.太平洋牡蛎卵母细胞发育及卵黄发生的超微结构[J].中国水产科学,1999,6(4):2-5.
[12]应雪萍,杨万喜.微黄镰玉螺卵黄发生过程中细胞器的变化[J].浙江大学学报:理学版,2003,30(7):204-209.
[13]刘卫东.栉孔扇贝卵发生的超微结构和细胞化学[J].应用与环境生物学报,1999,5(6):593-597.
[14]VACQUIER V D.Evolution of gamete recognition protein[J].Science,1998,281:1 995-1 998.
[15]邓泽沛,周占祥,孙秀华,等.小鼠精子表面SBA结合糖复合物的形成与变化[J].中国组织化学与细胞化学杂志,1997,6(1):67-72.
[16]奚耕思,杨月红,郑哲民.蟋蟀精子表面LCA及ConA结合糖复合物的分布变化[J].动物学报,2002,48(1):125-130.
[17]杜晓东.3种珍珠贝精子发生及其超微结构的比较研究[J].武汉大学学报:自然科学版,1996,42(2):219-224.
[18]任素莲,王德秀,绳秀珍.栉孔扇贝精子形成中的核变化与顶体形成[J].青岛海洋大学学报,1999,29(4):591-594.
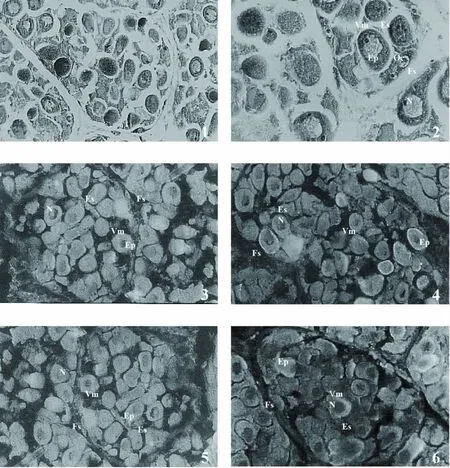
图版Ⅰ 紫贻贝卵巢组织结构及糖分布PlateⅠ Histological structure and carbohydrate distribution of ovary in Mytilus edulis
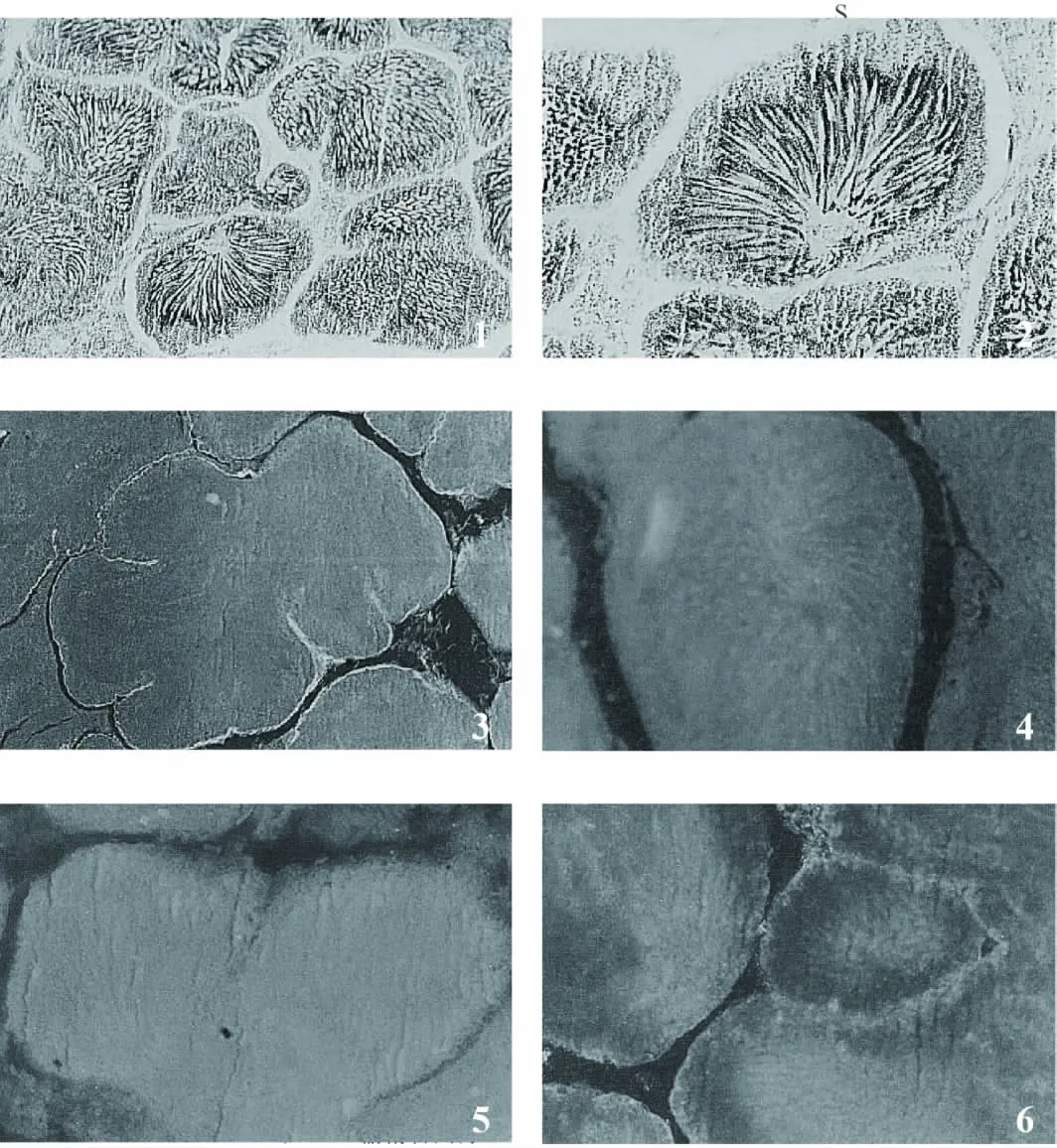
图版Ⅱ 紫贻贝精巢组织结构及糖分布PlateⅡ Histological structure and carbohydrate distribution of spermary in M.edulis

