内含肽介导的绿色荧光蛋白纯化
赵仲麟,顿文涛,李 燕,金显春,杨国玉,苏同福,袁 超
(1.河南农业大学理学院,河南 郑州 450002;2.河南农业大学信息化管理处,河南 郑州 450002;3.郑州轻工业学院食品与生物工程学院,河南 郑州 450002)
以蛋白质结构和功能为基础,从分子水平上认识生命现象已经成为现代生物学发展的主要方向.研究蛋白质首先要得到高度纯化并具有生物活性的蛋白质,常用于纯化蛋白质的传统方法有凝胶过滤和离子交换等,但是这些方法要求操作人员有较为丰富的经验.亲和层析也是一种常用的蛋白纯化方法,利用共价连接有特异配体的层析介质分离蛋白质,具有高效、快速、简便等优点,缺点是亲和标签可能对目的蛋白产生影响,常需要使用蛋白酶除去亲和标签,而蛋白酶处理有时非特异,且效率较低,同时也将增加蛋白纯化的步骤.内含肽(intein)是类似内含子的蛋白质等价物,通过翻译后蛋白剪接过程催化其自身从宿主蛋白上脱离[1,2].由内含肽介导的蛋白质剪接原理发展出多种新技术已用于蛋白质工程和化学生物学研究中[3~5].内含肽介导的蛋白质纯化方法可通过亲和层析的方法得到无亲和标签的蛋白,剪切能够在不使用蛋白酶的情况下切断肽键.CHONG等[6]利用酿酒酵母 Sce VMA内含肽进行了蛋白纯化.目的蛋白被融合在内含肽的N端,内含肽的C端连接到环状芽胞杆菌的几丁质结合域(CBD)的亲和尾上,硫醇诱导内含肽N端的肽键的断裂,从固定在柱上的融合蛋白上释放目的蛋白.ZHAO等[7]利用双内含肽的方法对绿色荧光蛋白进行了纯化.内含肽蛋白纯化系统的优点在于该方法简单、高效,可得到无载体来源氨基酸的蛋白质,分离蛋白质不需要使用昂贵的蛋白酶切除亲和标签.本研究利用来源于蓝绿藻Synechocystis sp.PCC6803的DnaB内含肽的剪切特性,纯化绿色荧光蛋白.
1 材料与方法
1.1 菌株与质粒
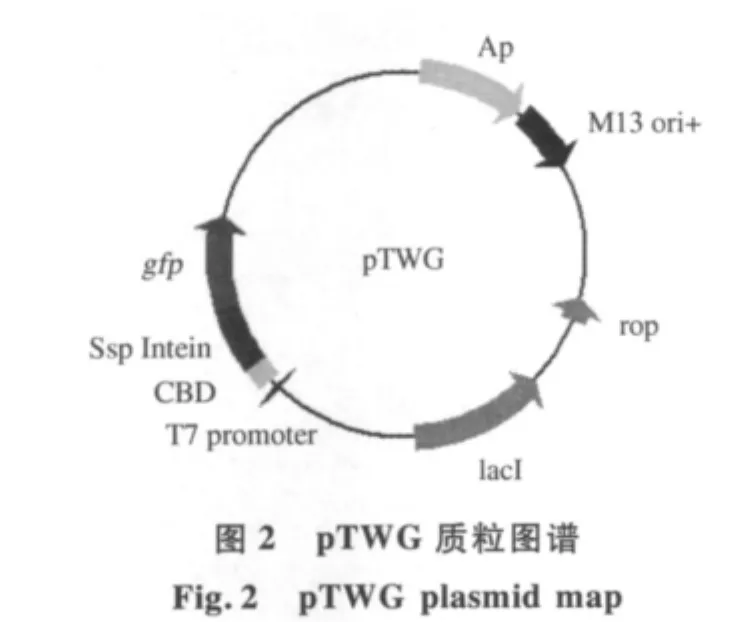
载体pTWIN1和大肠杆菌E.coli ER2566由NEB公司徐明群博士惠赠.
1.2 酶和试剂
限制性核酸内切酶、T4 DNA连接酶、几丁质树脂均购于NEB(北京)公司;高保真DNA聚合酶购自全式金公司;其它试剂均为分析纯.
1.3 绿色荧光蛋白基因(gfp)的克隆
根据gfp基因序列设计引物,分别加入位点EcoR I和Xho I(下划线部分).引物由上海生物工程有限公司合成,分别为:gfpF:5’-CCAGAATTCAT GCGTAAAGGAGAAGAAC-3’,gfpR:5’-CCACTCGA GTCATTTGTATAGTTCATC-3’.以含 gfp基因的质粒pG6th为模板,PCR扩增出全长的绿色荧光蛋白基因.PCR参数为:94℃预变性5 min,94℃变性30 s,58 ℃ 退火30 s,72 ℃延伸 50 s,共 30 个循环,最后72℃补充延伸10 min.
1.4 重组质粒的构建与转化
将PCR产物经琼脂凝胶电泳纯化回收,用EcoR I和Xho I双酶切,同时使用相同内切酶对质粒pTWIN1酶切.用T4 DNA连接酶将酶切后的pTWIN1和gfp于4℃连接过夜.将连接产物转化大肠杆菌 ER2566,涂布在含100 mg·L-1的氨苄霉素抗性的LB平板上,37℃培养12 h,得到含重组质粒pTWG的大肠杆菌.
1.5 绿色荧光蛋白的表达与纯化
将含重组质粒pTWG的大肠杆菌转化子接种于LB 液体培养基,37 ℃,200 r·min-1过夜培养后,按1%接种量转接入100 mL LB培养基中,37℃培养至 OD600为0.6,加入 IPTG使终浓度达到0.3 mmol·L-1,15 ℃培养16 h.离心收集菌体,用10 mL 缓冲液 B1(20 mmol·L-1Tris-HCl,pH 7.0,0.5 mol·L-1NaCl,1 mmol·L-1EDTA)将菌体重悬,超声波破碎细胞,后19 000×g离心30 min,上清液即为澄清的细胞粗提物.
将3 mL几丁质树脂倒入柱中,30 mL B1缓冲液(pH 7.0),4℃进行柱平衡.将澄清的细胞粗提物缓慢加入几丁质柱,流速约为1.0 mL·min-1.用50 mL的缓冲液彻底洗柱,流速为3 mL·min-1.停止柱流后,pH 7.0 条件下,20 ℃ 放置 12 h,后用10 mL B1缓冲液洗脱目的蛋白,SDS-PAGE电泳检测.
1.6 激光共聚焦影像试验
从含pTWG质粒的大肠杆菌2566平板上挑取单菌落,接种到5 mL LB液体培养基(含氨苄100 mg·L-1),加入 IPTG,15 ℃诱导培养 16 h后,5 000×g离心5 min,收集细胞,弃上清液.用无菌水洗菌体3次,取10 μL至于载玻片上,100倍油镜镜检,使用德国Leica TCS SP2激光共聚焦扫描显微镜观察,激发波长为488 nm.
2 结果与分析
2.1 绿色荧光蛋白基因的克隆及表达载体构建
根据绿色荧光蛋白gfp基因序列设计引物,PCR扩增出1条长度约为720 bp的条带(图1),经测序验证表明基因无突变.

图1 gfp基因PCR扩增结果Fig.1 PCR result of gfp gene
将PCR产物与酶切后的pTWIN1载体连接后,转入大肠杆菌ER2566感受态细胞.通过氨苄霉素抗性筛选转化子,经PCR验证表明已成功将gfp基因连接到表达载体上,产生载体命名为pTWG(图2).其中Ssp DnaB内含肽融合于gfp基因的N端,几丁质亲和域CBD融合于DnaB内含肽的N端,作为亲和纯化标签.
2.2 蛋白诱导表达及纯化
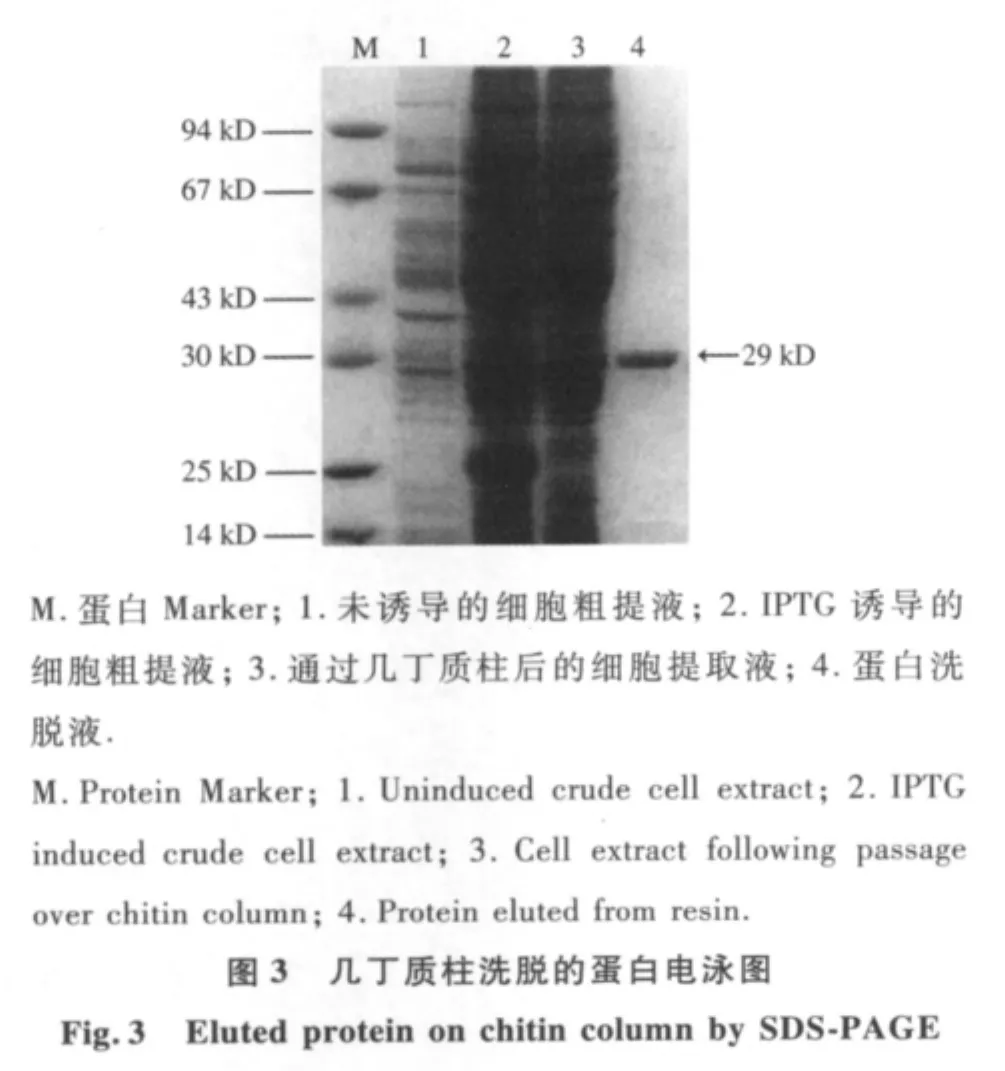
本研究使用0.3 mmol·L-1的 IPTG诱导蛋白表达.细胞粗提液通过亲和层析柱时,内含肽-绿色荧光蛋白融合体结合于几丁质树脂柱上.之后于20℃,pH 7.0条件下放置12 h诱导内含肽的自剪切活性,将绿色荧光蛋白从融合前体上脱离,后用缓冲液B1洗脱目的蛋白.SDS-PAGE电泳检测结果只出现1个条带,大小约29 kD(图3),符合绿色荧光蛋白的理论分子量,结果表明纯化得到的绿色荧光蛋白具有正确的大小,且具有较高的纯度.
2.3 菌体激光共聚焦扫描结果
绿色荧光蛋白较适合在低温下、长时间诱导其表达[8],因此本研究中采用15℃诱导16 h,取得了较好的表达效果.表达有绿色荧光蛋白的E.coli ER2566在488 nm激发下,菌体呈现明亮的绿色荧光.从菌体在明场中的光学影像(图4-A)和荧光扫描图像(图4-B)可见,所有大肠杆菌中均有绿色荧光蛋白表达,表明绿色荧光蛋白经内含肽介导的纯化后具有正确的功能和良好的活性,可作为细胞的分子影像标记.
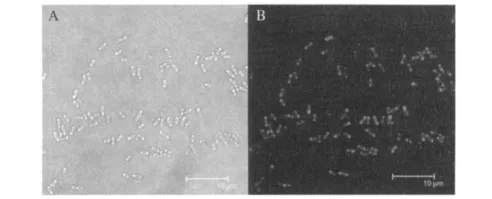
图4 含绿色荧光蛋白表达的E.coli ER2566共聚焦显微镜图像Fig.4 Confocal image of E .coli ER2566 strains with GFP expression
3 结语
1)本研究利用内含肽介导的蛋白质剪切反应纯化绿色荧光蛋白.在细胞生物学与分子生物学领域中,绿色萤光蛋白经常作为生物探针,是一种重要的标记基因.其稳定性好,颜色可见,易于检测.基于以上的优点,本研究使用绿色荧光蛋白作为纯化的目的蛋白.内含肽催化的蛋白转剪接反应具有高效、反应条件温和等特点,在离体和活体条件下均能进行蛋白质的剪接反应.
2)Ssp DnaB内含肽的剪切与温度和pH值有很大关系.在pH 7.0,温度16~23℃有较好的剪切活性.本研究利用单步反应,采用20℃,pH 7.0条件下,诱导内含肽自剪切活性的发生,从而纯化目的蛋白.纯化过程中无需添加任何其他试剂,系统中的作为亲和标签的几丁质结合域仍留在亲和柱上,得到的目的蛋白无亲和标签,减少了亲和标签对于蛋白质的影响.
[1]PERLER F B.Protein splicing of inteins and hedgehog autoproteolysis:structure,function,and evolution[J].Cell,1998,92(1):1 -4.
[2]PAULUS H.Protein splicing and related forms of protein autoprocessing[J].Annu Rev Biochem,2000,69:447-496.
[3]顿宝庆,陆 伟,赵仲麟,等.荧光假单胞菌G2-EPSP合酶的拆分和intein介导的活性恢复[J].科学通报,2006,52(12):1479 -1481.
[4]赵仲麟,马 鑫,林 敏,等.内含肽介导的蛋白质环化进展[J].中国农业科技导报,2009,11(3):19-24.
[5]任元涛,方宏清,周长林,等.蛋白质剪接研究进展[J]. 生物技术通讯,2010,21(4):575 -580.
[6]CHONG S R,COMB D G,SCOTT M E,et al.Singlecolumn purification of free recombinant proteins using a self-cleavable affinity tag derived from a protein splicing element[J].Gene,1997,192(2):271 -281.
[7]ZHAO Z L,LU W,DUN B Q,et al.Purification of green fluorescent protein using a two-intein system[J].Appl Microbiol Biotechnol,2008,77(5):1175 -1180.
[8]ZHAO Z L,MA X,LI L,et al.Protein cyclization enhanced thermostability and exopeptidase-resistance of green fluorescent protein[J].Journal of Microbiology and Biotechnology,2009,20:460-466.

