子痫前期患者外周血淋巴细胞CD28/CTLA-4的表达水平及意义
王莲莲,罗娜,曹霞
(中国医科大学附属第四医院产科,辽宁沈阳 110032)
妊娠期高血压疾病是妊娠所特有的疾病,子痫前期是其一种发展阶段,其病因不明,至今仍是围产医学研究的重点。近年来其免疫病因学的研究成为热点,目前认为,母胎免疫耐受失衡是子痫前期发病的中心环节之一。其中Th1/Th2失衡现象已得到证实,但Th1/Th2失衡原因仍是不解之谜。因协同刺激分子白细胞分化抗原28(CD28)/细胞毒性T淋巴细胞相关抗原(CTLA-4)是T细胞活化的重要调节因子[1],也影响T淋巴细胞的增殖。本研究拟通过检测外周血淋巴细胞中CD28/CTLA-4的表达,探讨其在子痫前期发病机制中的作用。
1 对象与方法
1.1 检测对象
为中国医科大学附属第四医院产科2009年10月至2010年11月产科病房住院患者,共65例。35例子痫前期患者年龄(31.35 ±2.20)岁,孕(35.80 ±1.60)周,平均血压(150.5 ±15.5)/(96.5 ±4.5)mmHg(1 mmHg=0.133 kPa);30例正常晚期妊娠孕妇年龄(30.20 ±2.50)岁,孕(37.50 ± 2.60)周,平均血压(120.5 ±8.2)/(70.5 ±10.5)mmHg。诊断标准具体参照文献[2],且所有对象均为剖宫产,均无高血压、糖尿病、甲亢等病史,无其他妊娠合并症,无传染病病史。两组间年龄、孕周差异均无统计学意义。
1.2 方法
1.2.1 主要试剂及仪器 FITC标记的抗人CD28单克隆抗体、PE标记的抗人CTLA-4单克隆抗体及PE标记的抗人CD3单克隆抗体为美国Biolegend公司产品;人淋巴细胞分离液购自中国医学科学院。主要仪器:FACSCalibur流式细胞仪;离心机。
1.2.2 血液标本的采集及制备方法 采集各组孕妇空腹肘正中静脉血1 ml,肝素抗凝,分离淋巴细胞后,调整细胞浓度为1×106ml-1。取100 μl加入 CD3荧光抗体20 μl,4 ℃ 避光静置 30 min,加细胞染色液2 ml洗涤,离心 5 min,弃上清,加固定/透膜剂 1 ml,4℃避光静置30 min,加破膜剂2 ml,离心5 min,弃上清;加抗人CD28,上机分析;加抗人CTLA-4单克隆抗体,上机分析。结果以各自所占CD3+T细胞的比例表示。
1.3 统计学处理
实验数据用SPSS 11.0统计软件分析,定量数据采用t检验,检验数据用±s表示,P<0.05表示差异有统计学意义。
2 结 果
实验组子痫前期患者外周血淋巴细胞CD28表达水平与对照组的相比,差异无统计学意义(P>0.05);实验组外周血淋巴细胞CTLA-4表达水平显著高于对照组,差异有统计学意义(P<0.05);实验组子痫前期患者外周血淋巴细胞CD28/CTLA-4的值显著低于对照组的值,差异有统计学意义(P<0.05)。见表1。
表1 外周血 CD28、CTLA-4表达水平及 CD28/CTLA-4的值±s)
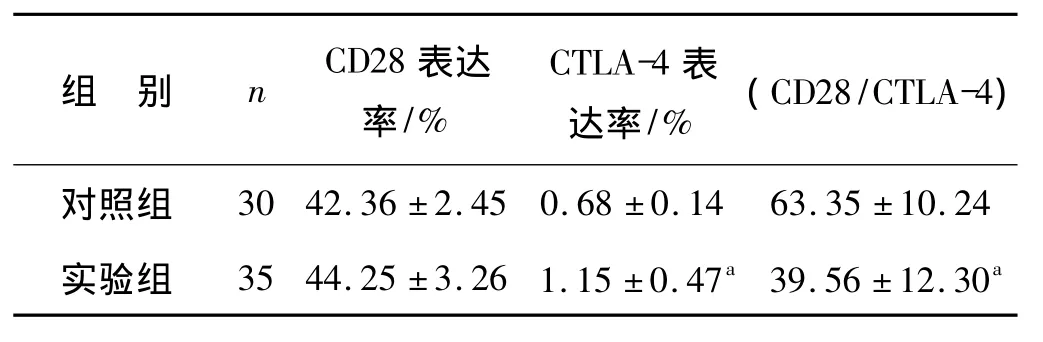
表1 外周血 CD28、CTLA-4表达水平及 CD28/CTLA-4的值±s)
与正常对照组相比,a P<0.05
组 别 n CD28表达率/%CTLA-4表达率/% (CD28/CTLA-4)30 42.36 ±2.45 0.68 ±0.14 63.35 ±10.24实验组 35 44.25 ±3.26 1.15 ±0.47a39.56 ±12.30对照组a
3 讨 论
妊娠是一种成功的同种异体移植,胎儿携带父方基因却不被母体排斥而直至足月,提示母体与胎儿之间存在特殊的免疫关系。一旦这种免疫关系失调就可能引起免疫排斥反应,可能导致病理妊娠的发生。子痫前期作为妊娠晚期的一种原因不明的特殊疾病严重影响着母婴健康,大量的研究表明,子痫前期的发生与免疫系统失衡存在着密切的关系[3]。CD3代表总淋巴细胞,根据其表面标记不同分为一些亚群,如辅助性淋巴细胞(Th)和抑制性淋巴细胞(Ts)等。各淋巴细胞亚群之间相互制约、相互协调处于平衡状态,一旦平衡打破,导致各种免疫损伤和疾病[4]。成人外周血T淋巴细胞群保持着相对恒定的数量,但个体数量增减取决于协同刺激分子传递的信号,其在维持免疫系统平衡方面起重要作用[5]。
正常妊娠需要母体对胚胎产生免疫耐受,其对妊娠的取向起着非常重要的作用,但其机制尚不完全明确。其中,“Th1/Th2型细胞因子平衡”学说占有重要地位。未致敏Th细胞或称前身Th细胞,接受抗原刺激后先分化成Th0细胞。在微环境中各种因素影响下,Th0细胞进一步向Th1或Th2分化这一过程又称Th1/Th2极化。Th1型免疫反应表现为免疫损伤,Th2型免疫反应表现为免疫保护或免疫营养作用[6]。正常妊娠时母体对胎儿抗原的免疫反应以免疫保护为主,排斥反应减低,趋向Th2型反应;而在子痫前期中母体对胎儿的排斥反应增强,趋向于Th1型反应,母胎免疫耐受失衡,导致发病[7]。
CD28/CTLA-4是重要的协同刺激分子。CD28是至今公认的最基本的协同刺激信号,改变刺激分子的表达可以调控免疫的强度和方向[8]。CTLA-4只表达于活化的T细胞上,是一种抑制性受体。CTLA-4通过同CD28竞争性结合受体传递信号,来抑制T细胞的活化。两者的差异性表达才能保证正、负向信号共同参与某一过程,有着互补的调节作用。有动物实验[9]证实,CTLA-4被封闭或缺乏导致T细胞向Th2亚群分化。本组35例子痫前期患者外周血中淋巴细胞CD28、CTLA-4的表达水平及CD28/CTLA-4值检测结果表明,实验组CD28/CTLA-4的值显著低于对照组,而负性调节因子CTLA-4的表达增加,T细胞的过度活化,使Th2的极化受抑制,促进T细胞向Th1亚群极化。Th1/Th2失衡,Th0向Th1偏移,母体对胎儿的排斥反应增强,在妊娠晚期可能导致子痫前期的发生。总之,CD28/CTLA-4作为协同刺激因子,其异常表达与免疫功能紊乱、T细胞异常活化具有相关性,在子痫前期发病中起着重要的作用,可作为判断其免疫学病因、评价免疫治疗疗效及预后的重要参照指标。
[1]JIN L P,CHEN Q Y,ZHANG T,et al.The CD4(+)CD25(bright)regulatory T cells and CTLA-4 expression in periph and decidual lymphocytes are down-regulated in human iscarriage[J].Clin Immunol,2009,133(3):402-410.
[2]乐杰,谢幸,林仲秋,等.妇产科学[M].7版.北京:人民卫生出版社,2008:92-94.
[3] DAMOCHWAI K D,SAITO S,ROLINSKI J.Activated T lymphocytes in preeclampsia[J].Am J Reprod Immunol,2007,58(1):39.
[4]张建军.妊娠中晚期外周血淋巴细胞亚群和细胞的观察[J].现代妇产科进展,2002,11(2):125-130.
[5]曹霞,王莲莲,梁杰.子痫前期孕妇外周血调节性T细胞差异表达的临床意义[J].东南大学学报:医学版,2010,29(6):621-622.
[6]魏军,刘岿然,隋丽红,等.子痫前期患者外周血单核细胞分泌Th1、Th2型细胞因子功能变化研究[J].中国现代医学杂志,2005,15(16):2415-2416.
[7]DARMOCHWAL-KOLARZ D,ROLINSKI J,LESZCZYNSKA-GOARZELAK B,et al.The expressions of intracellular cytokines in the lymphocytes of preeclampsia patients[J].Am J Reprod Immunol,2002,48(1):381-386.
[8]OLIVE D.Lymphocyte coreceptors[J].Med Sci(Paris),2006,22(12):1069-1074.
[9]OOSTERWEHGEL M A,MANDELBTROT D A,BOYD S D,et al.The role of CTLA-4 in regulating Th2 differentiation[J].J Immunol,1999,163(5):26-34.
东南大学学报(医学版)2011年5期
