COPD 大鼠模型海马组织代谢研究
凌学锋,林勇,孙思庆,张蔷
(1.东南大学医学院,江苏南京 210009;2.东南大学附属中大医院呼吸科,江苏南京 210009)
近年来临床研究表明,慢性脑功能损害是慢性阻塞性肺疾病(COPD)的一种确切的并发症[1-2],临床症状主要表现为认知能力下降、抑郁症及焦虑症等,但具体发病机制尚不明确。另外吸烟作为COPD的主要病因,香烟中主要成分对中枢系统会产生一定损害,且可能是导致COPD并发慢性脑损害的危险因素[2]。本实验拟利用Bruker 7.0T Micro-MRI在活体状态下对COPD大鼠模型双侧海马进行质子磁共振波谱(1H-MRS)分析,检测组织代谢物质的相对浓度与变化,从组织代谢方面对COPD并发慢性脑损害可能的分子机制进行初步探索。
1 材料与方法
1.1 材料
健康SPF级SD大鼠24只,雌雄各半,鼠龄12周,体质量(220±25)g,购于上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2008-0016;脂多糖(LPS)及戊巴比妥钠购于美国Sigma公司;大前门香烟(烤烟型,焦油量12 mg,烟气一氧化碳14 mg)属于上海卷烟厂出品;异氟烷购于上海雅培制药公司。
1.2 动物分组与模型的建立
大鼠雌雄分笼饲养,在东南大学SPF级动物中心适应性饲养1周后,随机分成正常对照组、单纯脂多糖组、单纯吸烟组、COPD模型组,每组6只,雌雄各半。建模具体方法如下:采用宋一平等[3]用两次内毒素注射联合被动吸烟法复制COPD大鼠模型。模型建立周期28 d,模型组于实验第1、14天气管内注射200 μg·(200 μl)-1脂多糖,单纯吸烟组于实验第1、14天气管内注射生理盐水200 μl,第2 ~13、15 ~28 天上午两组均各置自制72 L密闭染毒箱内(烟雾体积分数约0.05)30 min;正常对照组于实验第1、14天气管内注射生理盐水200 μl,单纯脂多糖组于实验第1、14天气管内注射 200 μg·(200 μl)-1脂多糖,余无特殊处理。所有饲养条件相同,温度(22±3)℃,湿度为(55±5)%,日光灯光照时间12 h·d-1,自由饮水和摄食。
1.3 磁共振成像及氢质子波谱采集
磁共振成像及波谱采集在东南大学分子和功能影像中心进行,采用动物麻醉机吸入浓度为1.5% ~2.0%异氟烷维持麻醉大鼠,取俯卧位将头部固定在立体定向仪支架上,放置入孔径60 mm的双通道头部射频线圈,并行心率和呼吸监测。利用自旋回波序列(SE)完成T1加权像,快速采集弛豫增强成像序列(RARE)完成 T2加权成像,TR为 4 200 ms,TE为36 ms,扫描层厚0.8 mm,层间距 1.0 mm,视野3.5 cm ×3.5 cm,矩阵256×256。T2WI图像上确定感兴趣区(ROI)即双侧海马(图1),体积3 mm×3 mm×3 mm,避开颅骨和脑脊液等结构,1H-MRS采用点分辨自旋回波波谱(PRESS)序列,TR 为2 500 ms,TE 为20 ms,匀场和水抑制均由自动扫描程序完成,采样累加的平均次数为512次。
利用工作站TopSpin软件对所得自由衰减信号进行傅立叶转换,得到谱线后进行相位校正和基线修正,指定水峰化学位移为4.7 ppm,确定NAA(2.02 ppm)、Cr(3.0 ppm)及 Cho(3.22 ppm)等信号;测定 NAA、Cho和Cr波峰曲线下面积,Cr被作为波谱研究的参照物,分别计算NAA/Cr、Cho/Cr比值。
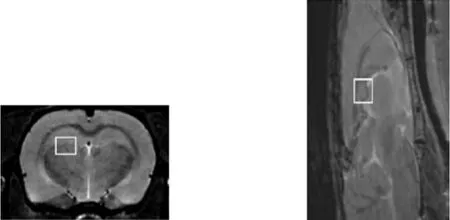
图1T2WI图像上海马定位(左:轴状位,右:矢状位)
1.4 大鼠呼吸力学指标测定
用0.4%戊巴比妥钠腹腔注射麻醉大鼠后仰卧固定于操作台,纵行切开颈部皮肤分离出气管和食管,在环状软骨下2个气管环处作一“T”形切口,行气管插管;在食管上部作一横行切口行食管插管,均用丝线打结固定。利用RMB6240系列多道生理信号采集处理分析系统,测定其潮气量、气道流速、跨肺压(用食管内压代替跨肺压),自动换算成肺阻力和肺动态顺应性:肺阻力(RL)=跨肺压/气道流速(cmH2O·ml-1·s-1,1 cmH2O=0.098 kPa),动态肺顺应性(Cdyn)=潮气量/跨肺压(ml·cmH2O-1)。
1.5 肺组织病理学检查
大鼠行呼吸力学指标检测完毕后,经腹主动脉放血处死,迅速剪开胸腔,分离肺组织,取右肺中叶置于10%中性福尔马林中固定,固定24 h以上脱水、石蜡包埋,切片机切片(厚约5 mm)行苏木精-伊红(HE)染色后光镜观察。
1.6 统计学处理
采用SPSS 16.0版本统计软件包分析处理,各组数据均行正态性检验,正态分布数据以±s表示;组间差异比较采用单因素方差分析,两两比较用q检验;组内左右两侧比较用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 病理切片光镜观察
正常对照组:可见支气管上皮纤毛丰富,排列整齐,在纤毛细胞间夹杂有少数杯状细胞,间质内有少数散在的淋巴细胞、巨噬细胞及中性粒细胞等炎症细胞浸润。单纯吸烟组:支气管上皮纤毛有脱落或缺失,细支气管及间质内有淋巴细胞、巨噬细胞和中性粒细胞等炎症细胞浸润,肺泡间隔增厚,局部肺泡萎陷。单纯脂多糖组:间质内有少数散在的淋巴细胞、巨噬细胞及中性粒细胞等炎症细胞浸润,部分肺泡扩张,肺泡间隔变窄、断裂。COPD模型组:支气管上皮纤毛有脱落或缺失,小支气管、细支气管及伴行的血管周围有不等的淋巴细胞、巨噬细胞和中性粒细胞等炎症细胞浸润。肺泡扩张,肺泡间隔变窄、断裂,扩张的肺泡并融合形成肺大疱。见图2。
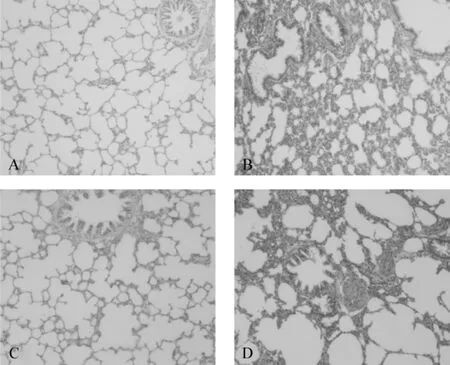
图2 4组病理切片光镜观察
2.2 呼吸力学指标测定结果
COPD模型组的肺阻力明显高于正常对照组和单纯吸烟组(P<0.05);COPD模型组的肺动态顺应性明显低于正常对照组、单纯吸烟组、单纯脂多糖组(P<0.05)。与正常对照组相比,单纯脂多糖组、单纯吸烟组的肺动态顺应性也减小(P<0.05),肺阻力无显著差异(P>0.05)。单纯吸烟组与单纯脂多糖组两组间肺阻力及肺动态顺应性无显著差异(P>0.05)(表1)。结果显示,COPD模型组的肺组织病理及呼吸力学指标变化符合人类 COPD病理生理特点,证实COPD模型复制成功。
表1 各组间大鼠肺阻力及肺顺应性比较±s)
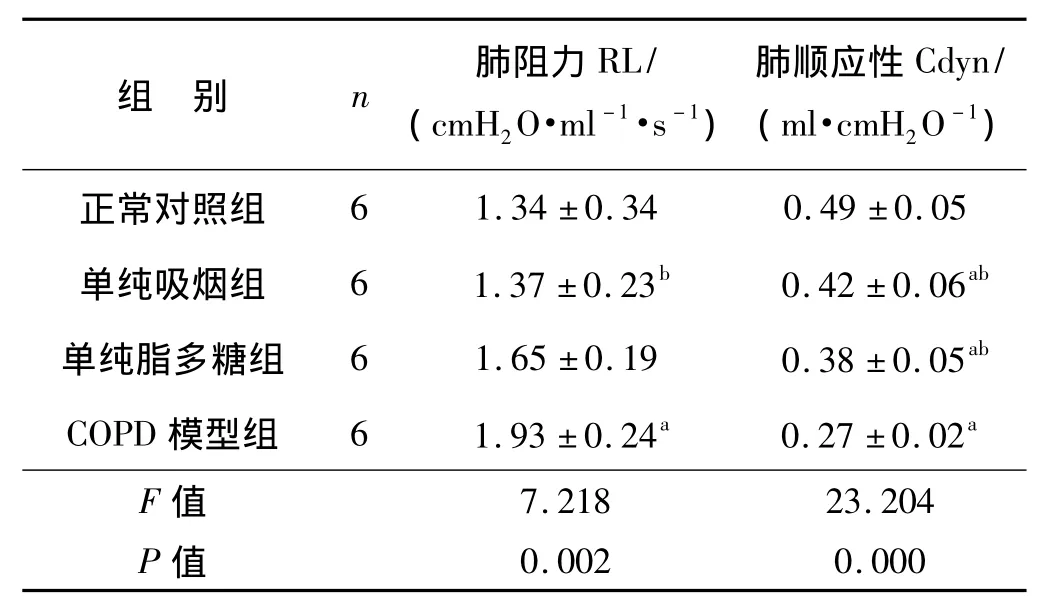
表1 各组间大鼠肺阻力及肺顺应性比较±s)
与正常对照组比较,a P<0.05;与COPD模型组比较,b P <0.05
组 别 n 肺阻力RL/(cmH2O·ml-1·s-1)肺顺应性Cdyn/(ml·cmH2O-1)6 1.34 ±0.34 0.49 ±0.05单纯吸烟组 6 1.37 ±0.23b 0.42 ±0.06ab单纯脂多糖组 6 1.65 ±0.19 0.38 ±0.05ab COPD 模型组 6 1.93 ±0.24a 0.27 ±0.02a F值正常对照组0.002 0.000 7.218 23.204 P值
2.3 各组大鼠双侧海马组织代谢测定结果
与正常组相比,COPD模型组双侧海马Cho/Cr比值显著减小(P<0.05)。单纯吸烟组、单纯脂多糖组左侧海马Cho/Cr值也较正常对照组减小,且差异有统计学意义(P<0.05),而右侧海马Cho/Cr值无显著差异(P>0.05)。单纯吸烟组、单纯脂多糖组、COPD模型组3组间双侧海马Cho/Cr值无显著差异(P>0.05);各组间双侧海马NAA/Cr值无显著差异(P>0.05)。各组内左右两侧NAA/Cr、Cho/Cr值无显著差异(P >0.05)。见表2。
表2 各组间双侧海马代谢物相对浓度的比较(±s)

表2 各组间双侧海马代谢物相对浓度的比较(±s)
与正常对照组比较,a P<0.05
组 别 n (NAA/Cr)(Cho/Cr)6 1.22 ±0.12 1.26 ±0.10 0.83 ±0.07 0.79 ±0.05单纯吸烟组 6 1.16 ±0.03 1.21 ±0.08 0.71 ±0.05a0.71 ±0.08单纯脂多糖组6 1.17 ±0.13 1.24 ±0.13 0.74 ±0.02a0.76 ±0.05 COPD 模型组 6 1.16 ±0.09 1.16 ±0.05 0.72 ±0.02a0.68 ±0.05a F值左侧海马 右侧海马正常对照组左侧海马 右侧海马0.528 1.465 8.334 4.110 P值0.668 0.254 0.001 0.020
3 讨 论
本研究通过被动吸烟联合气管滴注脂多糖双因素诱导法成功复制单纯的COPD大鼠模型,诱导因素贴近临床实际,并排除了多种可能干扰大脑组织代谢的临床上常见因素,如合并代谢性疾病和心血管疾病、年龄、药物治疗及氧疗等,同时并建立单诱导因素组观察各因素对脑代谢的可能影响。
1H-MRS是能在活体内评估局部组织代谢、生理生化改变的无创性检查技术,质子波谱兴趣区域法分析目前已广泛用于脑部疾病的研究。在本实验中选择的兴趣区域为双侧海马,主要考虑海马是边缘系统的重要组成部分,与丘脑前核群、下丘脑乳头丘脑束、扣带回等组成的环路是调节行为、学习和记忆、情绪反应的重要神经解剖基础。
NAA主要由神经元的线粒体产生,反映神经元的密度及完整性,其浓度降低是由于神经元破坏或线粒体功能失调所致,可作为判断神经元丢失和损伤的指标[4]。本实验研究结果显示,模型组与正常对照组间双侧海马NAA/Cr的值无显著差异,提示香烟及内毒素双因素诱导的COPD模型海马神经元可能尚未发生破坏或丢失。Sinha等[5-6]对COPD患者研究结论与我们结果相似。但与之相反,Shim等[7]研究却发现,有症状的COPD患者顶叶NAA含量较正常组明显减低。差异可能与所选择的兴趣区域不同有关,目前还没有明确COPD并发慢性脑损害的具体脑区。同时也可能由于各自采用的仪器设备、样本数量、有无合并症、是否药物治疗等因素不同导致结果的不一致。
Cho主要由甘油磷酸胆碱、磷酸胆碱、磷脂酰胆碱等组成,既是与记忆、情绪密切相关的神经递质乙酰胆碱的前体,也是神经包膜磷脂代谢的重要成分。本研究发现,COPD模型组双侧海马Cho/Cr的值较正常组明显降低。既往有研究[5,7]发现,COPD患者部分脑区Cho含量明显减低。这与我们的结果相似。Cho信号下降提示,细胞膜的合成更新变慢、细胞间的信号传递机制受损以及细胞的密度下降等[8]。此外,Cho信号下降亦可能与乙酰胆碱合成减少有关。Cho是与记忆、识别和情绪行为有关的重要神经递质乙酰胆碱的前体,同时海马区存在来自基底前脑胆碱能神经元的投射纤维,而胆碱能神经系统的破坏亦可损害中枢神经系统功能[9],从而影响记忆、认知和精神状态。Cho/Cr之值变化而NAA/Cr之值未见改变,可能表明神经胶质细胞在功能代谢方面出现异常,而后者能影响到多种神经递质变化,如γ-氨基丁胺、乙酰胆碱、谷胺酰胺等[10-11]。而且许多精神性疾病及神经退变性疾病在出现神经元丢失、认知功能减退、精神异常等明显的临床病理症状以前,大脑顶颞叶皮层和海马均已出现分子代谢及功能异常,是疾病发生发展重要的病理生理基础。结合以上研究及本研究,我们推测COPD大鼠模型在海马神经元丢失之前其细胞膜的结构组成、磷脂代谢、信号传递方面可能有功能异常改变。综上所述,COPD模型组双侧海马Cho/Cr之值降低提示,海马组织代谢异常可能是COPD并发慢性脑损害的早期病理基础之一。
此外,我们还发现,单纯吸烟组左侧海马组织Cho/Cr之值明显降低。以往研究[12-14]已证明,吸烟可以导致中枢组织代谢异常,且海马较易受尼古丁神经毒性损害并具有浓度依赖性特点。研究结果显示,吸烟可能是导致COPD并发慢性脑损害的危险因素之一。单纯脂多糖组左侧海马Cho/Cr值也较对照组明显降低。采用“二次打击法”构建肺损伤模型显示,能形成顽固性低氧状态[15]。喻林升等[16]发现,慢性低O2高CO2大鼠脑神经细胞发生变性、坏死及凋亡,以神经胶质细胞、海马神经细胞为著。文献[17-18]报道,大鼠腹腔或脑内注射脂多糖后,可诱导海马神经炎症、神经胶质细胞的免疫活化、神经元退化与凋亡。故是否与肺组织破坏后机体缺氧、气管滴入脂多糖引起神经炎症作用等多种综合因素有关,有待于深入研究。但有趣的是,单纯脂多糖组、单纯吸烟组右侧海马Cho/Cr的值与正常对照组无显著差异。既往研究也证实,一些神经精神性疾病的脑组织代谢异常存在不对称性,有偏向左半球现象[19-20]。
总之,COPD并发慢性脑损害的病理生理机制较为复杂,我们研究中仅选择双侧海马为兴趣区域发现组织代谢存在改变,其他脑区是否存在类似变化及代谢异常的机制与意义有待进一步研究。
[1]LIMA O M,OLIVEIRA-SOUZA R,SANTOS O R,et al.Subclinical encephalopathy in chronic obstructive pulmonary disease[J].Arq Neuropsiquiatr,2007,65(4B):1154-1157.
[2]DODD J W,GETOV S V,JONES P W.Cognitive function in COPD[J].Eur Respir J,2010,35(4):913-922.
[3]宋一平,崔德健,茅培英.慢性阻塞性肺疾病大鼠模型的建立及药物干预的影响[J].中华内科杂志,2000,39(8):56.
[4]SCHUFF N,CAPIZZANO A A,DU A T,et al.Different patterns of N-acetylaspartate loss in subcortical ischemic vascular dementia and AD[J].Neurology,2003,61(3):358-364.
[5]SINHA S,KUMAR V,JAGANNATHAN N R,et al.Proton magnetic resonance spectroscopy of brain to study the cerebral metabolic abnormalities in COPD patients:a case control study in north India[J].Indian J Chest Dis Allied Sci,2009,51(1):15-19.
[6]BORSON S,SCANLAN J,FRIEDMAN S,et al.Modeling the impact of COPD on the brain[J].Int J Chron Obstruct Pulmon Dis,2008,3(3):429-434.
[7]SHIM T S,LEE J H,KIM S Y,et al.Cerebral metabolic abnormalities in COPD patients detected by localized proton magnetic resonance spectroscopy[J].Chest,2001,120(5):1506-1513.
[8]DOWLING C,BOHEN A W,NOWOROLSKI S M,et al.Preoperative proton MR spectroscopic imaging ofbrain tumors:correlation with histopathologic analysis of resection specimens[J].Am J Neuroradiol,2001,22(4):604-612.
[9]WATSON G S,CRAFT S.Modulation of memory by insulin and glucose:neuropsychological observations in Alzheimer's disease[J].Eur J Pharmacol,2004,490(1-3):97-113.
[10]HAYDON P G.Glia:listening and talking to the synapse[J].Nat Rev Neurosci,2001,2(3):185-193.
[11]BRAMBILLA P,PEREZ J,BARALE F,et al.GABAergic dysfunction in mood disorders[J].Mol Psychiatry,2003,8(8):721-737.
[12]GALLINAT J,LANG U E,JACOBSEN L K,et al.Abnormal hippocampal neurochemistry in smokers:evidence from proton magnetic resonance spectroscopy at 3 T[J].J Clin Psychopharmacol,2007,27(1):80-84.
[13]DOMINO E F.Tobacco smoking and MRI/MRS brain abnormalities compared to nonsmokers[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(8):1778-1781.
[14] ABREU-VILLACA Y,SEIDLER F J,TATE C A,et al.Nicotine is a neurotoxin in the adolescent brain:critical periods,patterns of exposure,regional selectivity,and dose thresholds for macromolecular alterations[J].Brain Res,2003,979(1-2):114-128.
[15]李玉梅,卫洪昌,俞小宛,等.内毒素“二次打击”顽固性低氧血症大鼠ARDS模型建立与评价[J].中国病理生理杂志,2009,25(11):2235-2239.
[16]喻林升,张旭,高申孟.慢性低O2高CO2大鼠模型脑神经细胞凋亡及P53蛋白表达研究[J].中国神经免疫学和神经病学杂志,2002,9(3):178-179.
[17]陈正,张焰,谈大海.腹腔注射内毒素对老年大鼠记忆保持功能的损害[J].中国老年医学杂志,2010,30(8):1106-1108.
[18]ZARIFKAR A,CHOOPANI S,GHASEMI R,et al.Agmatine prevents LPS-induced spatial memory impairment and hippocampal apoptosis[J].Eur J Pharmacol,2010,634(1-3):84-88.
[19]FARCHIONE T R,MOORE G J,ROSENBERG D R.Proton magnetic resonance spectroscopic imaging in pediatric major depression[J].Biol Psychiatry,2002,52(2):86-92.
[20]HONG S T,CHOI C B,PARK C,et al.Specific hippocampal choline decrease in an animal model of depression[J].Br J Radiol,2009,82(979):549-553.
东南大学学报(医学版)2011年5期
