ERCC1、XRCC1单核苷酸多态性与非小细胞肺癌铂类药物化疗预后关系的研究
成红艳,陈宝安,孙新臣,邓雨霞,孙宁,曹远东
(1.东南大学附属中大医院 肿瘤科,江苏南京 210009;2.江苏省人民医院放疗科,江苏南京 2100068;3.江苏省肿瘤医院 肿瘤科,江苏南京 210006)
肺癌已经成为全球因癌症死亡的首要疾病。手术是早期非小细胞肺癌(NSCLC)的主要治疗手段,但术后的长期生存并不乐观,Ⅰa、Ⅰb、Ⅱa和Ⅱb期患者的5年生存率分别是70%、60%、55%和40%;当有同侧纵隔淋巴结转移时,5年生存率则降至13%。术后辅助化疗并未能明显改善患者的生存期,仅少部分患者从中获益[1]。含铂类药物的化学治疗仍是NSCLC,尤其是晚期NSCLC必不可少的治疗措施,如果能有生物标记来预测顺铂或卡铂的化疗效果,用于指导该类药物的个体化使用,不仅能提高疗效,还可避免毒副反应。为此,本研究采用一种新的基因芯片检测方法分析NSCLC患者 ERCC1(118)、XRCC1(399)位点的SNP,研究不同基因型与NSCLC铂类为主的方案化疗后生存期之间的关系,旨在为NSCLC铂类药物化疗后的生存期寻找预测指标提供依据。
1 资料与方法
1.1 一般资料
选择2006年5月至2007年12月收治的经病理组织学确诊的晚期NSCLC患者120例,男82例,女38例,年龄34~77岁,中位年龄58岁。患者来源于东南大学附属中大医院、南京军区南京总医院、江苏省肿瘤医院和南京胸科医院。120例中,腺癌73例,鳞癌47例。所有患者均经CT扫描证实具有可测量的肿瘤病灶。化疗前患者体力状况(KPS)评分均大于70分,血常规、血生化在正常范围内,心电图正常。入组的患者均给予以顺铂或卡铂为基础的两药联合方案化疗。21 d为1个周期,治疗2~3个周期后按照 RECIST(response evaluation criteria in solid tumor)标准进行疗效评价。有效病例可续用原方案,无效病例改用其它方案。当KPS评分<70分给予最佳支持治疗。生存时间指确诊ⅢB、Ⅳ期或复发转移开始至死亡或随访结束的时间。
1.2 方法
1.2.1 标本采集 所有患者均在化疗前抽取静脉血2 ml,柠檬酸或EDTA抗凝,常规酚-氯仿法提取基因组DNA。以基因芯片微阵列方法进行ERCC1(118)、XRCC1(399)位点的基因型分析。
1.2.2 目的片段的 PCR扩增 采用 Primer primer 5.0软件设计引物序列,ERCC1(118)位点引物序列为5'-AcryditeTM-GAGGTGCAAGAAGAGGTGGA-3'和5'-GCAGAGCTCACCTGAGGAAC-3'。XRCC1(399)位点引物序列为5'-ACCTAACTGGCATCTTCACTTCTG-3'和5'-AcryditeTM-CAGGTCCTCCTTCCCTCATCT-3'。PCR反应条件为:95℃预变性5 min后,于94℃ 40 s、60℃ 40 s和72℃ 45 s进行35个循环,最后72℃延伸5 min。PCR产物用95%的乙醇沉淀、干燥。
1.2.3 目的片段芯片的制备及杂交 将干燥的PCR产物用20 μl点样液溶解,点样于氨基玻片上,再真空固定1 h。然后经NaOH碱变性和TBE液电泳洗去未固定结合的链。ERCC1(118)野生型探针用Cy3荧光标记:5'-Cy3-GGGCACGTTGCGC-3';突变型探针用Cy5荧光标记:5'-Cy5-GGGCACATTGCGC-3'。XRCC1(399)位点野生型探针用Cy3荧光标记:5'-Cy3-CCTCCCGGAGGTA-3';突变型探针用Cy5荧光标记:5'-Cy5-CCTCCCAGAGGTA-3'。杂交后在4℃含Mg2+的TBE液中电泳,洗去未杂交的链和多余的杂交反应液,灭菌双蒸水清洗后吹干玻片,扫描仪进行芯片扫描。
1.2.4 测序验证 各位点随机选取10%的PCR产物送至上海英骏生物技术有限公司进行测序,以验证基因芯片检测的结果。
1.2.5 病例随访 我们采用电话、门诊、住院记录及
信件等形式对所有化疗结束后的患者进行随访。
1.3 统计学处理
采用SPSS 13.0统计软件包进行数据分析,采用Kaplan-Metier法进行单因素生存分析、χ2检验和Logrank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 样品的双色荧光杂交微阵列的分析
其原理为经过杂交、扫描后,根据Cy3和Cy5双色荧光扫描结果叠加图所呈现的绿、红、黄3种颜色进行分型。突变型样本获得Cy5荧光(红色荧光),野生型样本获得Cy3荧光(绿色荧光),杂合型样本既可获得Cy3荧光又可获得Cy5荧光,叠加后呈现黄色荧光。同一样本在同一微阵列中有很好的重复性,在不同微阵列中荧光强度略有差异,但叠加图颜色一致,分型结果相同。各位点多态性的基因芯片扫描图像见图1。

图1 SNPs位点基因分型的微阵列杂交扫描图像Fig 1 The microarray images of locus ERCC1-118 and XRCC1-399
2.2 各位点的基因型分布
在120例晚期NSCLC患者中,ERCC1(118)位点携带野生型的有73例(60.8%)、杂合型的有40例(33.3%)、突变型的有 7 例(5.9%);XRCC1(399)位点携带野生型的有48例(40.0%)、杂合型的有53例(44.2%)、突变型的有 19 例(15.8%)。这两个基因SNP分布符合哈迪-温伯格平衡定律(Hardy-Weinberg equilibrium,HWE),没有发现这些位点的基因型分布与年龄、性别和病理分型有关联(表1)。
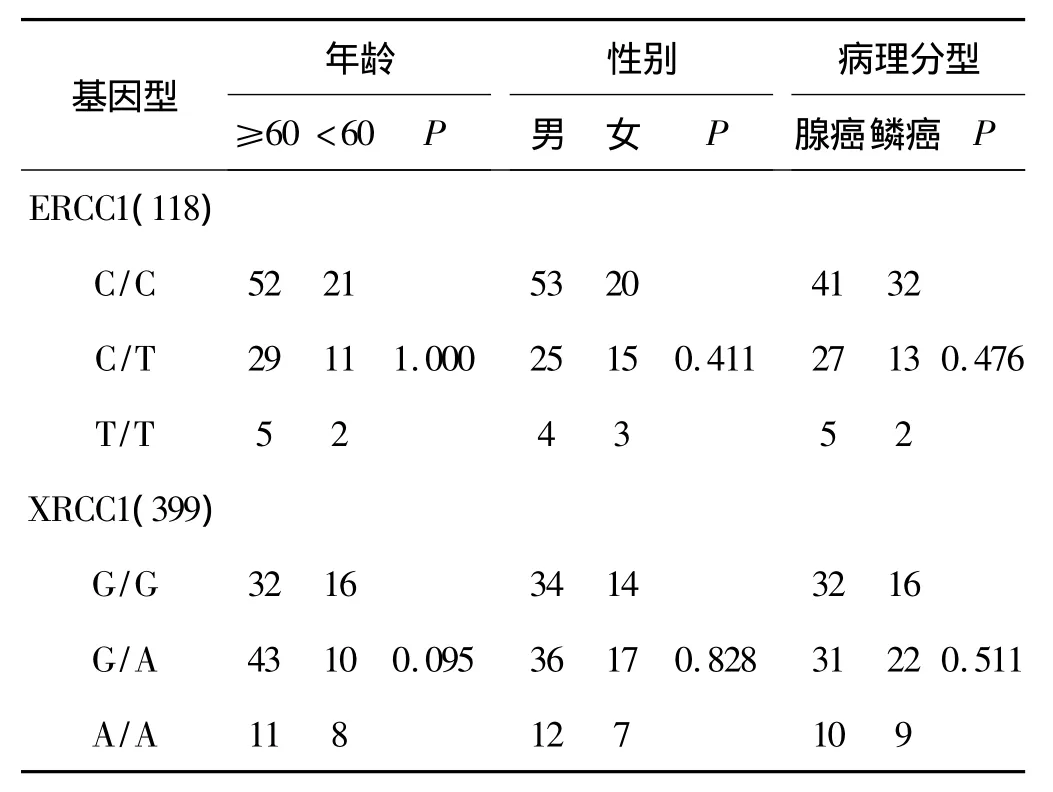
表1 各基因型分布与年龄、性别和病理分型的关联性Tab 1 The relationship between genetic polymorphisms and age,gender,histology
2.3 测序结果
把随机抽取10%的标本经PCR扩增后的产物送至上海英骏生物技术有限公司进行测序,每个位点的测序结果与基因芯片检测的结果完全吻合。
2.4 各基因型与晚期NSCLC化疗后生存期之间的关系
120例晚期NSCLC患者,获得完整随访资料的患者共106例,失访病例14例,中位随访时间11个月(6~49个月)。到随访截止日(2010-12-31),有7例存活,死亡99例,治疗后的中位生存期11.7个月,1年生存率 45.3%(48/106),2年生存率为 11.3%(12/106),3年生存率为 6.6%(7/106)。各基因型SNP与患者的生存期的关系见表2及图2、3。携带ERCC1(118)C/C、C/T+T/T基因型患者铂类化疗后MST、1年生存率、2年生存率及3年生存率分别为10.9个月、35.9%、6.3%、1.6% 和 13.5 个 月、59.5%、19.0%、14.3%,两者间比较差异均有统计学意义(P <0.05);携带 XRCC1(399)G/G、G/A+A/A基因型患者铂类化疗后MST、1年生存率、2年生存率及3年生存率分别为 15.2个月、59.1%、15.9%、6.8%和 11.1 个月、35.5%、8.1%、6.5%,两者间比较差异均有统计学意义(P<0.05)。
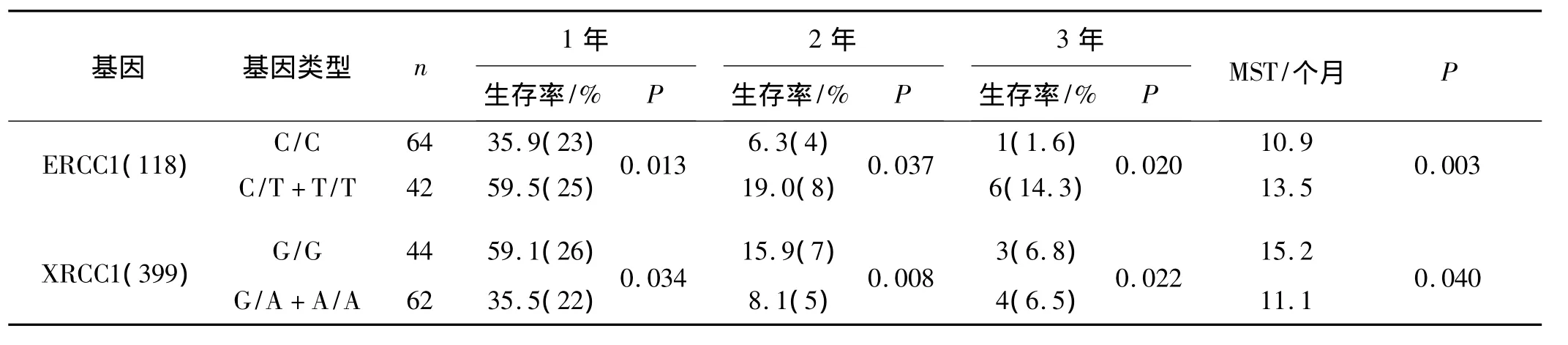
表2 各基因型与患者的生存期的关系Tab 2 The relationship between genetic polymorphisms and survival time
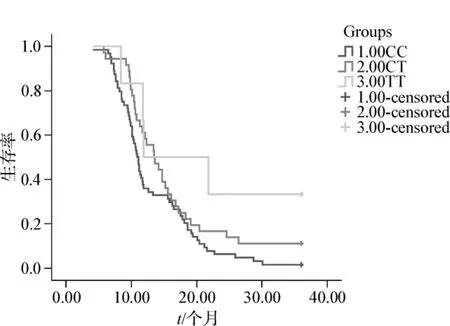
图2ERCC1(118)各基因型患者生存曲线Fig 2 Survival curves of ERCC1-118 various genotypes
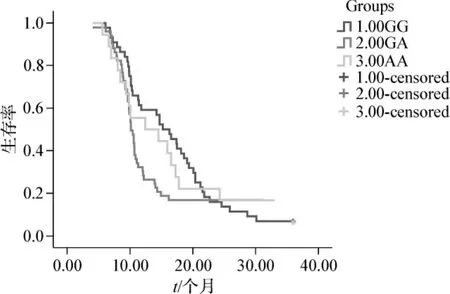
图3XRCC1(399)各基因型患者生存曲线Fig 3 Survival curves of XRCC1-399 various genotypes
3 讨 论
研究表明在肿瘤的治疗过程中,DNA修复能力增强影响了抗肿瘤药物疗效的发挥,易产生耐药性;DNA修复能力低可能与个体肿瘤易感性及生存期缩短密切相关,另一方面,DNA修复能力下降也许有助于有抗肿瘤活性的铂-DNA加合物功能的持续存在,从而对预后产生好的影响。国内外的许多学者发现,DNA修复基因多态不仅与NSCLC的化疗疗效有关,可能对预后也有影响。
SNP分析方法有很多,但大多不能一次大量检测或检测成本较高。基因芯片分析方法是一种全基因组的SNP扫描方法,其原理同TaqMan探针技术一样,也是等位特异性寡核苷酸杂交。它是将大量核酸片段以预先设计的方法固定在载玻片、尼龙膜等载体上组成密集分子排列,通过与标记样品进行杂交,检测杂交信号的强弱,进行判断样品中靶分子的数量及组成。我们采用基因芯片的方法对ERCC1(118)、XRCC1(399)成功进行基因分型,野生型、杂合型和突变型的叠加荧光分别显示为绿色、黄色和红色,并通过基因测序方法验证该基因芯片方法的准确性,其结果完全吻合。证明该基因芯片法检测外周血DNA损伤修复基因ERCC1(118)、XRCC1(399)位点 SNP方法,准确、可靠、高通量且价格低廉,适用进行大规模样本SNP实验及临床检测。该芯片能较长时间地储存,实验中可使用较多的微阵列,能对结果的分析提供一个较好的统计平台。
已有很多文献报道ERCC1、XRCC1的SNP与铂类药物化疗敏感性存在明显关系,但关于ERCC1的SNP与铂类药物化疗后生存期关系的研究相对较少。Zhou等[2]报道,130例NSCLC患者接受铂类为主方案化疗后总的生存期为15个月,ERCC1(118)C/T单核苷酸多态性与NSCLC患者铂类药物化疗后的生存期有显著相关性(P=0.003),多变量分析结果显示ERCC1(118)C/T和T/T基因型患者化疗后的生存期及化疗敏感性明显高于携带C/C基因型的患者。Ryu等[3]对 109例以顺铂联合化疗的 NSCLC患者的ERCC1(118)的多态性进行评估,结果显示全组总的中位生存时间是376 d;ERCC1(118)位点多态性C/C基因型的中位生存期是486 d,与变异型(T/T和C/T)患者的281 d存在差异(P=0.005 8)。大多研究[4-5]证实,ERCC1(118)SNP与铂类药物化疗后生存期存在一定的相关性;但也有部分研究[6-7]结果显示,ERCC1(118)SNP与铂类药物化疗后生存期无关。
一项包括135例NSCLC患者对铂类为主方案化疗后生存期与DNA修复基因XRCC1多态性关系的研究[8]结果显示,携带 XRCC1(399)G/G 基因型的NSCLC患者化疗后MST和1、2年生存率分别为14.0个月和56.3%、20.8%,携带 XRCC1(399)G/A 或 A/A基因型的NSCLC患者化疗后MST和1、2年生存率分别为10.0个月和39.0%、7.6%,差异均有统计学意义(P <0.05)。大多研究[9-12]证实,XRCC1(399)基因多态性与晚期NSCLC患者铂类药物化疗后的生存期有关,XRCC1(399)基因多态性可以在一定程度上判断晚期NSCLC患者铂类药物化疗后的预后。
我们的研究结果显示,携带ERCC1(118)C/C和C/T+T/T基因型患者铂类化疗后MST、1年生存率、2年生存率及3年生存率分别为10.9个月、35.9%、6.3%、1.6%,13.5 月、59.5%、19.0%、14.3%,差异有统计学意义(P<0.05);携带XRCC1(399)G/G和G/A+A/A基因型患者铂类化疗后MST、1年生存率、2年生存率及3年生存率分别为15.2个月、59.1%、15.9%、6.8%,11.1 个月、35.5%、8.1%、6.5%,差异有统计学意义(P<0.05)。我们的初步结论是,ERCC1(118)和XRCC1(399)的多态性与NSCLC铂类药物化疗后的生存期有关,有可能作为铂类药物化疗后生存期的预测指标。
我们的结果与文献报道不完全一致,可能有以下几个方面原因:入组的人群、种族及个体对药物代谢的特异性不同;样本量的差异;给药剂量、给药时间及给药方式的不同;化疗方案不同;基因多态性引起的编码蛋白质的功能改变还不确定;基因多态性检测方法的差异;不同研究结果也可能存在差异,而且目前国际上也缺乏统一标准。关于DNA损伤修复基因多态性与NSCLC铂类药物化疗后的预后关系及能否作为铂类药物化疗后患者的生存预后指标尚有待更多的研究证实。
[1]陈芹,周彩存,张颉.ERCC1、RRM1和 BRCA1在非小细胞肺癌中的表达及预后意义[J].肿瘤,2007,27(9):719-722.
[2]ZHOU C,REN S,ZHOU S,et al.Predictive effects of ERCC1 and XRCC3 SNP on efficacy of platinum-based chemotherapy in advanced NSCLC patients[J].Jpn J Clin Oncol,2010,40(10):954-960.
[3]RYU J S,HONG Y C,HAN H S,et al.Association between polymorphisms of ERCC1 and XPD and survival in non-smallcell lung cancer patients treated with cisplatin combination chemotherapy[J].Lung Cancer,2004,44(3):311-316.
[4] OKUDA K,SASAKI H,HIKOSAKA Y,et al.Excision repair cross complementation group 1 polymorphisms predict overall survival after platinum-based chemotherapy for completely resected non-small cell lung cancer[J].J Surg Res,2011,168(2):206-212.
[5]ISLA D,SARRIES C,ROSELL R.Single nucleotide polymorphisms and outcome in docetaxel-cisplatin-treated advanced non-small-cell lung cancer[J].Ann Oncol,2004,15(8):1194-1203.
[6]TAKENAKA T,YANO T,KIYOHARA C,et al.Effects of excision repair cross-complementation group 1(ERCC1)single nucleotide polymorphisms on the prognosis of non-small cell lung cancer patients[J].Lung Cancer,2010,67(1):101-107.
[7]TIBALDI C,GIOVANNETTI E,VASILE E,et al.Correlation of CDA,ERCC1 and XPD polymorphisms with response and survival in gemcitabine/cisplatin-treated advanced nonsmall cell lung cancer patients[J].Clin Cancer Res,2008,14(6):1797-1803.
[8]WANG Z H,XU B H,LIANG G,et al.Polymorphisms of DNA X-ray repair cross complementary protein 1 and its association with survival to plaintin-based chemotherapy in advanced non-small cell lung cancer[J].Clin Med China,2006,22(1):1-6.
[9]SUN X,LI F,SUN N,et al.Polymorphisms in XRCC1 and XPG and response to platinum-based chemotherapy in advanced non-small cell lung cancer patients[J].Lung Cancer,2009,65(2):230-236.
[10]GIACHINO D F,GHIO P,REGAZZONI S,et al.Prospective assessment of XPD Lys751Gln and XRCC1 Arg399Gln single nucleotide polymorphisms in lung cancer[J].Clin Cancer Res,2007,13(10):2876-2881.
[11]LIU X Z,QIAN X P,LIU B R,et al.Single nucleotide polymorphisms in XRCC1,XPD and platinum prognosis in nonsmall cell lung cancer[J].J Clin Med Prac,2008,12(5):7-11.
[12]De las PEÑAS R,SANCHEZ-RONCO M,ALBEROLA V,et al.Polymorphisms in DNA repair genes modulate survival in cisplatin/gemcitabine-treated non-small cell lung cancer patients[J].Ann Oncol,2006,17(4):668-675.
东南大学学报(医学版)2011年5期
