瘦素对大鼠脂肪细胞SOCS-3表达的影响
刘莉,顾海伦,赵越,任亚浩,于飞,杨军
(1.中国医科大学公共卫生学院营养与食品卫生学教研室,辽宁沈阳 110001;2.中国医科大学附属盛京医院骨外科,辽宁沈阳 110004)
瘦素是一种由脂肪细胞分泌的细胞因子,主要通过与下丘脑的瘦素长型受体结合,激活Jak蛋白酪氨酸激酶(Janus protein tyrosine kinase,Jak)/信号转导和转录激活子(signal transducer and activator of transcription,STATs)信号通路来调节摄食及能量代谢。我们在先前的研究中发现脂肪细胞也表达瘦素长型受体[1],提示瘦素可能通过该受体对脂肪细胞产生直接作用。细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS-3)是瘦素信号转导的负反馈抑制因子,在中枢瘦素抵抗中起重要作用。关于脂肪细胞SOCS-3的研究报道却较少,因此,本研究拟通过体外实验,采用重组瘦素处理大鼠成熟脂肪细胞,探讨其对SOCS-3蛋白表达的影响及机制。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体质量(200±20)g,购于中国医科大学实验动物部。
1.2 试剂
大鼠重组瘦素(Sigma公司,美国),Ⅱ型胶原酶(Sigma公司,美国),DMEM(Gibco公司,美国),FBS(Clark公司,美国),SOCS-3(H-103)抗体及 Protein A/G plus-Agrose(Santa Cruz公司,美国),p-STAT1,p-STAT3抗体(Cell Signal公司,美国)。
1.3 大鼠成熟脂肪细胞的分离
无菌条件下获取大鼠双侧附睾脂肪组织,加Ⅱ型胶原酶于37℃水浴振荡孵育1 h,过250 μm筛网,DMEM洗细胞,50×g离心10 min,吸出下清液,上层白色物质即为成熟的脂肪细胞,加入10%FBS的DMEM混悬,接种细胞于6孔板,于37℃、体积分数为5%的CO2培养箱中孵育。
1.4 瘦素处理成熟脂肪细胞
依据文献[1]方法,采用 50 nmol·L-1的大鼠重组瘦素分别处理0.5、2、6 h,同时设置未处理组,收集细胞,迅速放入液氮中保存待测。每一浓度重复3次。
1.5 免疫共沉淀结合 Western blotting法检测SOCS-3、p-STAT1、p-STAT3 蛋白表达
全细胞裂解液裂解细胞,超声粉碎,4℃离心。蛋白定量,调整浓度,取200 μl细胞裂解液,按说明书加入SOCS-3抗体(H-103)(1∶100)4℃过夜,加入Protein A/G plus-Agrose 20 μl 4 ℃ 摇动 3 h,500 μl细胞裂解液洗细胞5次,离心,向沉淀中加入20 μl样品缓冲液,变性,SDS-聚丙烯酰胺凝胶电泳,转印,5%脱脂奶粉封闭1 h,再分别加入 SOCS-3抗体(H-103)(1∶1 000)、p-STAT1 抗体(1∶1 000)、p-STAT3 抗体(1∶1 000)4℃过夜,加入碱性磷酸酶标记的二抗室温2 h,碱磷酶显色液显色并拍照成像。Scion Image 4.03软件分析产物灰度值。
2 结 果
2.1 瘦素对脂肪细胞SOCS-3蛋白表达的影响
未经瘦素处理的脂肪细胞中有少量SOCS-3表达;当50 nmol·L-1瘦素处理0.5 h 和2 h 后 SOCS-3 蛋白表达略有增加,但差异无统计学意义(P>0.05);在瘦素处理达6 h后,SOCS-3蛋白的表达量则显著增加(P<0.01)。见图1。
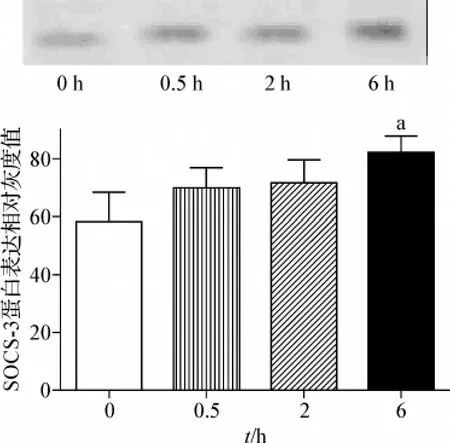
图1 脂肪细胞SOCS-3蛋白在50 nmol·L-1瘦素处理前后表达变化Fig 1 The time-dependent expression of SOCS-3 protein in adipocytes with 50 nmol·L -1leptin treatment
2.2 瘦素处理前后脂肪细胞p-STAT1和p-STAT3蛋白表达变化
当瘦素处理2 h和6 h后,p-STAT1蛋白表达相比于未处理和处理0.5 h的显著增加(P<0.01);但瘦素处理后2 h和6 h相比,p-STAT1蛋白表达无明显差异。见图2。
当瘦素处理6 h后,p-STAT3蛋白表达相比于未处理的显著增加(P<0.01),而瘦素处理0.5 h和2 h后的p-STAT3蛋白表达则无明显变化。见图3。
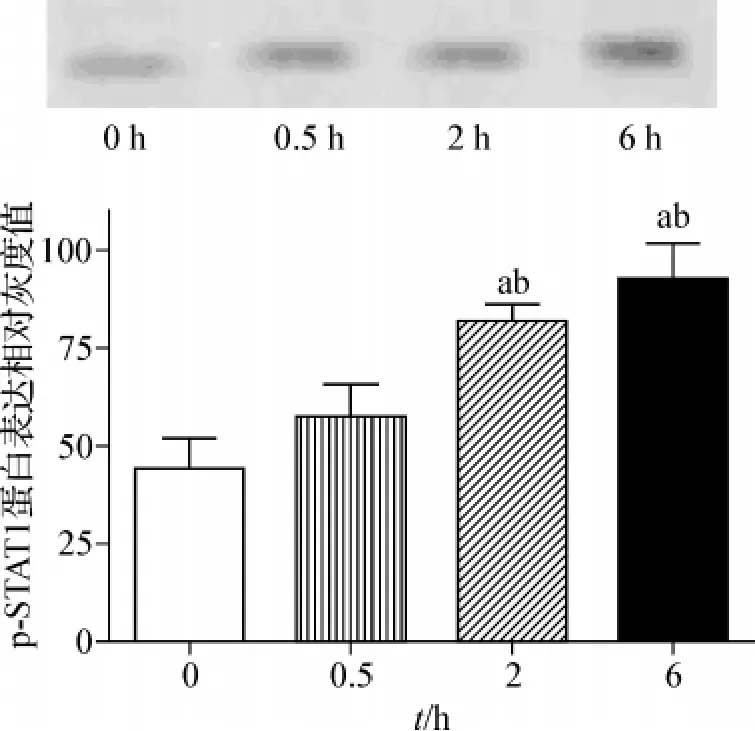
图2 脂肪细胞p-STAT1蛋白在50 nmol·L-1瘦素处理前后表达变化Fig 2 The time-dependent expression of p-STAT1 protein in adipocytes with 50 nmol·L - 1leptin treatment
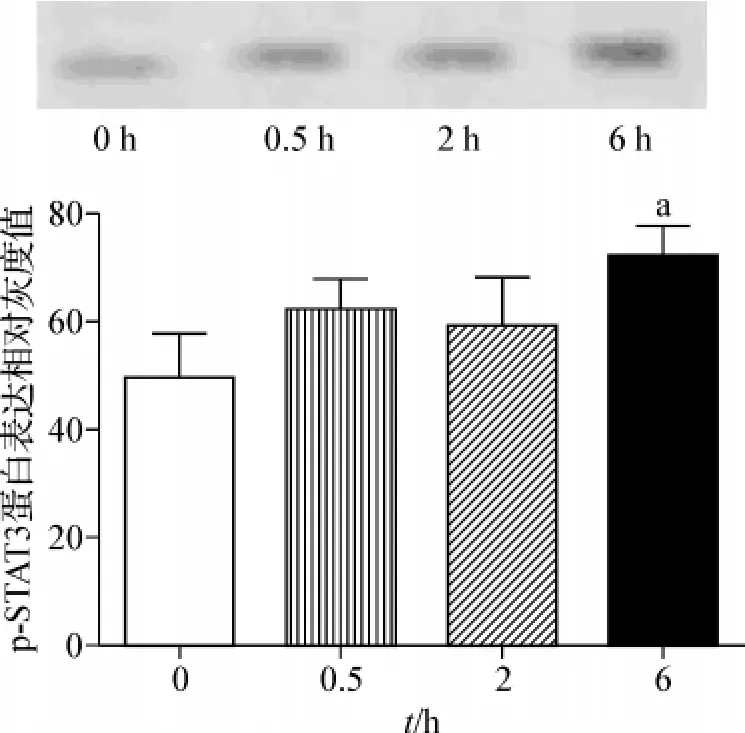
图3 脂肪细胞p-STAT3蛋白在50 nmol·L-1瘦素处理前后表达变化Fig 3 The time-dependent expression of p-STAT3 protein in adipocytes with 50 nmol·L - 1leptin treatment
3 讨 论
瘦素抵抗是大多数肥胖者和啮齿类动物都存在的一种现象,其产生机制被认为与SOCS-3增多有关。许多研究表明,肥胖小鼠的下丘脑SOCS-3表达显著升高[2],说明肥胖小鼠存在中枢瘦素抵抗。也有研究发现,肥胖大鼠脂肪组织SOCS-3水平也显著高于对照组,提示在脂肪组织中也可能存在瘦素抵抗现象[3]。
在中枢瘦素与OB-Rb结合,通过激活Jak/STAT途径诱导SOCS-3的产生,而产生的SOCS-3又可以抑制该途径的信号转导,使瘦素不能发挥减少体重的作用,产生瘦素抵抗。本研究发现,瘦素未处理的脂肪细胞中只有少量SOCS-3表达,而瘦素处理6 h后,SOCS-3蛋白的表达量显著增加,说明瘦素可以诱导脂肪细胞SOCS-3的产生,并具有时间依赖性。在Jak/STAT信号通路中,Jak是一种在细胞因子信号传递过程中起重要作用的蛋白酪氨酸激酶,它可在细胞因子与其受体结合后活化,并进而激活另一种信号蛋白分子STATs来诱导目的基因表达。STATs是一类脱氧核糖核酸结合蛋白,作为Jak-STAT途径中重要的Jak底物,STATs在细胞因子的信号转导中起着关键性的作用。哺乳动物细胞中发现的STAT家族成员主要包括STAT1 ~STAT6[4],在中枢 SOCS-3 的产生主要是通过Jak2/STAT3途径。有研究报道,在3T3-L1脂肪细胞中,STAT1和STAT3信号转导通路可被白血病抑制因子、干扰素γ激活[5-6]。因此,本研究主要通过检测 p-STAT1和p-STAT3的表达来研究脂肪细胞中瘦素诱导SOCS-3产生的信号转导通路。
研究显示,当瘦素处理2 h和6 h后,p-STAT1蛋白表达相比于未处理和处理0.5 h的显著增加。当瘦素处理6 h后,p-STAT3蛋白表达相比于未处理的显著增加。提示在脂肪细胞中瘦素也是通过激活Jak-STAT信号通路,引起STAT1、STAT3的磷酸化,进而诱导SOCS-3的表达。由此可见,在肥胖状态下,肥大的脂肪细胞产生并分泌大量瘦素,而高浓度瘦素可以诱导产生更多的SOCS-3,过多的SOCS-3则可抑制瘦素信号转导通路,使瘦素不能发挥减少脂肪的效应,导致肥胖者脂肪细胞产生直接的瘦素抵抗。当然,在脂肪细胞中瘦素还将通过其他通路,如AMPK途径等发挥作用,所以,关于脂肪细胞瘦素抵抗的进一步机制还须深入探讨。
[1]刘莉,顾海伦,杨军,等.大鼠重组瘦素对成熟脂肪细胞细胞信号转导抑制因子3表达的影响[J].卫生研究,2009,38(2):160-162.
[2]MUNZBERG H,FLIER J S,BJORBAEK C,et al.Regionspecific leptin resistance within the hypothalamus of diet-induced obese mice[J].Endocrinology,2004,145(11):4880-4889.
[3]刘莉,顾海伦,赵越,等.瘦素抵抗肥胖大鼠脂肪组织SOCS-3、PPARγ 及 ACO mRNA 水平的探讨[J].卫生研究,2008,37(1):40-42.
[4]HEINRICH P C,BEHRMANN I,MULLER-NEWE N,et al.Interleukin-6-type cytokine signalling through the gp130/Jak/STAT pathway[J].Biochem J,1998,334(Pt 2):297-314.
[5]JACQUELINE M,STEPHEN S,STEVEN J,et al.Activation of signal transducers and activators of transcription 1 and 3 by leukemia inhibitory factor,oncostatin-M,and interferon-γ in adipocytes[J].J Biol Chem,1998,273(47):31408-31416.
[6]WADA T,HOSHINO M,KIMURA Y,et al.Both typeⅠandⅡIFN induces insulin resistance by inducing different isoform of SOCS expression in 3T3-L1 adipocytes[J].Am J Physiol Endocrinol Metab,2011,300(6):E1112-E1123.
东南大学学报(医学版)2011年5期
