3株细菌降解木质素的条件调控研究
张欢,柴立元,朱咏华,陈跃辉,靳冉
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;2. 湖南大学 生命科学与技术研究院,湖南 长沙,410082)
木质素是自然界中含量极为丰富的一种天然有机高分子聚合物,它广泛存在于植物细胞壁中,与纤维素和半纤维素一起构成植物的支撑骨架。受生物合成的影响,木质素分子不像纤维素那样具有单一结合形式,而是以苯丙烷类似物为结构单元,通过碳碳键、二芳基键、烷醚键等连接而成的无定形三维空间网状芳香族高分子聚合物。由于这种联建复杂,木质素不像其他自然高聚物(纤维素、淀粉等)一样易被降解,是目前公认的微生物难降解的芳香族化合物之一[1]。木质素的微生物降解不仅取决于微生物自身的降解能力,而且在很大程度上依赖于周围的环境条件。目前国内外有关微生物木质素降解营养调控机制的研究表明,木质素降解酶活性受碳源、氮源、碳氮比、pH、溶解氧浓度和金属离子等因素影响。Kirk等[2]通过研究木质素降解模式菌黄孢原毛平革菌(Phanerochaete chrysosporium)认为,氮源浓度对其木质素降解的影响较为显著,低氮有利于木质素的降解;振荡培养导致真菌菌丝球的形成严重抑制木质素的降解;木质素降解的最佳 pH为 4.0~4.5。李翠珍等[3]对其筛选出的 1株白腐真菌F2的木质素降解酶生产特性进行了研究,结果表明:限碳和富氮条件下有利于LiP酶的产生;而碳源浓度对其产MnP的影响不大,限氮和富氮条件下都有利于MnP的产生。白腐真菌是木质素降解中最主要的微生物,对其木质素降解、产酶条件优化、实际应用等方面的研究是目前生物技术应用方面的热点课题[4-5],然而,细菌具有生长迅速、来源广泛、便于基因工程改造及易工业化生产等优势,因此,对细菌木质素降解的研究也具有很大的应用价值。为此,本课题组前期从三国吴简蚀斑微生物中分离、筛选得到3株具有木质素降解能力的细菌Acinetobacter sp. B-2,Pandoraea sp. B-6和 Novosphingobium sp. B-7[6]。目前已发现不动杆菌属Acinetobacter的一些菌株具有降解木质素及其相关化合物的能力。Delneri等[7]研究了Acinetobacter calcoaceticus DSM 586菌株对木质素单体化合物的降解代谢,发现该菌株能有效地降解反式阿魏酸和对羟苯丙烯酸,并对降解反应机制进行了分析。Vasudevan等[8]从森林土壤中分离筛选得到了1株Acinetobacter sp.,测定菌株降解14C标记的脱氢高分子聚合物(DPH,被广泛地用作木质素的模型化合物)和柚木木质素CO2累积产生量,6 d分别可达38.9%和 27.2%。虽然对 Pandoraea属和 Novosphingobium属的细菌降解木质素及其木质素相关化合物的报道较少,但有证据表明它们能降解芳烃类、苯酚类有机物。Pandoraea sp. 能降解有机氯杀虫剂硫丹[9],而Novosphingobium sp. 能降解联苯、萘、氯酚等多种异生物质[10]。目前,人们对这3种细菌的木质素降解条件调控的研究很少。为此,本文作者采用易溶于水的木质素磺酸钠作为天然木质素的替代物,探讨氮源、氮源浓度、温度、pH、摇床转速等因素对菌株木质素降解性能的影响,从而确定各菌株适宜的木质素降解条件,以期为其进一步应用研究提供一定的理论依据。
1 材料和方法
1.1 材料
1.1.1 菌种
试验用的 3株细菌为本课题组前期从三国吴简(长沙简牍博物馆保存)蚀斑微生物中分离筛选得到的菌,分别为不动杆菌属菌株 B-2(Acinetobacter sp.B-2)、伯克氏菌属菌株B-6(Pandoraea sp. B-6)和新鞘氨醇杆菌属菌株B-7(Novosphingobium sp. B-7)。
1.1.2 培养基
(1) 菌种保藏培养基:木质素磺酸钠(天津市光复精细化工研究所生产)3 g/L,K2HPO41 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.1 g/L,FeSO4·7H2O 0.05 g/L,MnSO4·H2O 0.02 g/L,KH2PO41 g/L,(NH4)2SO41.98 g/L,琼脂15 g/L,pH为7.0左右。
(2) 菌种活化培养基:LB培养基(蛋白胨10 g/L,酵母浸膏5 g/L,NaCl 10 g/L,pH为7.0左右)。
(3) 液体降解培养基:木质素磺酸钠 3 g/L,K2HPO41 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.1 g/L,FeSO4·7H2O 0.05 g/L,MnSO4·H2O 0.02 g/L,KH2PO41 g/L,(NH4)2SO41.98 g/L,pHo 7.0左右。
(4) 基础培养基(BM培养基):酵母膏10 g/L,葡萄糖20 g/L,琼脂15 g/L,pH为7.0左右。
1.2 试验方法
1.2.1 木质素降解酶的定性检测
采用苯胺兰(Azure-B)和 RB亮蓝(Remazol Brilliant Blue)染料平板检测,在BM培养基中分别加入0.1 g/L的染料苯胺兰和RB亮蓝,铺平板后接种各菌株,于30 ℃培养箱中静置培养,每天观察,以平板培养基中菌落周围脱色圈的有无来定性检测木质素降解酶是否产生。有脱色圈产生记为(+),无脱色圈产生记为(-)。
1.2.2 菌株的木质素降解性能
以LB培养基活化培养细菌至对数期,以体积分数1%接种于液体降解培养基中,于30 ℃摇床振荡培养,每天取样测定培养液中木质素磺酸钠的浓度,直至木质素磺酸钠浓度不再变化为止。
1.2.3 木质素降解的调控研究
以LB培养基活化培养细菌至对数期,以体积分数为 1%接种于降解培养液中培养并进行各项检测分析。选取氮源、氮源浓度、pH、温度、摇床转速5个因素进行细菌木质素降解实验。各因素所选取水平见表1。
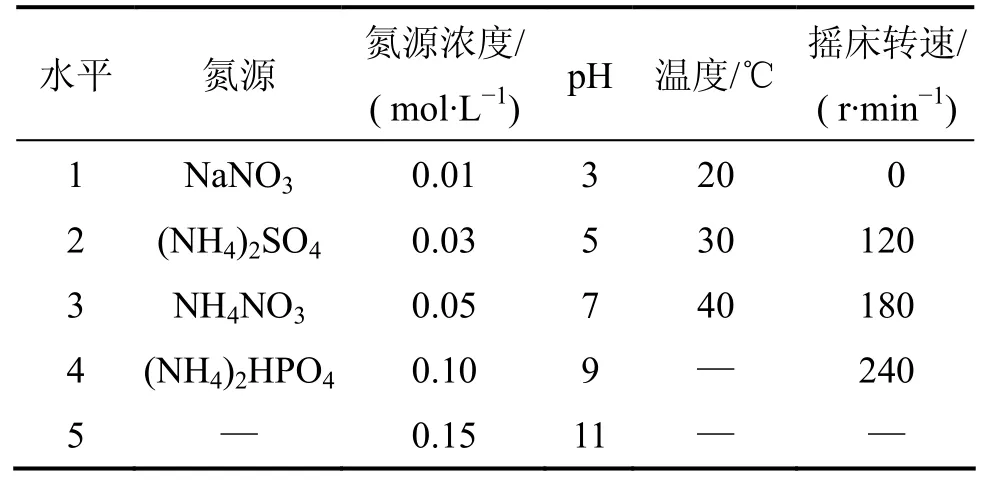
表1 培养调控因素及所选水平Table 1 Incubating control factors and parameter levels
1.3 测定方法
1.3.1 木质素磺酸钠-总碳标准曲线测定
准确称取木质素磺酸钠1.000 0 g,用蒸馏水定容至 1 L,进行适当稀释,得到木质素磺酸钠质量浓度为0.1~0.8 g/L的等梯度溶液,分别测定各溶液的总碳(Total carbon,TC)质量浓度。以木质素磺酸钠质量浓度为横坐标,总碳质量浓度为纵坐标,绘制木质素磺酸钠-总碳质量浓度标准曲线。
1.3.2 木质素降解率测定
取培养液4 mL,经转速12 000 r/min离心6 min,上清液用直径为0.22 μm的微孔滤头(上海生工生物工程技术服务有限公司)过滤,测定滤液TC质量浓度。根据木质素磺酸钠-总碳质量浓度标准曲线,换算成木质素磺酸钠的质量浓度。根据降解前后木质素磺酸钠质量浓度的比较,即可得到木质素降解率。对于所要考察的每种情况同时进行3组平行实验,结果取平均值。
1.3.3 溶液总碳测定
溶液总碳质量浓度采用TOC—VCPH型总有机碳分析仪(日本岛津公司制造)测定。
2 结果与讨论
2.1 木质素降解酶的定性检测结果
木质素的降解主要是依赖一系列酶的共同作用,这些酶主要包括木质素过氧化物酶(Lignin peroxidases,LiP)、锰过氧化物酶(Manganese peroxidases, MnP)和漆酶(Laccase, Lac)。通过定性检测菌株产木质素降解酶的情况,可以初步判断菌株的木质素降解能力。苯胺蓝的脱色与LiP及MnP的产生有关,但不反映漆酶的产生,漆酶能使RB亮蓝脱色[11-13],结果如表2所示。菌株Acinetobacter sp. B-2和Pandoraea sp. B-6对苯胺蓝有较强的脱色能力,对RB亮蓝无脱色作用。Novosphingobium sp. B-7对苯胺蓝和RB亮蓝都有一定的脱色能力。根据平板的脱色结果,表明在无木质素诱导物存在的情况下3株菌均具有产木质素降解酶的能力,但据苯胺蓝平板脱色反应和RB亮蓝脱色反应只能简单判断菌株的产酶情况,要具体确定菌株的木质素降解能力,需进行木质素降解的定量测定实验。

表2 菌株平板培养染料的脱色效果Table 2 Effects of bacteria strains on decolorization of dye under plate culture
2.2 木质素磺酸钠-总碳质量浓度标准曲线
木质素磺酸钠与总碳质量浓度测定结果见图 1。从图1可见:木质素磺酸钠溶液质量浓度与TC质量浓度有很好的正相关性,可用于样品木质素磺酸钠质量浓度的确定。
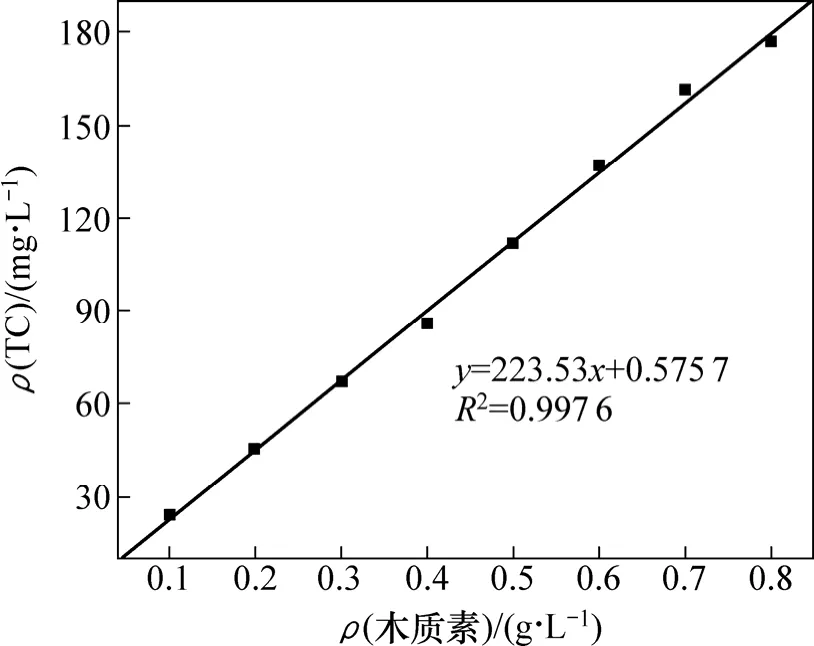
图1 木质素磺酸钠-总碳质量浓度标准曲线Fig.1 Standard curve of mass concentration of sodium lignin sulfonate-total carbon
2.3 菌株木质素的降解性能
3株细菌接种到液体降解培养基后,每天取样测定其木质素质量浓度,3株菌的木质素降解情况如图2所示。从图2可见:培养的前3天为3株菌的木质素快速降解期,第4天后菌株的木质素降解曲线趋于缓和,表明木质素的质量浓度基本不再变化,菌株对木质素的降解基本稳定。可见这3株细菌对木质素的降解主要发生在初级代谢阶段,这与Ramachandra等[14]认为细菌的木质素降解发生在初级代谢阶段的研究结论相一致。第4天以后由于细菌生长进入衰亡期,大量细胞开始死亡并发生自溶,会导致溶液的TC质量浓度升高,影响实验结果的测定,无法真实表征菌株的木质素降解率,因此,选定培养3 d后测定各条件下菌株的木质素降解率。目前,国内外有关木质素微生物降解的研究大多集中于真菌,但真菌培养周期长,降解缓慢,需要培养3周甚至更久才能检测到木质素的部分降解[15-16]。习兴梅等[17]从农林废物中分离得到1株黑曲霉,在固态培养条件下培养30 d,木质素降解率达16.87%,通常认为是非丝状细菌降解木质素的低相对分子质量组分和木质素的降解中间产物[18]。孙先锋等[19]从造纸黑液中筛选分离得到6株细菌液体,培养12 d后木质素的降解率为10%~20%。本研究采用的从三国吴简蚀斑微生物中分离筛选得到的3株非丝状细菌第5天对木质素的降解基本趋于稳定与多数菌种相比具有降解速率快、降解时间短的特点。目前,国内外对于非丝状细菌的木质素降解研究较少,对于这一类微生物的木质素降解能力、降解机制以及其在木质素的自然降解中所起的作用还缺乏了解,因此,对于具有高效木质素降解能力的非丝状细菌的研究具有重要的意义。
2.4 氮源对3株菌木质素降解的影响
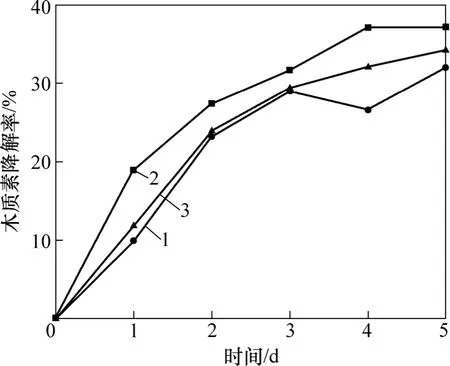
图2 菌株木质素降解曲线Fig.2 Lignin-degrading curves of bacteria strains
本实验中的3株细菌均可以利用木质素磺酸钠为唯一碳源,故选择最常见的无机氮源进行氮源选择实验。分别以硝酸钠、磷酸氢二铵、硫酸铵、硝酸铵(各为0.03 mol/L)作为唯一氮源,测定3株菌的木质素降解率,实验结果见表 3,可见:硝酸铵为菌株Acinetobacter sp. B-2和Novosphingobium sp. B-7的最佳氮源;磷酸氢二铵为菌株Pandoraea sp. B-6最佳氮源。但以氮源为硝酸铵时,3株菌的木质素降解率都相对较高。罗宇煊等[20]对1株嗜碱木质素降解菌产酶及麦草木质素降解的研究也表明硝酸铵为该菌的最佳产酶氮源。菌株 Acinetobacter sp. B-2和 Pandoraea sp.B-6虽然在4种不同氮源条件下木质素降解率有明显差别,但整体降解率都较高,表明这2株菌氮源具有非专一性。
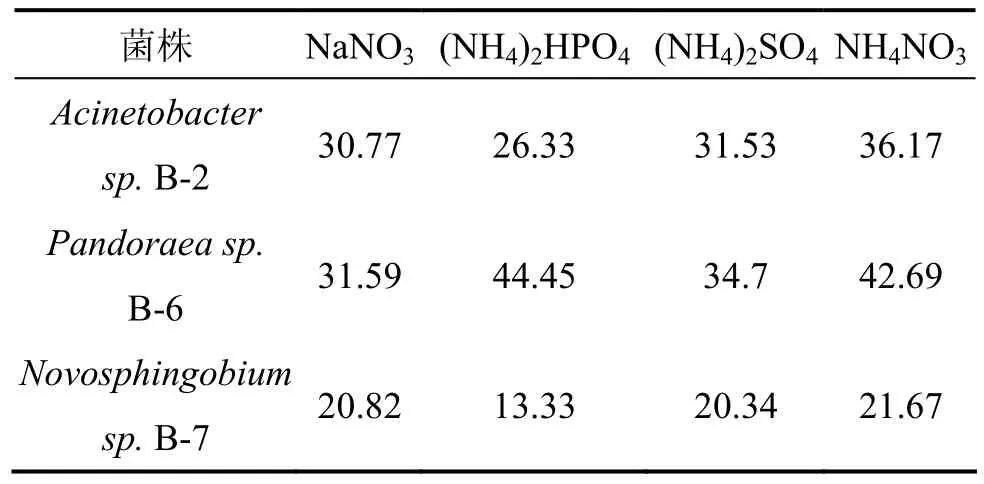
表3 氮源对菌株木质素降解率的影响Table 3 Effect of nitrogen source on lignin degradation by bacteria strains %
2.5 氮源浓度对3株菌木质素降解的影响
在木质素磺酸钠浓度不变的条件下,通过改变所选出的 3株细菌各自的最佳氮源(Acinetobacter sp.B-2,Novosphingobium sp. B-7(碳源为硝酸铵),Pandoraea sp. B-6(碳源为磷酸氢二铵)的浓度来调节降解培养基中的碳氮比。选取从较低浓度到高浓度 5个梯度,分别测定3株菌的木质素降解情况,实验结果见图3。从图3可见:不同的氮源浓度对其木质素降解有一定的影响,但在所选氮源浓度范围内并未表现出木质素降解率和氮源浓度的相关性。总的来说,低氮浓度似乎有利于菌株木质素降解能力的提高。对Acinetobacter sp. B-2和Novosphingobium sp. B-7,氮源浓度选择为0.01 mol/L;对Pandoraea sp. B-6,氮源浓度选择为0.03 mol/L。很多文献都涉及到氮源浓度对菌株产酶影响的研究,一般认为真菌的木质素降解发生在次级代谢阶段,限碳或限氮有利于木质素的降解或产酶。毕鑫等[21]研究了营养条件对白腐菌No.4510产LiP酶影响,结果表明限碳有利于LiP酶的产生。喻国策等[22]对黄孢原毛平革菌产木质素降解酶的研究发现,不仅在氮限制条件下而且在较高氮浓度甚至氮充分条件下都检测到少量LiP酶活性。可见,不同菌株其木质素降解性能及木质素降解酶的产生差别很大。
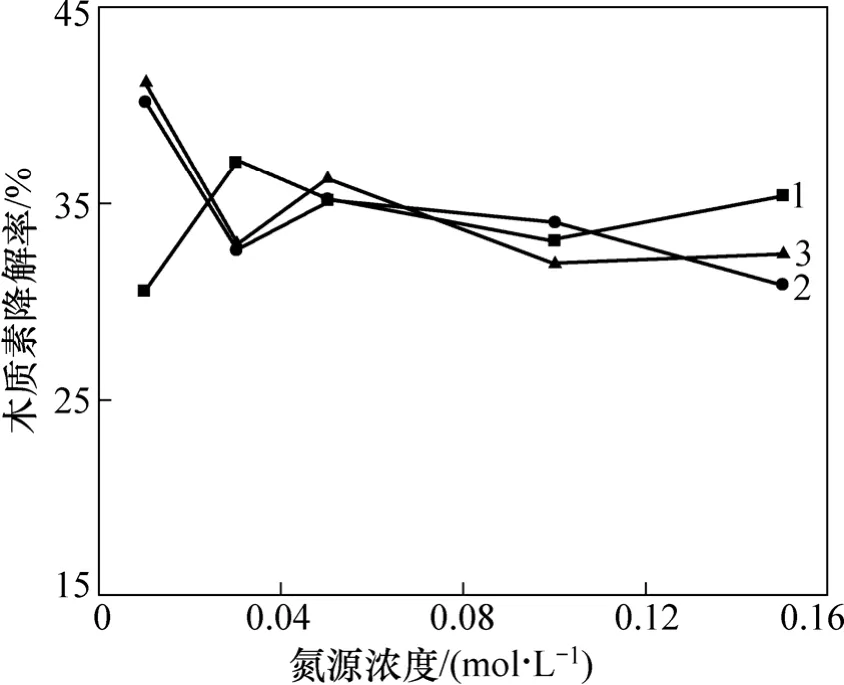
图3 氮源浓度对3株菌木质素降解的影响Fig.3 Effect of nitrogen source concentration on lignin degradation by bacteria strains
2.6 温度对3株菌木质素降解的影响
由于目前对这3株细菌木质素降解的研究报道较少,其木质素的降解特性尚不清楚,因此,根据筛选分离菌株时的环境条件,初步探讨了20,30和40 ℃3种温度下菌株的木质素降解性能,实验结果如图 4所示。从图4可以看出:温度对菌株木质素降解性能的影响很大,而且对3株菌的影响趋势基本相同,于30 ℃时降解效果明显好于20 ℃和40 ℃的降解效果。并且这3株菌的耐受温度范围较宽;当温度为20 ℃或40 ℃时,3 d仍有20%左右的降解率。
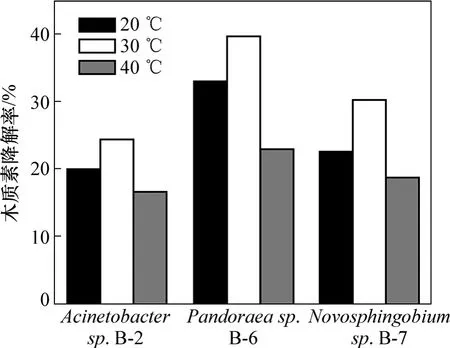
图4 温度对3株菌木质素降解的影响Fig.4 Effect of temperature on lignin degradation by bacteria strains
2.7 初始pH对3株菌木质素降解的影响
从酸性到碱性调节液体降解培养基的初始pH(3.0,5.0,7.0,9.0和11.0),其他条件保持不变,分别测定3株菌的木质素降解率,实验结果见表4。从表4可以看出:当初始pH为3时,3株菌均未显示木质素的降解性能;菌株 Acinetobacter sp. B-2和Pandoraea sp. B-6在初始pH为7时,降解效果最好;而Novosphingobium sp.B-7菌株在初始pH为5时,降解率最高,菌株 Acinetobacter sp.B-2和Novosphingobium sp.B-7在初始pH为11时,仍可以检测到有20%左右木质素被降解,而菌株Pandoraea sp. B-6则不能检测到木质素降解效果。造纸废水一般呈碱性,菌株的这些降解特性对于工业应用极其有利。另外,通过测定3株菌培养数天后培养基的pH(表5)发现:不管初始 pH呈偏酸性或偏碱性,其木质素降解后培养液的终 pH都有转为中性的趋势。初步断定各菌株在木质素降解过程中有自动调节 pH的功能,以保证其最有效地发挥木质素降解能力。

表4 不同初始pH时的菌株木质素降解率Table 4 Lignin degradation rate by bacteria strains at different initial pH values %
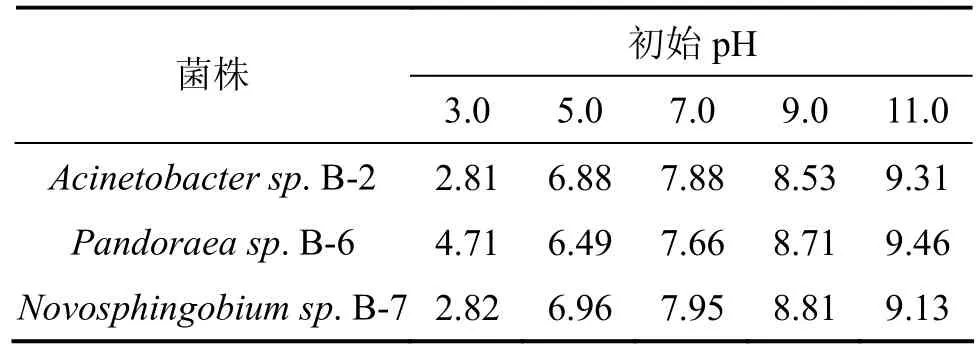
表5 菌株木质素降解后的最终pHTable 5 Final pH after lignin degradation by bacteria strains
2.8 摇床转速对3株菌木质素降解的影响
改变摇床转速,从氧气和营养物质的传质方面考察微生物的生长及其生理特性。分别在60,120,180和240 r/min 4种转速下培养菌株并检测其木质素降解性能。由图5可见:3株菌摇床培养的木质素降解效果明显好于静止培养时的降解效果;而在振荡培养时,转速为120 r/min时木质素的降解已经饱和。过快的振荡可能影响了菌体的正常生长并使得其与木质素紧密结合变得困难,从而阻碍了菌株对木质素的降解。120 r/min的摇床转速可以有效地促进从培养基到菌体的氧气和营养物质的传递,对3种菌的生长及木质素降解是适当的。
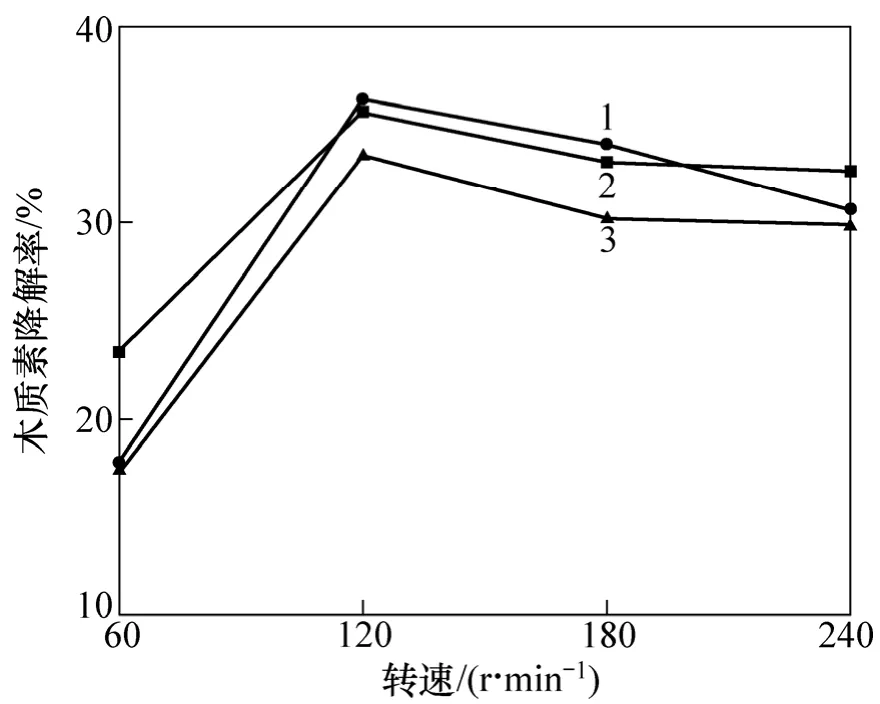
图5 摇床转速对降解木质素的影响Fig.5 Effects of rotation speed on lignin degradation by bacteria strains
3 结论
(1) Acinetobacter sp. B-2,Pandoraea sp. B-6和Novosphingobium sp. B-7能使苯胺蓝和RB亮蓝平板脱色,在无木质素诱导物的情况下具有产木质素降解酶的能力。
(2) 第5天时,3株细菌对木质素的降解基本趋于稳定,具有较快的降解速度,降解效率比目前报道的多数菌种的降解效果好。
(3) 采用单因素实验对 3株细菌进行了木质素降解条件的调控研究,初步确定了3株菌适宜的降解条件。对Acinetobacter sp. B-2,氮源为硝酸铵,氮源浓度为0.01 mol/L,培养温度为30 ℃,初始pH=7.0,摇床转速为120 r/min;对Pandoraea sp. B-6,氮源为磷酸氢二铵,氮源浓度为0.03 mol/L,培养温度为30℃,初始 pH=7.0,摇床转速为 120 r/min;对Novosphingobium sp. B-7,氮源为硝酸铵,氮源浓度为0.01 mol/L,培养温度为30 ℃,初始pH为5.0,摇床转速为120 r/min。在适宜的降解条件下,3株菌第3天降解率均可达到30%~35%,具有较强的木质素降解能力。
[1] Sjostrom E. Wood chemistry, fundamentals and application[M].New York/London: Academic Press, 1993: 107-121.
[2] Kirk T K, Schultz E, Connors W J, et al. Influence of culture parameters on lignin metabolism by Phanerochaete chrysosporium[J]. Archieve of Microbiology, 1978, 117:277-285.
[3] 李翠珍, 文湘华. 白腐真菌 F2的生长及产木质素降解酶特性的研究[J]. 环境科学学报, 2005, 25(2): 226-231.LI Cui-zhen, WEN Xiang-hua. Characterization of growth and ligninolytic enzymes production of a white rot fungus F2[J].Acta Scientiae Circumstantiae, 2005, 25(2): 226-231
[4] 李慧蓉. 白腐真菌生物学和生物技术[M]. 北京: 化学工业出版社, 2005: 10-30.LI Hui-rong. Biology and biotechnology of white rot fungi[M].Beijing: Chemical Industry Press, 2005: 10-30.
[5] 黄丹莲, 曾光明, 黄国和, 等. 白腐菌固态发酵条件最优化及其降解植物生物质的研究[J]. 环境科学学报, 2005, 25(2):232-237.HUANG Dan-lian, ZENG Guang-ming, HUANG Guo-he, et al.Optimum conditions of solid-state fermentation for white-rot fungi and for It’s degrading straw[J]. Acta Scientiae Circumstantiae, 2005, 25(2): 232-237.
[6] 陈跃辉. 三国吴简腐蚀斑微生物的分离鉴定及其木质素降解性能研究[D]. 长沙:中南大学冶金科学与工程学院, 2009:13-15.CHEN Yue-hui. Identification of microorganisms isolated from erosive bamboo slips Kingdom Wu and characterization of lignin degradation[D]. Changsha: Central South University. School of Metallurgy Science and Technology, 2009: 13-15.
[7] Delneri D, Degrassi G, Rizzo R, et al. Degradation of trans-ferulic and p-coumaric acid by Acinetobacter calcoaceticus DSM 586[J]. Biochimica et Biophysica Acta, 1995, 1244:363-367.
[8] Vasudevan N, Mahadevan A. Degradation of lignin and lignin derivatives by Acinetobacter sp.[J]. Journal of Applied Bacteriology, 1991, 70: 169-176.
[9] Siddique T, Benedict C O, Arshad M. Biodegradation kinetics of endosulfan by fusarium ventricosum and a Pandoraea Species[J].Agric Food Chem, 2003, 51(27): 8015-8019.
[10] Stolz A. Molecular characteristics of xenobiotic-degrading sphingomonads[J]. Appl Microbiol Biotechnol, 2009(81):793-811.
[11] 蔡磊, 尹峻峰, 杨丽萍, 等. 几种简便的木质素降解真菌定性筛选方法[J]. 微生物学通报, 2002, 29(1): 67-69.CAI Lei, YIN Jun-feng, YANG Li-ping, et al. Several qualitative methods for the screening of fungi to decompose lignin[J].Microbiology China, 2002, 29(1): 67-69.
[12] Archibald F S. A new assay for lignin-type peroxidases employing the dye Azure B[J]. Appl Environ Microbiol, 1992,58(9): 3110-3116.
[13] 康从宝, 李清心, 刘瑞田, 等. 一株白腐菌产生的漆酶对 RB亮蓝的脱色作用[J]. 应用与环境生物学报, 2002, 8(3):298-301.KANG Cong-bao, LI Qing-xin, LIU Rui-tian, et al.Decolorization of remazol brilliant blue R by laccase produced from a white rot fugus[J]. Chin J Appl Environ Biol, 2002, 8(3):298-301.
[14] Ramachandra M, Crawford D L. Hertel G. Characterization of an extracellular lignin peroxidase of the lignocellulolytic actinomycete Streptomyces viridosporus[J]. Applied and Environmental Microbiology, 1998(54): 3057-3063.
[15] Ferraz A, Duran N. Lignin degradation during softwood decaying by the ascomycete Chrysonilia Sitophila[J].Biodegradation, 1995, 6(4): 265-274.
[16] Dey S, Malti T K, Bhattacharyya B C. Production of some extracellular enzymes by a lignin peroxidase-producing brown-rot fungus and its comparative abilities for lignin degradation and dye decolorization[J]. Applied and Environmental Microbiology, 1994, 60(11): 4216-4218.
[17] 习兴梅, 曾光明, 郁红艳, 等. 黑曲霉Aspergillus niger木质纤维素降解能力及产酶研究[J]. 农业环境科学学报, 2007, 26(4):1506-1511.XI Xing-mei, ZENG Guang-ming, YU Hong-yan, et al.Lignocelluloses degrading ability of Aspergillus niger and the enzyme production[J]. Journal of Agro-Environment Science,2007, 26(4): 1506-1511.
[18] Toumela M, Vikman M, Hatakka A, et al. Biodegradation of lignin in a compost environment: A review[J]. Bioresource Technology, 2000, 72: 169-183.
[19] 孙先锋, 张志杰, 崔红军. 造纸黑液木质素降解微生物的分离和降解特性研究[J]. 环境工程, 2002, 20(3): 78-80.SUN Xian-feng, ZHANG Zhi-jie, CUI Hong-jun. Study on isolation of lignin-degradation microorganisms of pulping liquor and degradation characteristics[J]. Environmental Engineering,2002, 20(3): 78-80.
[20] 罗宇煊, 张甲耀, 管筱武, 等. 嗜碱细菌降解木质素的复合碳源共代谢研究Ⅰ: 复合碳源组合方式及氮源的选择[J]. 城市环境与城市生态, 2000, 13(2): 8-10.LUO Yu-xuan, ZHANG Jia-yao, GUAN Xiao-wu, et al.Research of compounded carbons cometabolism of alkaliphilic ligninolytic bacteria Ⅰ: Selections of compounded carbons and nitrogen sources[J]. Urban Environment and Urban Ecology,2000, 13(2): 8-10.
[21] 毕鑫, 路福平, 杜连祥. 白腐菌木素过氧化物酶发酵条件及其酶液对稻草降解的研究[J]. 纤维素科学与技术, 2002, 10(4):41-48.BI Xin, LU Fu-ping, Du Lian-xiang. Optimum conditions for production of lignin peroxidase and degrading rice straw with crude enzyme of LiP[J]. Journal of Cellulose Science and Technology, 2002, 10(4): 41-48.
[22] 喻国策, 文湘华, 李东锋, 等. 黄孢原毛平革菌在多种氨氮浓度下木质素降解酶的产生[J]. 环境科学学报, 2003, 23(6):802-806.YU Guo-ce, WEN Xiang-hua, LI Dong-feng, et al. Formation of the ligninolytic enzymes by Phanerochaete chrysosporium under various ammonium nitrogen concentrations[J]. Acta Scientiae Circumstantiae, 2003, 23(6): 802-806.
- 中南大学学报(自然科学版)的其它文章
- 有菌和无菌体系下磁黄铁矿氧化的电化学研究
- 金属Mo的价键结构随温度和压力的变化

