连用DCS与显微方法的冷冻干燥系统及实验研究
王海燕 伦照荣 吕树申
(1 中山大学化学与化学工程学院 广州 510275; 2 中山大学生命科学学院 广州 510275)
冷冻干燥技术,简称冻干,就是将含有水分的物质,预先通过降温冻结成固态,然后在真空低温的条件下,通过对冻结物质加热使其中的水分直接升华和解吸出去,从而得到干物质的技术[1-3]。冷冻干燥法,由于在低温下进行,物质的理化活性能得到有效保护,干燥后的物质疏松多孔,复水后能迅速恢复原来的状态,且冻干过程能排除95%~99%的水分,使干燥后的物质可以在室温下长时间保存,大大减少了储存和运输的不便[1-3]。因此,冷冻干燥技术广泛用于保存热敏性生物样品,如蛋白质、疫苗及微生物等。
冷冻干燥过程包括预冻、升华干燥和解吸干燥三个阶段。预冻是为了在低温下将物料中游离态的水冻结成冰,以利于水分的升华,是干燥的准备阶段。尽管如此,预冻却是整个冻干过程中最为关键的一步,因为冰晶在预冻过程中形成,且预冻过程中的诸多因素不仅影响冰晶大小和形状,而且影响后续的升华干燥速率以及冻干产品质量[4,5]。例如,慢速冷冻时,形成的冰晶尺寸较大,冻干产品的孔径较大,升华阻力也较小;快速冷冻时,形成较多细小的冰晶,导致冰晶表面积增大,使升华阻力增大。
用于物质冻结特性和微观结构研究的最常用的方法是差示扫描量热法(differential scanning calorimetry, DSC)和显微镜观察法。根据DSC和显微镜的工作原理和特点,将其与冷冻干燥设备的功能有机结合,研制了一种连用DSC与显微镜观察的冷冻干燥系统,并利用此系统,选择保护剂海藻糖(trehalose, TR)和聚乙烯醇(polyvinyl alcohol,PVA),对TR/PVA水溶液进行冷冻干燥实验,考察在不同冷冻速率和冷冻溶液用量等条件下对溶液冻结特性和升华过程的影响。
1 实验仪器、材料和方法
1.1 冷冻干燥系统
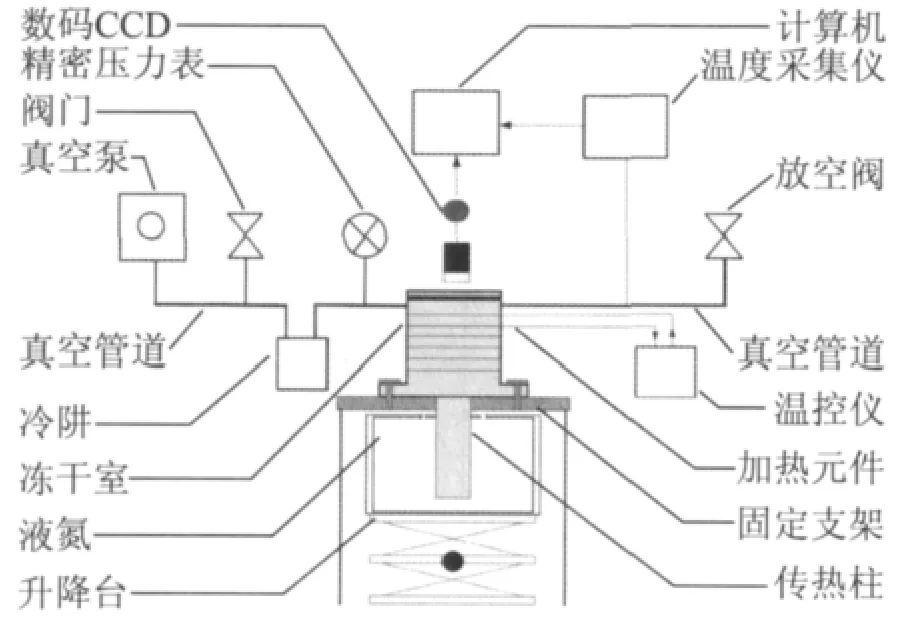
图1 冷冻干燥系统示意图Fig.1 Schematic of freeze-drying system
如图1所示,该冷冻干燥系统主要由冷冻系统、真空系统、DSC热分析系统、显微摄像系统和计算机组成。其中,冷冻系统包括冻干室、加热元件和制冷元件,冻干室为一密闭容器,容器壁上设有透明部分,加热元件和制冷元件设于冻干室上;冻干室连接真空系统;DSC热分析系统设于冻干室内部(未图示);显微摄像系统设于冻干室外部,可透过冻干室盖上的透明部分观察内部样品的微观结构;DSC热分析系统和显微摄像系统分别与计算机连接[6]。制冷元件包括传热棒和液氮,冻干室的底部与传热棒一端连接,传热棒的另一端浸入液氮中,从而将冷量传至冻干室,并以此对冻干室内样品进行降温和冷冻。液氮设于升降台上。传热棒浸入液氮中的深度可以通过升降台自由调节。上面所述的加热元件包括电加热丝和温控器,电加热丝均匀安装在冻干室容器外表面,通过温控器根据设定的温度程序来调节加热功率,为冻干室内样品提供热源。
1.2 实验材料
选择海藻糖(AR, Sigma)和聚乙烯醇(Mw=68000, Sigma),配制一定浓度的TR/PVA混合水溶液,使海藻糖(TR)的质量浓度为10%,聚乙烯醇(PVA)的质量浓度为1%。分别取0.3mL和1.5mL的TR/PVA溶液装入生物冻存管中,置于冷冻干燥系统的冻干室中进行冷冻干燥实验。
1.3 实验方法
1.3.1 DSC校准
对冷冻干燥系统的DSC测量,采用超纯水对熔点Tm(℃) 和结晶潜热ΔHf(334J/K) 进行两点校准,降温速率为1℃/min,升温速率为0.02℃/min,校准方法如文献[7]所述。
1.3.2 冷冻干燥实验
1) 预冻过程。将装有TR/PVA溶液的冻存管放入冷冻干燥系统的冻干室中进行预冻实验。首先将溶液在20℃恒温保持约10min以除去热历史,然后分别采用以下2种冷冻方案进行预冻,即:以1℃/min冷冻至-40℃并保持约1h(慢速);直接投入液氮中,冷冻速率约为280℃/min,然后转移至-40℃冻干室中放置约1h (快速)。
2) 冷冻干燥。将通过上述冷冻方案冻结的TR/PVA溶液置于-40℃冻干室中,待稳定后开始抽真空使其升华干燥,升华温度为-10℃,升华时间不少于20h,升华结束后在20℃进行解吸干燥。
1.3.3 冻干溶液检测
1) 冻干溶液显微镜观察 采用Nikon倒置生物显微镜观察冻干溶液的表面和截面,并利用Image Pro 6.0图像分析软件测量并计算冻干溶液的孔径,计为预冻结束后冻结溶液中的冰晶尺寸。
2) 冻干溶液孔隙率测定 从冻干溶液上剪取一块,测量其厚度,计算其体积为V,质量为W1,将其浸入无水乙醇中至完全饱和,取出称其质量为W2,无水乙醇的密度极为ρ,那么冻干溶液的孔隙率 P = [(W2-W1)/ρ]/V。
2 实验结果与讨论分析
2.1 冷冻条件对溶液冻结特性的影响
经不同预冻方案的TR/PVA冻结溶液在升温过程中的DSC曲线如图2所示。从图中可以看出,加快冷冻速率,并不影响冻结溶液的熔融温度,但是冻结溶液的熔融峰面积却因冷冻速率的加快而下降(表1),这表明在先前的预冻过程中,加快冷冻速率,使溶液冻结不完全,使冻结水质量分数,即冻结水占溶液中总含水量的质量分数下降。冻结水质量分数可以通过式(1)进行估算:

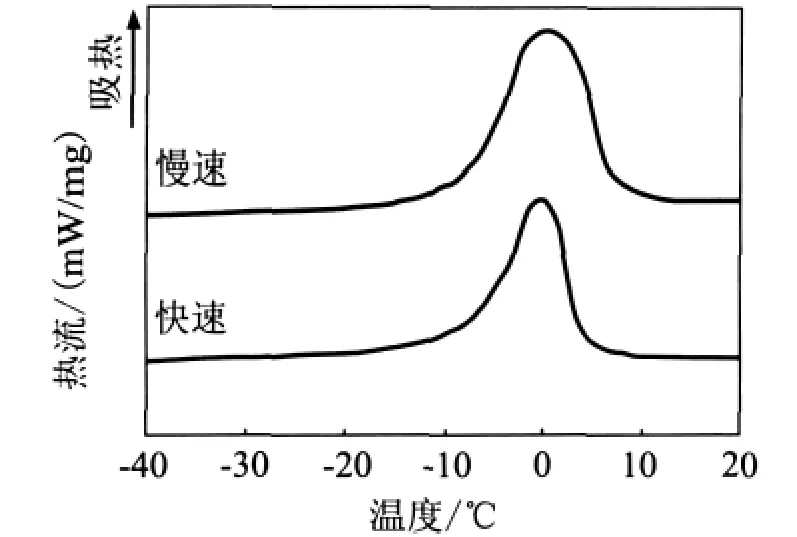
图2 不同冷冻方案所得TR/PVA冻结溶液的升温DSC曲线Fig.2 DSC thawing curves of the frozen TR/PVA aqueous solution obtained from different freezing protocols
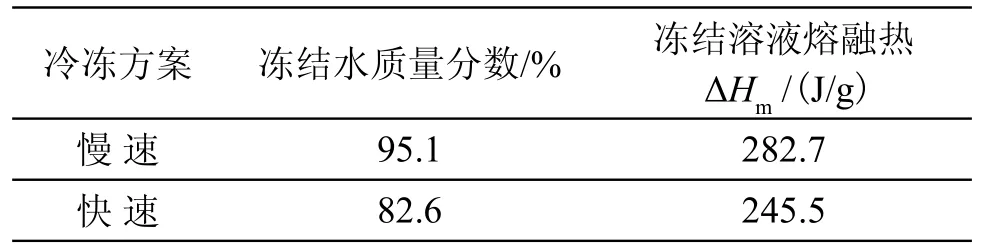
表1 冷冻速率对TR/PVA溶液冻结特性的影响Tab.1 Effects of cooling rate on the freeze parameters of the TR/PVA aqueous solution
2.2 冷冻条件对冻干溶液结构的影响
冷冻条件对TR/PVA冻干溶液的结构和形貌的影响,如图3所示。其中,(A, a)是用量为0.3mL、通过慢速冷冻方案所得冻干溶液的上表面和断面的显微镜照片,(B,b)是用量为1.5mL、通过慢速冷冻方案所得冻干溶液的上表面和断面的显微镜照片,(C,c)是用量为0.3mL、通过慢速冷冻方案所得冻干溶液的上表面和断面的显微镜照片。从图中可以看出,经冷冻干燥的TR/PVA冻干溶液内部孔洞均匀,互相连通,这是在预冻阶段形成的冰晶完全升华后留下的多孔通道。比较(A,a)和(C,c)可以看出,加快冷冻速率,所得冻干溶液的孔径减小(表2),网状孔洞变得致密,尽管孔隙率受冷冻速率的影响很小 (表2),这表明在先前的预冻过程中,加快冷冻速率使溶液过冷度增大,使成核点增多,且形成的细小冰晶来不及长大[8,9],因此在冻干溶液中留下致密、尺寸很小的多孔通道。
众所周知,在预冻阶段,冷冻速率会影响溶液冻结时形成冰晶的尺寸,进而影响冻干产品的内部结构,包括孔隙率和孔径尺寸。在实验中也发现使用不同体积的TR/PVA溶液进行冷冻干燥,所得冻干样品的内部结构会有所差异。如图3(A,a)和(B,b)所示,采用相同的冷冻方案,冷冻速率都为1℃/min,属于慢速冷冻,当增加冷冻溶液的体积时,冻干溶液的孔径尺寸却随之减小,孔洞也因而变得致密。这主要是因为在先前的预冻过程中,增加冷冻溶液的体积,使溶液的过冷度增大,导致成核点增多,使冰晶尺寸减小,从而使冻干溶液的孔径尺寸下降。

图3 不同冷冻条件所得TR/PVA冻干溶液的表面(A-C)及断面(a-c)显微镜照片Fig.3 Microphotos of the surface (A-C) and cross-section(a-c) of the freeze-dryed TR/PVA solution obtained from different freezing conditions

表2 冷冻速率对TR/PVA冻干溶液结构的影响Tab.2 Effects of cooling rate on the texture of the freezingdryed TR/PVA solution
2.3 冷冻条件对升华率的影响
冷冻条件不同,溶液冻结形成冰晶尺寸就不同,后续的升华速率也会不同。尽管冰晶尺寸与升华率的关系还没有测量到,但是根据努森分子扩散理论[1]可以初步判断,加快冷冻速率和增大冷冻溶液体积,会使冰晶尺寸减小,导致升华阻力增大。在实验过程中也发现,采用相同的升华干燥时间,即升华20h后,只有用量为0.3mL、采用慢速冷冻所得的冻结TR/PVA溶液才可以升华完全。继续升华10h后,用量为0.3mL、采用快速冷冻所得的冻结TR/PVA溶液也可以升华完全。而用量为1.5mL的TR/PVA溶液,无论采用快速冷冻还是慢速冷冻,升华总时间长达30h后也未能升华完全。因此,为了提高升华率,优化冷冻条件,选择合适的冷冻速率和冷冻体积是非常有必要的,以便将冰晶尺寸控制在一个合适的范围。
升华干燥结束后,还需要进行解吸干燥以去除物料中非冷冻水。冰晶升华后留下的多孔通道对解吸干燥速率也有较大的影响。因此,优化选择冷冻条件时,只考虑升华速率是不够的,还必须考虑对解吸干燥的影响。
3 总 结
通过研制的连用DSC与显微方法的冷冻干燥系统,对保护剂海藻糖和聚乙烯醇(TR/PVA)水溶液进行冷冻干燥实验,考察了冷冻速率和冷冻溶液的用量等冷冻条件对溶液冻结特性和升华干燥过程的影响。溶液冻结后形成的冰晶在升华干燥结束后留下多孔通道,因此可以利用显微镜研究多孔冻干溶液的微观形貌,以判断溶液冻结后冰晶的形成情况。冰晶的大小不仅受冷冻速率的影响,而且与溶液体积有关,加快冷冻速率会导致不完全冷冻并形成大量细小的冰晶,增加溶液体积也会引起过冷度增大,使冰晶尺寸减小,导致升华阻力增大,使升华速率减慢。
本文受中山大学实验室开放基金(KF200919)项目资助。(The project was supported by the Opening Fund of Laboratory, Sun Yat-sen University (No. KF200919).)
[1] Hottot A, Vessot S, Andrieu J. Freeze drying of pharmaceuticals in vials: Influence of freezing protocol and sample configuration on ice morphology and freezedryed cake texuture [J]. Chem. Eng. Process., 2007, 46:666-674.
[2] Hottot A, Vessot S and Andrieu J. A direct characterization method of the ice morphology: Relationship between mean crystals size and primary drying times of freezedrying processes [J]. Drying Technol., 2004, 22(8):2009-2021.
[3] Passot S, Trelea I C, Marin M, et al. Effect of controlled ice nucleation on primary drying stage and protein recovery in vials cooled in a modified freeze-drying [J]. J.Biomech. Eng., 2009, 131: 074511-074515.
[4] 李云飞, 华泽钊, 傅行军. 降温速率对食品材料冻干特性的影响[J]. 制冷学报, 2002, 4: 10-12. (Li Yunfei, Hua Zezhao, Fu Xingjun. The effects of freezing rates on the sublimation of foods [J]. Journal of Refrigeration, 2002, 4:10-12.)
[5] 苏树强, 丁志华, 肖洪海, 等. 溶液类样品冻干过程中隔板预冻特性分析[J]. 低温工程, 2004,1:39-43.(Su Shuqiang, Ding Zhihua, Xiao Honghai, et al. Study on the solution freezing on the cooling shelf during lyophilization[J]. Cryogenics, 2004, 1: 39-43.)
[6] 王海燕, 吕树申, 伦照荣. 具有DSC及微结构观察功能的真空冷冻干燥装置. 中国, ZL201020155579.6 [P].2010-10-27. (Wang Haiyan, Lv Shushen, Lun Zhaorong.A freeze-drying experimental system coupled by DSC and Microscopy. China, ZL201020155579.6 [P]. 2010-10-27.)
[7] 王海燕, 吕树申. 一种可视化DSC装置的设计与校准[J].工程热物理学报, 2010, 31(4): 682-684. (Wang Haiyan,Lv Shushen. Design and calibration of an optical DSC system [J]. Journal of Engineering Thermophysics, 2010,31(4): 682-684.)
[8] Wang H Y, Inada T, Funakoshi K, et al. Inhibition of nucleation and growth of ice by poly(vinyl alcohol) in vitrification solution [J]. Cryobiology, 2009, 59:83-89.
[9] Wang H Y, Lv S S, Lun Z R. Glass transition behavior of the vitrification solutions containing propanediol, dimethyl sulfoxide and polyvinyl alcohol [J]. Cryobiology, 2009,58(1): 115-117.

