几种不同方法检测抗蛔虫抗体的建立
何光志,田维毅*,高 英,王 平,王文佳,奚 锦,俞 琦,曹 峰,黄 高,蔡 琨,韩 洁,王乾宇,刘安胜,安传伟,查高武,张 鹏
(1贵阳中医学院,贵阳550002;2遵义医学院附属医院;3天桥乡畜牧兽医水产站;4乌沙镇格里小学;5捧乍中学)
蛔虫病呈世界性分布,已成为公共卫生问题之一[1,2]。相对其他虫种来说,蛔虫的免疫诊断技术研究较少,发展也较缓慢。近年研究发现,宿主感染蛔虫后能够引起免疫反应,所以蛔虫感染的免疫学诊断成为可能[3~6]。2009年12月 ~2010年10月,本研究用蛔虫虫卵蛋白可溶性抗原,建立了间接血凝试验(IHA)、间接ELISA和琼脂扩散试验(AGP)方法检测采自农村小学生的血清样本,并对这方法进行敏感性比较,以探讨这些方法在诊断蛔虫感染的应用价值。
1 材料与方法
1.1 试剂 鼠抗人IgG-HRP,购自上海郎顿生物科技有限公司;TMB底物溶液,购自北京天根生物公司;其他产品购自上海华美公司;戊二醛,购自河南省华龙药业有限公司;鞣酸,购自上海华美化工有限责任公司;胎牛血清,购自杭州四季青公司;健康绵羊全血,采自贵阳医学院实验动物中心;琼脂糖,购于北京华美生物有限公司。
1.2 血清样本 蛔虫阳性血清、蛔虫阴性血清和人的钩虫、鞭虫和蛲虫阳性血清各10份,由贵阳中医学院微生物及寄生虫实验室保存;小学生血清样本,采自贵州5个县农村小学生,共100份。
1.3 方法
1.3.1 蛔虫虫卵蛋白可溶性抗原的制备 取新鲜的雌性蛔虫进行解剖,在蛔虫近阴门1/3处,用小剪刀剖开子宫,用生理盐水洗涤数次,收集虫卵用尼龙绢过滤,获得纯净的蛔虫虫卵,将虫卵置预冷的(-70℃)研钵内,液氮研磨至粉沫状,然后加入适量生理盐水,振荡混匀,4℃冷浸过夜,然后于 4℃,10 000 r/min离心30min,取上清液即得蛔虫虫卵蛋白可溶性抗原,用紫外分光光度计测定蛋白质的含量,分装暂存于-20℃备用。
1.3.2 间接ELISA方法的建立
1.3.2.1 最佳包被浓度及血清最佳稀释倍数的确定将蛔虫虫卵蛋白可溶性抗原用0.05 mol/L碳酸盐(pH9.6)稀释成20、10、5、1、0.5、0.1 μg/ml 6 个浓度包被酶联板,100 μl/孔,每个浓度包被1列。于37℃温1 h后,放4℃冰箱过夜,取出用0.05%Tween-20(PBS-T)洗涤3次,5min/次,然后在每孔加入1%牛血清白蛋白(BSA)100 μl封闭液,37℃封闭1 h。然后将阳性血清和阴性血清在酶标板上1∶20、1∶40、1∶80、1∶160、1∶320 倍比稀释,分别加入酶标板中,100 μl/孔,37℃反应1 h后,洗涤3次,5min/次。用1%BSA封闭液作1∶8 000稀释鼠抗人IgG-HRP(按说明书使用)加入酶联板,100 μl/孔,37 ℃ 反应 1 h,用0.05%PBS-T 洗涤 3 次,5min/次,加入底物溶液(TMB)100 μl/孔,反应 15min,最后加入 100 μl 2 mol/L硫酸终止反应,用酶标仪在490 nm波长下测定OD值。同时用健康人血清作方阵滴定。选择阳性血清与阴性血清OD490的比值(P/N)最大所对应的抗原、抗体稀释度作为判定标准。
1.3.2.2 ELISA方法建立 将蛔虫虫卵蛋白可溶性抗原以最佳包被浓度包被酶标板,100 μl/孔于37℃过夜,洗涤 3 次,每次 3min,晾干;加入 100 μl/孔封闭液,37℃温育1 h,然后将待检血清按最佳稀释倍数稀释后加入酶标板,100 μl/孔,37℃温育1 h,洗涤3次,晾干,加入最佳工作浓度的鼠抗人IgGHRP 100 μl/孔,37 ℃ 温育 1 h,洗涤 3 次,每次 3min,晾干,加入 TMB 底物 100 μl/孔,37 ℃ 反应 15min,最后加入100 μl 2 mol/L硫酸终止反应,用酶标仪测OD490值。
1.3.2.3 酶标二抗最佳工作浓度的确定 鼠抗人IgG-HRP 作 1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000和1∶16 000倍比稀释,通过检测已知阳性和阴性血清,来确定酶标二抗的最佳工作浓度。
1.3.2.4 ELISA阴阳性临界值的确定 取5份健康人血清进行ELISA检测。同时设阳性和阴性对照。计算健康人血清OD490的平均值(±s)和标准偏差(SD),求出阴阳临界限±s+3SD。
1.3.2.5 特异性试验 用建立的ELISA方法检测蛔虫阳性血清、阴性血清各10份,其他寄生虫病阳性血清(钩虫、鞭虫和蛲虫)阳性血清各10份,鉴定本方法特异性。
1.3.3 IHA 方法的建立
1.3.3.1 绵羊红细胞的醛化 经静脉采绵羊全血,5 000 r/min 离心洗涤3 次,10min/次,以 PBS(0.01 mol/L,pH7.4)配成2.5%的细胞悬液。取9倍体积的细胞悬液与1倍体积的1%戊二醛溶液混合,在室温下缓慢搅拌1 h,5 000 r/min离心洗涤3次,10min/次,最后用含有0.1%NaN3的PBS将绵羊红细胞稀释成1%的细胞悬液。
1.3.3.2 醛化红细胞的致敏 将醛化的细胞悬液用PBS稀释成10倍体积的细胞悬液,再与等体积制备的蛔虫虫卵蛋白可溶性抗原混合,于室温条件下搅拌2 h,离心洗涤,用含 0.1%NaN3、1%BSA 的PBS洗涤,再用含0.1%NaN3、1%BSA 的 PBS配成1%的细胞悬液,即为蛔虫间接血凝诊断试剂。
1.3.3.3 IHA最佳工作条件的确定 取蛔虫间接血凝诊断试剂与蛔虫阳性血清进行IHA试验。①采用0.01%、0.02% 和 0.04% 的致敏红血球浓度进行IHA,确定最佳反应浓度;②在最佳反应浓度的条件下,采用4℃、20℃和37℃进行IHA,确定最佳反应温度;③在最佳反应浓度和最佳反应温度的条件下采用30min、45min和60min进行IHA,确定最佳反应时间。以阴性和阳性反应界限明显作为判断标准。
1.3.3.4 特异性试验 采用建立的IHA检测蛔虫阳性血清、阴性血清各10份,其他寄生虫病阳性血清(钩虫、鞭虫和蛲虫)阳性血清各10份,鉴定本研究制备的诊断试剂的特异性。
1.3.4 AGP的建立 以1.3.1制备的蛔虫卵可溶性抗原,采用蛔虫阳性血清、阴性血清、钩虫、鞭虫和蛲虫阳性血清各10份进行AGP,验证重组蛋白作为抗原检测蛔虫抗体是否具有特异性。
1.3.5 临床血清样本的检测 采用本实验建立的间接ELISA、IHA和AGP方法对100份人血清样本进行检测,这些血清样本对应粪便样本在采血时现场进行粪检虫卵法确定阳性率为2.0%。
2 结果
2.1 应用间接ELISA的建立
2.1.1 蛔虫虫卵蛋白可溶性抗原和血清最佳工作浓度确定 用本实验室保持的蛔虫阳性血清和阴性血清进行方阵滴定,重复3次,测得的平均OD490值分别见表1和表2。可见当蛔虫虫卵蛋白可溶性抗原浓度为1 μg/ml、抗蛔虫抗体为1∶160 时,阳性血清 OD490值达 0.364,而阴性血清 OD490值为 0.025,阳性孔显色明显,阴性孔不显色。因此,确定抗原包被浓度为1 μg/ml和抗体1∶160倍稀释为ELISA的最佳工作浓度。
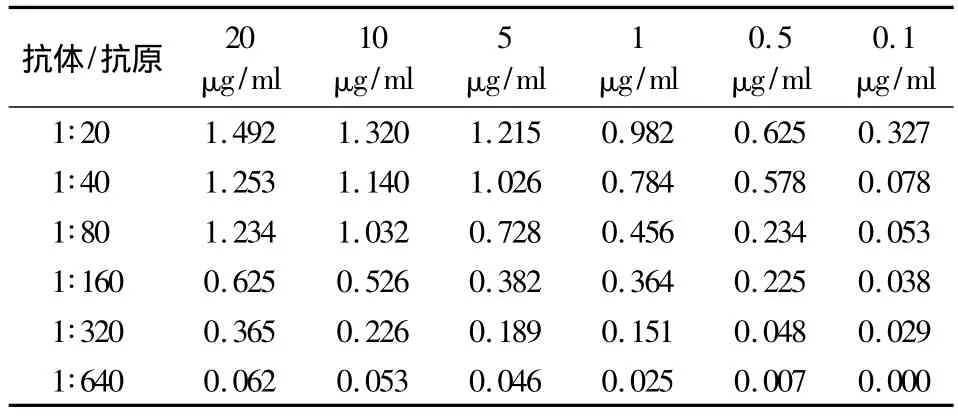
表1 阳性血清ELISA方阵滴定结果的平均OD值

表2 阴性血清ELISA方阵滴定结果的平均OD值
2.1.2 酶标二抗最佳工作浓度的确定 蛔虫阳性对照OD490大于1.0,在阴、阳性对照差异最大时,酶标二抗的稀释浓度即为最佳工作浓度,由表3看出1∶8 000的稀释为酶标二抗的最佳工作浓度。
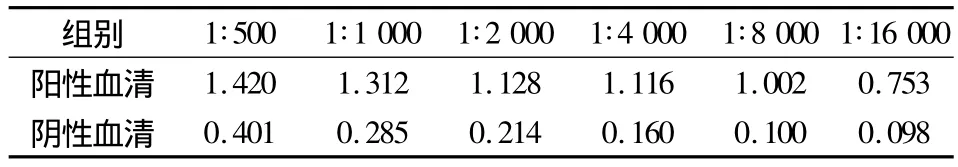
表3 酶标二抗最佳工作浓度结果
2.1.3 临界值的确定 采5份健康人血清用ELISA法进行了检测,每个样品重复1次,结果分别为 0.129、0.116、0.120、0.150、0.124,阳性对照为0.902,阴性对照为 0.015,以(0.128+3 ×0.028)为临界值,计算出临界值0.212。
2.1.4 特异性试验 用本试验建立的ELISA方法检测10份蛔虫阳性血清全为阳性,蛔虫阴性血清、钩虫、鞭虫和蛲虫阳性血清各10份,结果全为阴性,说明本方法具有很好的特异性。2.2 IHA检测蛔虫抗体的建立
2.2.1 IHA最佳工作条件的确定 取本实验制备的蛔虫IHA诊断试剂与已知蛔虫阳性血清和阴性血清进行IHA试验,经过测定,采用0.1%的致敏红血球、20℃作用45min为IHA的最佳反应条件。
2.2.2 特异性试验 取10份蛔虫阳性血清,10份蛔虫阴性血清、钩虫、鞭虫和蛲虫阳性血清各10份分别与本实验制备的IHA诊断试剂进行特异性试验,测定结果8份蛔虫阳性血清全为阳性,阳性率为80.0%(8/10),其余全为阴性。
2.3 AGP的建立及特异性试验 取10份蛔虫阳性血清,蛔虫阴性血清、鞭虫、钩虫和蛲虫阳性血清各10份分别与蛔虫虫卵蛋白可溶性抗原进行特异性试验,测定结果表明5份蛔虫阳性血清,阳性率为50.0%(5/10),其余全为阴性。
2.4 几种方法的敏感性比较 将100份血清样本,用本实验建立的间接ELISA方法、IHA和AGP比较这些方法的敏感性,阳性率分别为 10.0%(10/100)、7.0%(7/100)、4.0%(4/100),其中 AGP为阳性的血清样本间接ELISA方法和IHA试验检测结果全为阳性。
3 讨论
蛔虫病的准确诊断是开展蛔虫生物学及防治等研究的基础性工作。相对其他虫种来说,蛔虫病免疫诊断技术研究较少。常常采用粪便的直接涂片法或饱和盐水漂浮法等简单的方法结合临床症状对蛔虫作出诊断。但由于蛔虫具有特殊生活史,当其通过粪便检查检出虫卵时,宿主往往已经被幼虫在肝脏、肺脏器官内移行而造成了损害,而且粪便检虫卵法检出率低,也容易漏检。值得注意的是,蛔虫在光学显微镜下的形态很难和其他寄生虫虫卵区别,所以传统诊断方法的敏感性和特异性都很差。因此,建立一种敏感而又特异的检测方法对控制蛔虫病具有重要意义。
本研究用蛔虫虫卵可溶性蛋白作为包被抗原,建立了蛔虫特异性抗体的间接ELISA检测方法,对100份血清进行临床检测,其阳性检出率为10.0%;将蛔虫虫卵可溶性蛋白标记在免疫红血球上建立了IHA检测蛔虫抗体,阳性检出率为7.0%;以重组蛋白作为抗原,建立AGP,其阳性检出率为4.0%。实验结果表明间接ELISA比AGP和IHA敏感性较强,因此AGP和IHA在蛔虫病的早期在诊断中容易出现漏检,研究结果提示间接ELISA在蛔虫阳性血清病的早期、快速诊断具有一定的应用价值,同时也表明了蛔虫虫卵可溶性抗原可用于蛔虫病的诊断和抗体检测。
ELISA方法是一种应用免疫学技术测定标本的方法,是将抗原或抗体吸附于固相载体,在载体上进行酶免疫反应,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。由于ELISA具有敏感性高、一次性检测样本多、试验时间短、易操作等特点,因此倍受青睐[7]。
[1]杨黎青.免疫学基础与病原生物学[M].北京:中国中医药出版社,2004:71-75.
[2]翁培兰,彭卫东.人蛔虫和猪蛔虫差异的比较研究[J].中国寄生虫学与寄生虫病杂志,2006,24(2):140-145.
[3]Urban JF Jr,Tromba FG.Development of immune responsiveness to Ascaris suum antigens in pigs vaccinated with ultraviolet-attenuated eggs[J].Vet Immunol Immunopathol,1982,3(4):399-409.
[4]Kelley GW,Nayak DP.Acquired immunity to migrating larvae of ascaris suum induced in pigs by repeated oral inoculations in infective eggs[J].J Parasitol,1964,50:499-503.
[5]Stankiewicz M,Jeska EL.Evaluation of pyrantel-tartrate abbreviated Ascaris suum infections for the development of resistance in young pigs against migrating larvae[J].Int J Parasitol,1990,20(1):77-81.
[6]Hill DE,Fetterer RH,Romanowski RD,et al.The effect of immunization of pigs with Ascaris suum cuticle components on the development of resistance to parenteral migration during a challenge infection [J].Vet Immunol Immunopathol,1994,42(2):161-169.
[7]邹艳波,迟秀娟,王芳.鼠疫间接血凝药盒制备技术探讨[J].中国地方病防治杂志,2006,21(1):27-29.

