OPN在喉癌组织中的表达变化及LV-shOPN对喉癌Hep-2细胞侵袭转移的影响
陈剑秋 ,朱敏辉,邱晓霞,夏思文,刘 达,陈世彩,郑宏良
(1济南军区总医院,济南250031;2第二军医大学附属长海医院)
95%的喉癌为鳞状细胞癌。复发和侵袭转移是喉癌患者死亡的主要原因。肿瘤的发生发展是一个多因素、多步骤和多基因参与的复杂过程。基因改变贯穿了肿瘤病变的全过程。因而,从基因水平控制喉癌的侵袭和转移,是提高疗效的关键。骨桥蛋白(OPN)是首先在骨基质中发现的一种分泌型钙结合磷酸化糖蛋白,其中含有特异的与细胞黏附有关的RGD序列,通过其受体整合素、CD44等来促进细胞的趋化、黏附、迁移和增殖,从而介导肿瘤细胞的侵袭转移[1]。RNA干扰(RNAi)是由内源性或外源性双链RNA诱发的在mRNA水平上的基因沉默机制,可以有效并特异地抑制靶基因的表达[2]。本研究首先观察了喉鳞状细胞癌(LSCC)组织中OPN的表达变化;然后通过RNAi技术下调喉癌Hep-2细胞中OPN的表达,观察该细胞增殖和侵袭能力的变化。现将结果报告如下。
1 资料与方法
1.1 临床资料 2003年1月~2005年12月经病理检查确诊的LSCC患者44例,男40例,女4例;年龄38~76岁。临床分期(2002年,UICC):Ⅰ期8例,Ⅱ期11例,Ⅲ期17例,Ⅳ期8例。肿瘤分化程度:高分化20例,中分化16例,低分化8例。肿瘤类型:声门上型14例,声门型25例,声门下型5例。所有患者术前未实施放疗和化疗。术中留取癌组织及癌旁正常组织(取自距癌1 cm处的喉组织,病理检查未见癌细胞浸润)。上述标本常规制作石蜡包埋切片,厚4 μm。
1.2 主要试剂及细胞株 即用型鼠抗人OPN单克隆抗体,DAB显色试剂盒,免疫组化SP染色试剂盒,GAPDH抗体,MTT试剂盒,细胞侵袭检测试剂盒。Hep-2喉癌细胞株,干扰OPN慢病毒载体(LV-shOPN)。
1.3 癌及癌旁正常组织中OPN的检测 标本切片采用免疫组化SP法染色,DAB显色,苏木素复染、脱水,树脂封固,镜下观察。细胞质中出现棕黄色颗粒者为OPN阳性细胞。细胞未染色为0分,黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比<5% 为0分、5% ~25%为1分、26% ~50%为2分、>50%为3分。上述2种分值的乘积≤3定为阴性、>3定为阳性。用已知阳性切片作阳性对照,PBS代替一抗作阴性对照。
1.4 Hep-2细胞培养及LV-shOPN转染 Hep-2细胞加入含10%胎牛血清的 DMEM,置37℃、5%CO2细胞培养箱中培养。取适量细胞接种在6孔板中至60% ~70%融合后转染LV-shOPN,培养24 h后更换新鲜培养基继续培养。LV-shOPN转染后细胞命名为Hep-2-LV-shOPN,转染空载体的细胞命名为Hep-2-LV-shNone。
1.5 细胞OPN检测 采用Western blot法。收集Hep-2细胞及转染72 h后的Hep-2-LV-shOPN、Hep-2-LV-shNone,PBS洗涤2次,离心弃上清,每孔加入0.2 ml细胞裂解液,冰浴30 min,4 ℃、12 000 g离心20 min,收集上清。取50 μg蛋白质加入2×上样缓冲液,经100℃、5 min变性后用10%的SDS-PAGE分离。蛋白质转至PVDF膜,用含5%脱脂奶粉的TBST缓冲液4℃封闭过夜。分别加入 OPN及GAPDH一抗,4℃过夜,TBST洗涤3次,加入二抗(Santa cruz),室温孵育1 h,TBST洗涤4次。加显色剂1 min,X线胶片曝光成像。图像用Quantity one 4.4软件进行定量分析。
1.6 细胞增殖活性检测 采用MTT法。收集培养1、2、3、4、5 d 的 Hep-2 细胞及转染 1、2、3、4、5 d 的Hep-2-LV-shOPN、Hep-2-LV-shNone,分别制成单细胞悬液,按5×103/孔接种于96孔板,每天各取3个复孔的细胞,用MTT法检测细胞增殖活性(用OD值表示)。
1.7 细胞侵袭力检测 采用Transwell小室实验。取Hep-2细胞及转染72 h后的Hep-2-LV-shOPN、Hep-2-LV-shNone。按照侵袭实验试剂盒说明,各设3个复孔。于Transwell小室的上室加入细胞1×106/孔(无血清培养基的单细胞悬液),下室加入完全培养基,培养24 h。培养结束后用棉拭子将Transwell上室细胞擦去,穿过聚碳酸酯膜的细胞用结晶紫染色,清水冲洗数次,空气干燥后显微镜下观察照相,10×20视野下随机选取5个视野计数细胞(代表细胞侵袭力),取均值。
1.8 统计学方法 采用SPSS15.0统计软件。数据比较用t检验、χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 OPN蛋白表达及其与LSCC临床病理参数的关系 LSCC组织和癌旁正常组织中OPN阳性表达率分别为 75.0%(33/44)、13.6%(6/44),两者相比,P<0.01。OPN的表达与LSCC临床分期、分化程度、淋巴结转移有关(P均<0.05),与患者年龄、性别、LSCC临床类型无关(P均>0.05),详见表1。
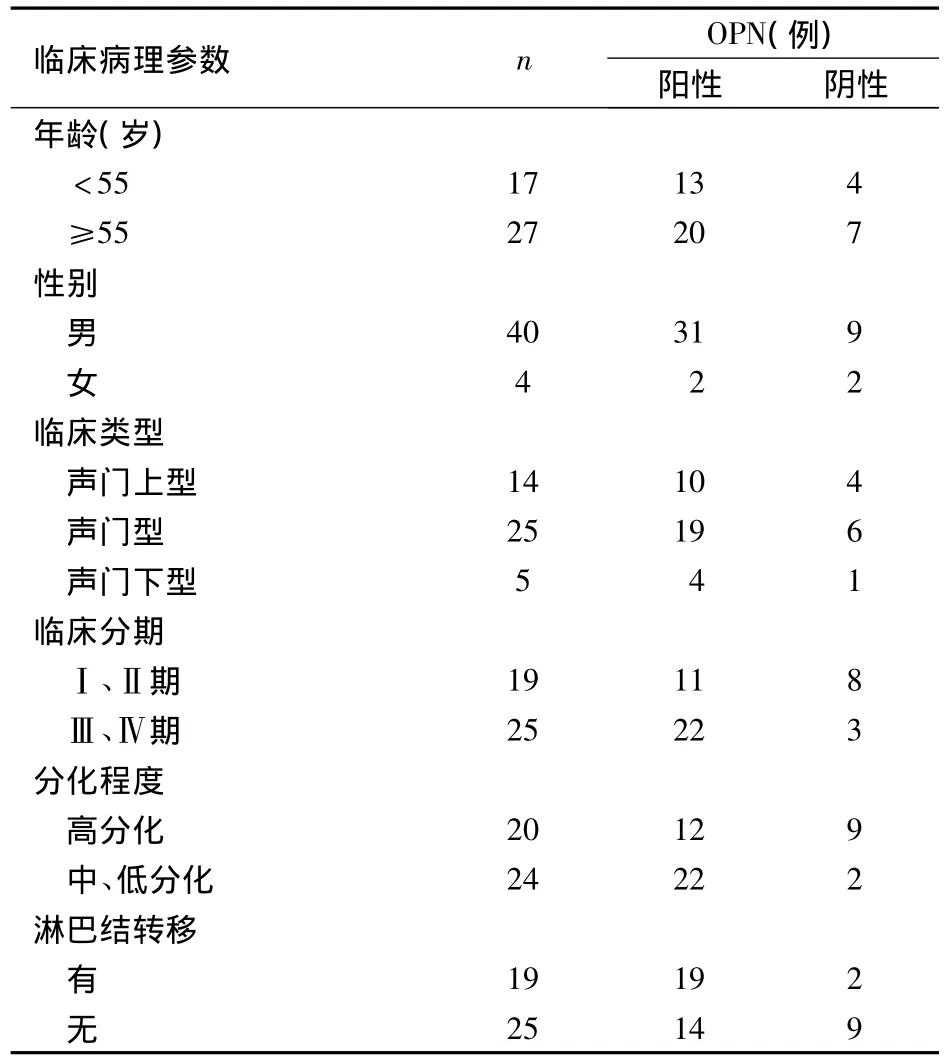
表1 OPN表达与LSCC临床病理参数的关系
2.2 Hep-2细胞及转染细胞 OPN表达比较Hep-2、Hep-2-LV-shOPN和 Hep-2-LV-shNone细胞OPN 的相对表达量分别为0.60 ±0.01、0.15 ±0.02和0.54 ±0.02,Hep-2-LV-shOPN 细胞 OPN 的表达量较其他两种细胞明显下调(P均<0.01)。
2.3 Hep-2细胞及转染细胞的增殖活性 不同时间点 Hep-2、Hep-2-LV-shOPN、Hep-2-LV-shNone细胞的OD值比较见表2。
2.4 Hep-2细胞及转染细胞侵袭力比较 穿过聚碳酸酯膜的 Hep-2、Hep-2-LV-shOPN和 Hep-2-LV-shNone的细胞数分别为(60.66 ±0.88)、(25.33 ±0.88)和(58.33 ±0.79)个,穿过聚碳酸酯膜的 Hep-2-LV-shOPN细胞数较其他两种细胞明显减少(P均<0.01)。
表2 不同时间点三种细胞的OD值比较(±s)
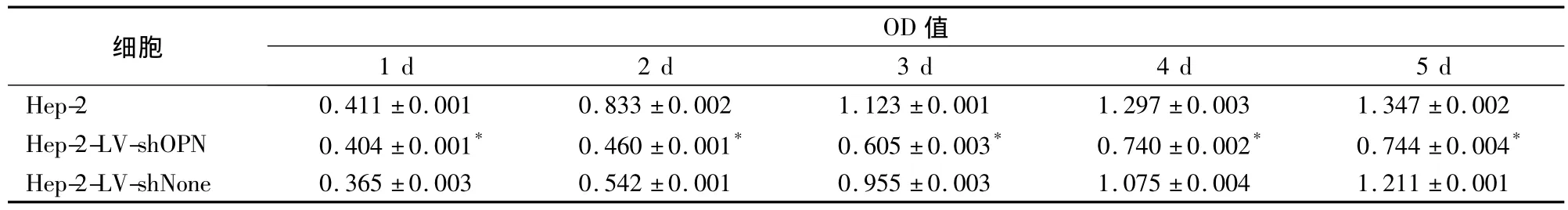
表2 不同时间点三种细胞的OD值比较(±s)
注:与 Hep-2、Hep-2-LV-shNone细胞相比,*P <0.05
细胞OD值1 d 2 d 3 d 4 d 5 d Hep-2 0.411 ±0.001 0.833 ±0.002 1.123 ±0.001 1.297 ±0.003 1.347 ±0.002 Hep-2-LV-shOPN 0.404 ±0.001* 0.460 ±0.001* 0.605 ±0.003* 0.740 ±0.002* 0.744 ±0.004*Hep-2-LV-shNone 0.365 ±0.003 0.542 ±0.001 0.955 ±0.003 1.075 ±0.004 1.211 ±0.001
3 讨论
OPN在多种肿瘤患者的血浆中高表达[3],因此被认为是肿瘤转移相关基因蛋白。OPN在肿瘤中高表达与乳腺癌、甲状腺癌、胃癌、肝癌、直肠癌的发生发展和侵袭转移密切相关[4~7],它能够反映肿瘤恶性程度及转移侵袭能力。
Celetti等[8]研究发现,LSCC 患者血清中 OPN过度表达。本研究发现,LSCC组织中OPN的阳性表达率明显高于癌旁正常组织,OPN的表达与LSCC临床分期、分化程度、淋巴结转移有关,OPN阳性表达者恶性程度高、侵袭力强、易发生转移。提示OPN可作为LSCC的标志物及侵袭转移能力的判断指标之一。
RNAi是转录后水平的基因沉默技术,可特异地下调靶基因的表达。该技术能快速、高效地阻滞肿瘤细胞或组织中异常、突变蛋白的表达。相对于基因敲除、反义寡核苷酸干扰等技术,RNAi技术具有操作更简单、抑制作用更完全、特异性更高等特点。本研究在体外将OPN基因的RNAi慢病毒载体转染喉癌Hep-2细胞,该细胞中OPN的表达下调,其增殖活性及侵袭力被抑制。这一结果为以OPN为靶点的喉癌基因治疗提供了理论依据。
[1]Shevde LA,Das S,Clark DW,et al.Osteopontin:an effector and an effect of tumor metastasis[J].Curr Mol Med,2010,10(1):71-81.
[2]Kunath T,Gish G,Lickert H,et al.Transgenic RNA interference in ES cell-derived embryos recapitulates a genetic null phenotype[J].Nat Biotechnol,2003,21(5):559-561.
[3]Eto M,Kodama S,Nomi N,et al.Clinical significance of elevated osteopontin levels in head and neck cancer patients[J].Auris Nasus Larynx,2007,34(3):343-346.
[4]Briese J,Cheng S,Ezzat S,et al.Osteopontin(OPN)expression in thyroid carcinoma[J].Anticancer Res,2010,30(5):1681-1688.
[5]Chen RX,Xia YH,Cui JF,et al.Osteopontin,a single marker for predicting the prognosis of patients with tumor-node-metastasis stage I hepatocellular carcinoma after surgical resection[J].J Gastroenterol Hepatol,2010,25(8):1435-1442.
[6]Cui R,Takahashi F,Ohashi R,et al.Osteopontin is involved in the formation of malignant pleural effusion in lung cancer[J].Lung Cancer,2009,63(3):368-374.
[7]Wang X,Chao L,Ma G,et al.Primary breast carcinoma:association of mammographic calcifications with osteopontin expression[J].Radiology,2010,254(1):69-78.
[8]Celetti A,Testa D,Staibano S,et al.Overexpression of the cytokine osteopontin identifies aggressive laryngeal sqnamous cell carcinomas and enhances carcioma cell proliferation and invasiveness[J].Clin Cancer Res,2005,11(22):8019-8027.

