大黄素对2型糖尿病小鼠血糖、胰岛素水平的影响及机制探讨
宋 冰,刘学政
(1辽宁医学院附属第一医院,辽宁锦州121000;2辽宁医学院)
大黄素化学名为6-甲基-1,3,8-三羟基蒽醌,是从大黄属中药中分离后得到的主要有效单体。现代药理研究认为大黄具有纠正血脂代谢紊乱、抗炎、改善微循环、调节免疫等作用[1~3],但其是否有降血糖作用及其机制为何均不清楚。2011年1~3月,我们观察了大黄素对2型糖尿病KKAy小鼠血糖及胰岛素信号传导途径的影响。现报告如下。
1 材料与方法
1.1 实验动物分组与处理 SPF级自发性2型糖尿病KKAy小鼠40只,10周龄,体质量(35±2)g,均为雌性,自由摄食、饮水。动物室内设置12 h昼夜循环,并维持室温在(22±2)℃。用含10%蔗糖、10%脂肪的KKAy小鼠专用高能量饲料喂养。血糖均≥13.9 mmol/L。随机分为模型组,低、中、高剂量大黄素治疗组及吡格列酮治疗组,各8只。模型组灌服20 ml/(kg·d)无菌水;低、中、高剂量大黄素治疗组分别给予12.5、25、50 mg/kg大黄素灌胃;吡格列酮治疗组予1.95 mg/(kg·d)吡格列酮灌胃。均用药8周。
1.2 血糖、血清胰岛素检测及胰岛素敏感指数(ISI)计算方法 8周后用美国强生血糖仪及配套试纸测定各组小鼠空腹血糖(FPG),用放射免疫法分析法测定空腹血清胰岛素(FINS),ISI=1/(FPG×FINS),取自然对数正态化后进行分析。
1.3 肌肉及脂肪组织磷酸肌醇3-激酶(PI3-K)及葡萄糖转运蛋白(GluT)4基因的检测方法 采用RT-PCR法。按Trizol试剂使用说明书标注的操作步骤提取组织中总RNA,然后按照RT-PCR试剂盒说明书操作分别检测PI3-K及GluT4基因的表达。各基因引物序列为:β-actin:正义:5'-ATCATGTTTGAGACCTTCAACA-3', 反 义: 5'-CATCTCTTGCTCGAAGTCCA-3',产物长度308 bp;GluT4:正义:5'-ACTGGCACTTCCACTGAACTCTTG-3',反 义:5'-TTTCTGCTCCCTATCCGTTCTT-3',产物长度388 bp;PI-3K,正义:5'-GTTGCTCTACCCAGTGTCCAAATACCAG-3',反义:5'-TTTCTGCTCCCTATCCGTTCTT-3',产物长度200 bp。实时定量PCR扩增条件:96℃预变性2min后,96℃变性45 s,59℃退火45 s,70℃延伸45 s,70℃延伸5min,共35个循环。结果以PI3-K、GluT4与β-actin的Ct值之比表示。
1.4 统计学方法 采用SPSS15.0统计软件。计量资料以±s表示,组间比较用方差分析。P≤0.05为差异有统计学意义。
2 结果
各组小鼠 FPG、FINS、ISI见表1。由表1可见与模型组比较,低、中、高剂量大黄素治疗组和吡格列酮治疗组小鼠的FPG、FINS、ISI均明显降低(P均<0.05),且呈剂量依赖性 。高剂量大黄素治疗组组FINS、ISI均高于吡格列酮治疗组(P均<0.05)。各组小鼠肌肉及脂肪组织中PI3-K及GluT4 mRNA见表2。由表2可见,与模型组相比,低、中、高剂量大黄素治疗组及吡格列酮治疗组小鼠的PI3-K、GluT4 mRNA明显增高(P均<0.05)。
表1 各组小鼠 FPG、FINS、ISI(±s)
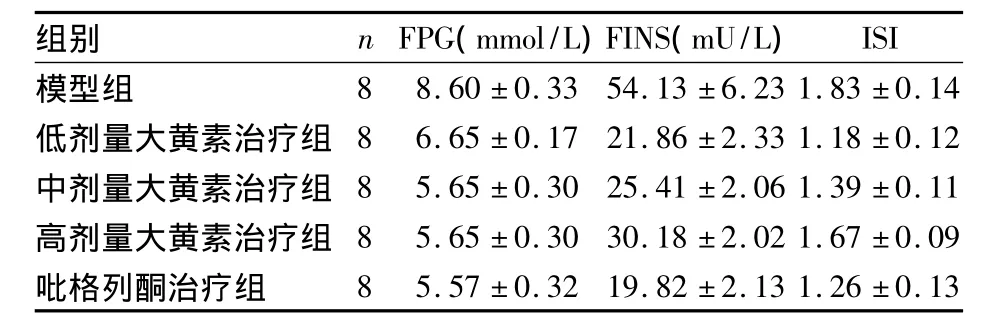
表1 各组小鼠 FPG、FINS、ISI(±s)
组别 n FPG(mmol/L)FINS(mU/L)ISI模型组8 8.60 ±0.33 54.13 ±6.23 1.83 ±0.14低剂量大黄素治疗组 8 6.65 ±0.17 21.86 ±2.33 1.18 ±0.12中剂量大黄素治疗组 8 5.65 ±0.30 25.41 ±2.06 1.39 ±0.11高剂量大黄素治疗组 8 5.65 ±0.30 30.18 ±2.02 1.67 ±0.09吡格列酮治疗组8 5.57 ±0.32 19.82 ±2.13 1.26 ±0.13
表2 各组小鼠PI3-K及GluT4 mRNA(±s)

表2 各组小鼠PI3-K及GluT4 mRNA(±s)
组别 n PI3-K mRNA GluT4 mRNA模型组8 1.08 ±0.27 0.17 ±0.07低剂量大黄素治疗组 8 2.16 ±1.29 0.39 ±0.15中剂量大黄素治疗组 8 3.35 ±1.19 0.48 ±0.18高剂量大黄素治疗组 8 4.38 ±1.26 0.61 ±0.19吡格列酮治疗组8 5.43 ±1.51 0.59 ±0.13
3 讨论
胰岛素主要是靠其与靶细胞膜表面的胰岛素受体结合,然后通过受体后信号的转导,调节代谢和基因的表达而实现其生理功能。胰岛素对代谢功能的调节主要通过胰岛素受体底物(IRS)/PI3-K信号转导途径完成的。胰岛素信号传递受阻或者减弱是导致胰岛素抵抗的根本原因。目前,其发生主要以受体后水平的变化最为多见[4,5]。常见的受体后水平缺陷有GluT、IRSs或PI3-K异常等。胰岛素与靶细胞表面的受体结合后,与其上的胰岛素受体α亚单位相结合,并激活其β亚单位的内在激酶的活性,而导致胰岛素受体的自磷酸化。磷酸化的胰岛素受体与PI3-K的P85调节亚单位结合,催化p110进而激活PI3-K,使蛋白激酶B的丝氨酸残基磷酸化,最终导致GluT4从胞内移位至胞膜进而促进葡萄糖的利用。众多研究表明,GluT4表达和活性的下降而引起的骨骼肌和脂肪细胞对葡萄糖摄取、利用的减少是胰岛素抵抗产生的重要分子基础[6~10]。
本研究结果提示,10周龄KKAy糖尿病小鼠存在典型的胰岛素抵抗,大黄素治疗后可以降低血糖、血脂和炎症因子生成,改善胰岛素抵抗。同时,大黄素能够上调PI3-K、GluT4 mRNA表达,表明大黄素具有良好的降血糖、降低胰岛素水平和提高胰岛素敏感度作用,其机制可能与PI3-K、GluT4基因有关。
[1]王冰,李宏亮,杨文英.胰岛素信号转导通路与β细胞分泌功能的关系的机制[J].中日友好医院学报,2008,38(1):57-62.
[2]孟晓云,陈跃.葡萄糖转运蛋白的调控与疾病[J].医学综述,2008,25(14):2097-2100.
[3]李淑娟,黄晓华,武海霞,等.大黄及其有效成份药理作用研究进展[J].医学综述,2005,22(11):76-78.
[4]YangY,ShangW,Zhou L,et al.Emodinwith PPARgamma ligandbinding activity promotes adipocyte differentiation and increases glucose uptake in 3T3-Ll cells[J].Biochem Biophys Res Commun,2007,353(2):225-230.
[5]李光伟,潘孝仁,Lillioja S,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,13(10):656.
[6]Mita T,Goto H,Azuma K,et al.Impact of insulin resistance on enhanced monocyte adhesion to endothelial cells and atherosclerogenesis independent of LDL cholesterol level[J].Biochem Biophys Res Commun,2010,395(4):477-483.
[7]Chen R,Liang F,Morimoto S,et al.The effects of a PPARalpha agonist on myocardial damage in obese diabetic mice with heart failure[J].Int Heart J,2010,51(3):199-206.
[8]Khan AH,Capilla E,Hou JC,et al.Entry of newly synthesized GLUT4 into the insulin responsive storage compartment is dependent upon both the amino terminu and the large cytoplasmic loop[J].J Biol Chem,2004,279(36):37505-37511.
[9]Koch C,Augustine RA,Steger J,et al.Leptin rapidly improves glucose homeostasis in obese mice by increasing hypothalamic insulin sensitivity[J].Eur J Neurosci,2010,30(48):16180-16187.
[10]Han JW,Zhan XR,Li XY,et al.Impaired PI3K/Akt signal pathway and hepatocellular injury in high-fat fed rats[J].World J Gastroenterol,2010,16(48):6111-6118.

